八年级科学/第一节:元素
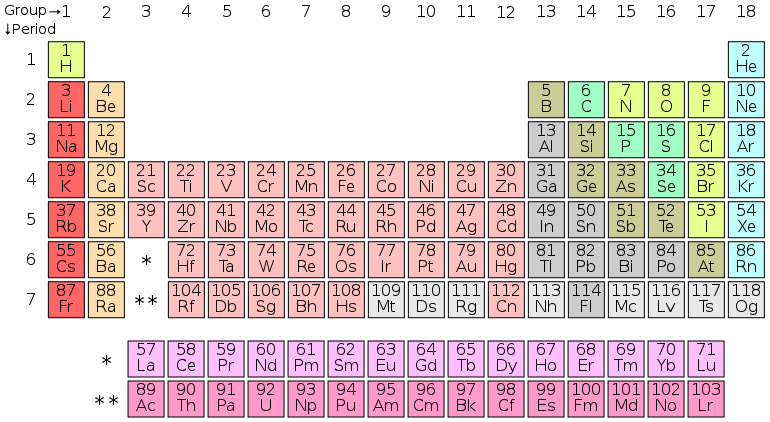
元素周期表中的元素都是构成物质宇宙结构基础的不同类型的原子。目前已知有超过 100 种元素。元素根据其质子数进行编号,因为这是赋予每个原子其独特性质的原因。每个原子都包含一个原子核,原子核周围环绕着带负电的电子云。原子核由带正电的质子和不带电的中子组成。对于每个质子,都存在一个相互作用的电子,这意味着所有元素都不带电。例如,宇宙中最常见的元素是氢。氢有 1 个质子、1 个电子和 1 或 2 个中子。由于它有 1 个质子,所以在元素周期表中它被赋予了数字 1。
每个元素周围轨道的电子不仅决定了它在周期表中的位置,还决定了它如何与其他元素相互作用。每个元素都有一组围绕其运行的电子轨道,根据电子的数量和它们占据的轨道,决定了它与什么共享它的电子。元素周期表按这种方式划分是为了区分电子不足的元素(左侧;碱金属和碱土金属),也电子不足但都有不完整的 d 轨道(中间;过渡金属),电子丰富的元素(右侧;非金属)。还有一个特殊的族被称为惰性元素。这些元素形成了一个完整的外部电子层,这使得它们除了在特殊情况下无法与任何东西发生反应。
如前所述,每个元素都有一团电子围绕它,根据该数量决定了它的行为方式以及它如何与其他元素相互作用。每个原子的第一个环在填充了两个电子时是稳定的。此后每个环通常必须有八个电子才能稳定。自然界试图以最小的努力获得平衡。具有少于四个电子的原子将尝试将除了第一个环之外的任何环都清空。另一方面,具有超过四个电子的原子将尝试填满最外层的环。这被称为八面体规则或八隅体规则。氢的原子序数为 1,这意味着它有一个质子,因此有一个电子。这个电子填充了 s 轨道的一半。每个围绕元素运行的电子对都需要一个“自旋向上”而另一个电子“自旋向下”来为原子创造稳定性。化学的一个重要规则是,一切都想找到最稳定的状态。当原子的外层电子层(称为价层)充满时,原子是稳定的。由于氢只有一个电子,氢原子通常与其他氢原子结合。像这样自然地与自身结合的元素被称为双原子元素,来自希腊语“Di”,意思是两个。
氢之后的下一个元素是氦。氦的原子序数为 2,有两个电子填充 s 轨道。因为第一个环只需要两个电子,所以氦非常稳定。氦不仅非常稳定,而且与它共享一个列的所有元素也都共享这种完整的轨道构型,因此也很稳定。这些元素是惰性元素,如上所述。当您沿着元素周期表向下移动(原子序数增加)时,p 和 d 轨道等更多轨道被填充。电子按如下方式分布(以引导数字表示轨道数,以最后一个数字表示电子数):1S2 2S2 2P6 3S2 3P6 4S2 3D10 4P6 4D10 4F14 沿途偶尔会有例外,关于偶尔元素的电子分布方式,否则元素周期表是一个很好的方法,可以根据表格中的趋势快速确定元素的轨道。