- 另请参阅:关于烯烃和绘制烯烃的信息
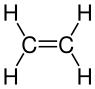
烯烃分子是不饱和的烃,因为它们比具有相同碳原子数的烷烃少2个氢原子,并且也具有碳双键而不是全部单键。烷烃是饱和的烃。您可以通过溴试验来区分饱和和不饱和烃。
在空气中,氧气不足以使烯烃完全燃烧,完全燃烧只会产生二氧化碳和水(与烷烃的完全燃烧相同)。与其他燃烧反应一样,这是一个放热反应;会释放能量。相反,它们在空气中燃烧会产生冒烟的黄色火焰

形成的精确产物取决于氧气的含量,因此您可能会有没有碳产生的反应。以下是在存在少量氧气的情况下戊烯(5个碳)的不完全燃烧的示例

或者您也可以使用相同的反应

但是碳允许您更容易地平衡它,因此是首选选择。
烯烃与氢气、水和卤素反应,通过在  处添加原子,使双键变为单键。
处添加原子,使双键变为单键。
烯烃与氢气反应时可以转化回烷烃。以下是以丙烯为例

请记住,烷烃和烯烃的通式之差是2个氢原子。您还需要能够绘制显示式
如我们所见,烯烃的官能团(同系物系列的特征结构,赋予其所有特殊性质)碳双键被转化为与氢气的单键。但是,这种反应只能在催化剂的存在下进行。
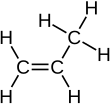
卤素也会去除烯烃官能团。以下是以乙烯和溴为例的化学式

文字方程式有助于理解发生了什么

“二”指的是化合物中存在两个溴原子,而“-烷”则表示不再存在碳双键;它具有与烷烃相同的官能团(所有单键)。结构式如下:
 + Br—Br → + Br—Br →  |
| 乙烯 + 溴 → 二溴乙烷 |
正如我们所见,这与氢化几乎相同,只是我们使用的是卤素。这也解释了为什么溴试剂有效,因为溴水中溴原子会发生反应形成新化合物,而它们不会与烷烃反应。
醇是具有羟基官能团(-OH)的饱和烃同系物。当烯烃与水反应(需要催化剂的存在)时,我们可以形成醇。例如:
我们可以很容易地算出醇的化学式,因为我们知道末端的官能团(必须存在-OH),并且所有碳和氢必须平衡。产物称为丁醇,其中“-醇”表示它是醇。上面显示了结构式:与烷烃结构相比,醇结构唯一的区别是氧原子,正如我们所见。
有时,醇的写法略有不同,以反映其结构。例如
 是乙醇的化学式,也可以写成
是乙醇的化学式,也可以写成  。
。 指的是化合物的其中一端,
指的是化合物的其中一端, 指的是中间的碳链,而
指的是中间的碳链,而 表示官能团。醇的一般式为
表示官能团。醇的一般式为

所有醇类都可溶于水,其溶液呈中性 pH 值。由于其溶解性,它们常被用作工业溶剂。较小的醇类也被用作燃料,例如乙醇被用作酒精灯燃料。然而,它(乙醇)最常见的用途是在酒精饮料中。
醇类是易燃的,在空气中燃烧时会发生完全燃烧



醇类可以被氧化(添加氧气)形成羧酸,这些反应发生在与燃烧不同的条件下。
当糖溶液在酵母酶的作用下发酵时,会产生乙醇的水溶液。
![{\displaystyle {\ce {C6H12O6 ->[yeast] 2C2H5OH + 2CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9523e86482fc03cf80f0892d303b94d66ece4598)
这表明葡萄糖,一种简单的糖,被转化为乙醇和二氧化碳。该反应需要厌氧(无氧)条件,相当高的温度(37 摄氏度)和略微酸性的 pH 值。
羧酸具有  的官能团,其名称以“-酸”结尾。它们的结构图类似于醇类,不过添加了一个碳氧双键。以下是丁醇和丁酸的比较
的官能团,其名称以“-酸”结尾。它们的结构图类似于醇类,不过添加了一个碳氧双键。以下是丁醇和丁酸的比较
正如我们所看到的,2 个氢原子被移除并被一个氧双键取代。羧酸的一般式为

重要的是要注意,对于第 n 项,我们使用不包含在官能团中的碳原子,因此,虽然丁酸有 4 个碳原子,但它有 3 个碳原子不属于官能团,从而得到以下公式

另一种写法是

像任何其他酸一样,羧酸与碳酸盐反应生成盐、水和二氧化碳
羧酸能够溶于水。但是,当它们溶解时,它们会电离,释放 H+ 离子,从而形成弱酸性溶液,因为它们不会完全电离。
羧酸与酸性催化剂反应生成酯(一种新的同系物)和水。


从化学方程式中可以看出,酯在一端具有相同的  ,以及
,以及  ,就像羧酸一样。但是,氢被移除并被醇的烃链
,就像羧酸一样。但是,氢被移除并被醇的烃链  取代。因此,酯被称为乙酸乙酯(醇是 -yl,羧酸是 -anoate)并不奇怪。但是,绘制酯可能会很棘手
取代。因此,酯被称为乙酸乙酯(醇是 -yl,羧酸是 -anoate)并不奇怪。但是,绘制酯可能会很棘手
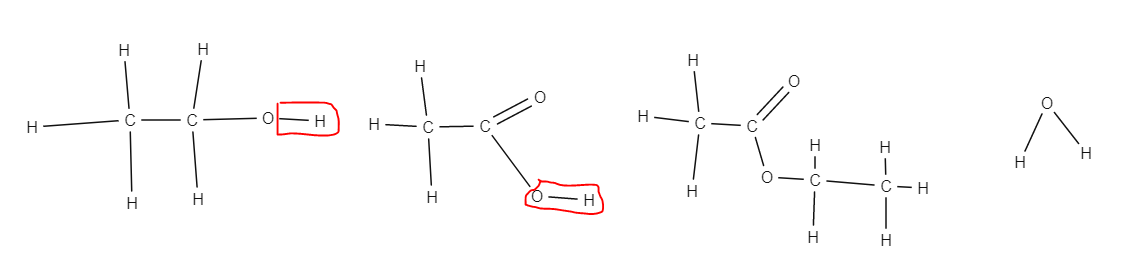
绘制酯的最简单方法是首先绘制没有 OH 的羧酸。然后,您将醇添加到与碳连接的碳上,并完成醇的结构,除了氢。这些原子结合产生由反应生成的的水。
| 能量的定义是什么?
|
| 系统(物体或物体组)可能发生的能量变化的最大值 |
| 能量储存的两种主要类型是什么?它们之间有什么区别?
|
| 与运动相关的能量储存(动能)和与物体在空间中的位置相关的势能储存。 |
| 比热容是什么?
|
| 使 1 公斤物质升温 1 摄氏度所需的能量。 |
 +
+ 
 + Br—Br →
+ Br—Br → 
 +
+ 


















![{\displaystyle {\ce {C6H12O6 ->[yeast] 2C2H5OH + 2CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9523e86482fc03cf80f0892d303b94d66ece4598)










