A-level 应用科学/颜色化学/颜色
有色化学物质吸收光谱可见部分的电磁波。吸收的能量
导致分子电子能量的变化。电子从“基态”
变为“激发态”。
大多数跃迁不是由可见光引起的。许多吸收紫外线
辐射。吸收紫外线辐射的化学物质是无色的(除非它们发出荧光)。
有色化合物和无色化合物的分子在能量变化方面如下图所示
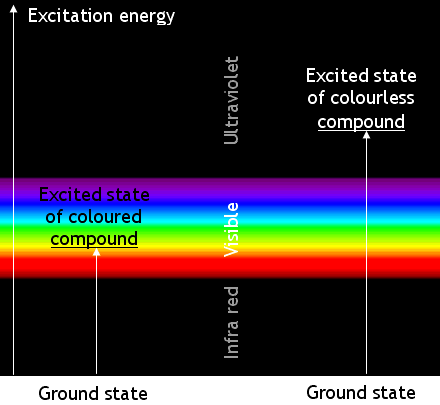
请记住,表观颜色是由吸收互补色光子引起的。A
蓝色化合物是蓝色的,因为它吸收黄光。

具有与可见光相对应的激发态的化学结构称为
生色团。主要有两种类型
1. 过渡金属配合物。
过渡金属形成复杂离子——金属与小分子结合
或称为配体的阴离子。配体使金属离子的电子进入激发态
如果电子吸收可见光光子。
例如四氯合铜(II)离子和六水合铜(II)离子
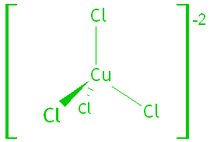
过渡金属化合物的部分填充的 d 轨道在赋予颜色方面很重要
过渡金属配合物。见图(可以表示 V+2,Cr+3,
Mn+4 等)

①. 在未络合的离子中,所有 d 轨道具有相同的能量。
②. 当配体包围离子时,配体的负电荷使 d 轨道
不稳定(能量更高)。
③. 关键是,配体将比其他配体更靠近某些 d 轨道。通常,
两个或三个轨道比其余轨道更不稳定。
一个处于较低 d 轨道的电子可以获得能量激发到较高
d 轨道

这种机制使过渡金属配合物能够吸收可见光光子。
2. 共轭/离域电子体系。
当单键和双键交替出现时,双键中的电子可以进入激发态
如果它们吸收可见光光子。例如 β-胡萝卜素(上图)有十个共轭 C=C 键
上图显示了共轭醛的激发能。n 是 C=C 的数量
共轭的双键。最简单的(n=1)是 CH3-CH=CH-CH=O。
注意,激发能随着共轭键数的增加而降低。
| n | 波长(nm) | 能量 (kJ mol−1) |
| 1 | 220 | 544 |
| 2 | 270 | 443 |
| 3 | 312 | 384 |
| 4 | 343 | 349 |
| 5 | 370 | 324 |
| 6 | 393 | 305 |
| 7 | 415 | 289 |
染料分子的生色团通常包含 >C=O 和 -N=N- 等不饱和基团,它们是
共轭键体系的一部分,通常涉及芳香环。金黄色素,一种
碱性染料,如下所示

注意 -N=N- 基团只是共轭体系的中心,该体系延伸到所有
十二个碳原子,包括七个双键。所有
偶氮染料都包含 -N=N- 排列。
助色团:连接到生色团的是两个 -NH2 基团,它们与
生色团相互作用以改变橙色。连接到生色团的一组原子,
修改该生色团吸收光的能力称为助色团。它们可以修改
或增强染料的颜色。示例:-OH,- NH2,醛。
添加的官能团也可以
- 改变染料在水或其他溶剂中的溶解度。
- 将染料分子结合到布料、纸张或其他基材上。

- ↑ Streitwieser, A & Heathcock, CH (1985) 有机化学导论(第 3 版)第 628 页,Macmillan,纽约



