A-level 应用科学/合成有机化合物/实践
| 在尝试本页中的任何内容之前,请阅读华夏公益教科书:风险免责声明。本页中的部分信息可能不正确、未经验证且存在危险。华夏公益教科书、WMF 和贡献者 对本页内容不承担任何责任。 |
此处提供的实验细节是出于善意,并且被认为是安全且可行的。但是,作者对执行这些实验的后果不承担任何责任。
这些实验是为经验丰富的科学教学人员编写的,作为受监督的学生班级的指导。这些实验不是为没有监督的学生或公众中没有经验的人设计的。如果您想尝试这些实验,请确保您事先完成了法律上充分的风险评估,并且在风险评估的限制范围内工作。
您的作品集要求您提供两份实践报告。一份是固体,另一份是液体。这两种化合物应使用不同的反应制备。以下四种制备方法涵盖了这些标准,并且旨在使前两种制备方法提供经验,这些经验将帮助您熟练地完成最后两种实验。
| 氧化 | 缩合 | |
| 固体 | 苯甲酸 | 阿司匹林 |
| 液体 | 乙醛 | 乙酸乙酯 |
如何使用此模板:文本包含提示、清单和建议。根据提示,用您自己的实验说明替换此文本。
解释这份报告的主题,以及您是如何在报告中包含有关有机化合物和一般反应的信息,以及对红外光谱的讨论。
涉及的有机化合物
- 命名
- 结构
- 元素的电负性和分子的极性。
- 官能团
- 物理性质,如沸点/熔点、在水中的溶解度、健康和安全数据。
- 形状
- 反应类型 - 对反应类型进行分类
- 给出平衡方程式,并描述反应所需的试剂和条件。
- 光谱 - 光谱告诉我们有关分子哪些信息。
详细说明有机反应物和产物的结构和性质(如熔点/沸点、红外光谱)。
包括通过研究发现的方法的副本。
注解描述方法的主要特征 - 正在进行哪些类型的反应?净化方法是如何工作的?
根据文献方法和可用资源,建议一种方法。
包括您程序的风险评估。
计算预期产物的最大产率。
讨论如何使用光谱来评估程序(例如,反应物污染产物)。
您的老师将必须写一份声明,评估您执行制备的安全性和熟练程度。
应记录完整的观察结果和大量数据,并且测量值应尽可能精确。
数据应清晰、逻辑地呈现 - 如果合适,请考虑使用表格、图表和图形。
根据产物的质量,计算产率。
根据产物的熔点/沸点,推断其纯度。
总结您的工作的主要要点。
提出建议,以改进实验以获得更多/更纯的产物。
包括您所使用过的每个信息来源的参考资料。
在使用来自该来源的信息时,请记下该来源(例如,在光谱出现在您的报告中的位置旁边简要显示光谱的来源,然后在参考文献中完整地引用该来源)。
乙醇可以在酸性溶液中被重铬酸根(VI)离子氧化。氧化反应的第一个产物是乙醛,它可以被进一步氧化形成乙酸。通过小心地改变反应方法,可以得到其中的一种或另一种产物。
乙醛的制备应在通风橱中进行。
- 重铬酸钠 (VI)
- 乙醇
- 乙醛(产物)
- 浓硫酸
- 防暴沸颗粒
- 去离子水
佩戴护目镜和实验服。
制备乙醛时,在通风橱中操作。
取用浓硫酸时,戴手套。
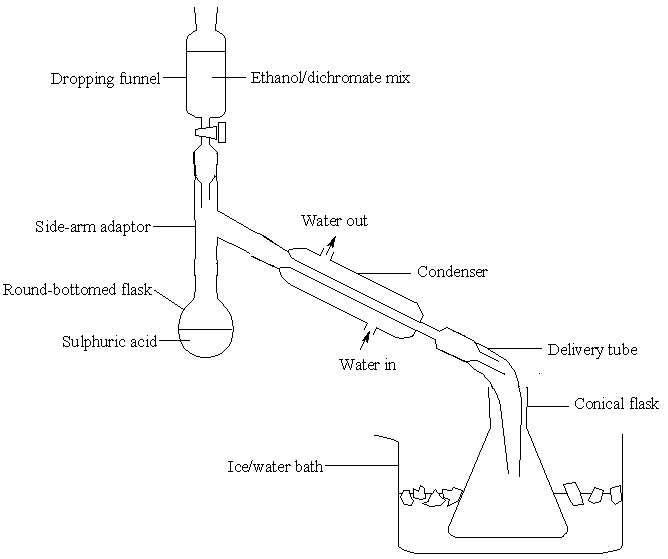
在圆底烧瓶中,先加入 50 cm³ 去离子水,然后缓慢加入 17 cm³ 浓硫酸,边加边摇动。最后,在烧瓶中加入一些防暴沸颗粒,并按如下所示装置设置装置。
冷凝管周围应有快速的水流。如果你不确定,请向你的讲师咨询如何调节水流 - 在橡胶管中很容易产生过大的压力。将 50 g 重铬酸钠 (VI) 溶解在 50 cm³ 去离子水中,然后加入 40 cm³ 乙醇。充分混合,将混合物加入上述装置中的滴液漏斗中。确保滴液漏斗的活塞先关闭。
加热烧瓶中的酸,直到它轻轻地沸腾,然后关闭热源。
缓慢加入乙醇/重铬酸盐混合物:用 20 分钟时间加入整个样品。反应剧烈,一开始会使混合物沸腾。在反应的后期阶段,你需要加热混合物以保持它轻轻沸腾。
当反应在圆底烧瓶中进行时,乙醛溶液将在锥形瓶中收集。
小心地注意其特征气味。塞住锥形瓶,并将其保存在冰水中。如果有时间,取样并使用银镜、2,4-DNPH 或碘仿测试进行测试。
2-羟基苯甲酸(“水杨酸”)与乙酸及其衍生物反应生成 2-乙酰氧基苯甲酸(“阿司匹林”)。
- 圆底“快速连接”烧瓶
- 真空过滤装置
- 回流冷凝器
- 冰浴
- 烧杯,100 cm³
- 加热套
- 天平
- 表面皿
- 2.0 g 2-羟基苯甲酸(“水杨酸”)
- 3.0 cm³ 乙酸酐
- 85% 磷酸 (V) 5 滴
- 始终佩戴护目镜和实验服。
- 使用本生灯时,将长发扎起来。
- 称取约 2.0 g(准确称量)2-羟基苯甲酸(“水杨酸”),加入圆底“快速连接”烧瓶中。
- 小心地向烧瓶中加入 3.0 cm³ 乙酸酐。
- 再次小心地加入 85% 磷酸 (V) 5 滴,轻轻旋转以混合烧瓶内容物。
- 使用加热套,将混合物轻轻回流 5 分钟。
- 5 分钟后,立即小心地将 2.0 cm³ 水沿着垂直冷凝管加入。注意:这将产生剧烈反应。
- 反应结束后,小心地将烧瓶内容物倒入一个小烧杯中 40 cm³ 冷水中。
- 让烧杯内容物冷却,如果结晶没有立即发生,用玻璃棒刮擦烧杯的内壁。
- 结晶开始后,将烧杯及其内容物放在冰浴中冷却。
- 使用抽滤(真空)过滤固体产物,并用少量冷水洗涤固体。
- 从少量热水中重结晶产物,按上述方法过滤和洗涤。
- 将材料在空气中干燥,将其刮到一个预先称重的表面皿上,并测定产物的质量。
- 测定产率。
- 进行熔点测定。
- 发生了什么类型的反应?形成了什么类型的键?
- 磷酸的作用是什么?
- 乙酸酐和乙酸之间的关系是什么?
- 查找并写一个简短的关于阿司匹林如何制造的说明。2-羟基苯甲酸是如何制成的?
- 快速连接:圆底烧瓶(2x100 cm³)
- 冷凝器
- 接收器适配器
- 滴液漏斗
- 蒸馏头
- 温度计套管
- 4x 防暴沸颗粒
- 锥形瓶(50 cm³)和橡胶塞
- 量筒(10,100 cm³)
- 温度计(110oC)
- 漏斗和折叠滤纸
- 加热套
- 称量秤
- 碳酸钠 12.2cm3(30% 溶液)
- 氯化钙(颗粒状)12.5cm3
- 硫酸(浓)5cm3
- 乙酸(浓)25cm3
- 乙醇 25cm3
- 乙酸乙酯(产物)
1. 在一个圆底烧瓶中,加入乙醇 (25 cm³) 和冰乙酸 (25 cm³)。缓慢加入浓硫酸 (5 cm³),边加边冷却和摇动。确保每次添加后混合物均质。加入一些防暴沸颗粒,并将混合物在回流状态下煮沸约 10 分钟。
2. 重新排列装置,蒸馏掉约三分之二的混合物。将馏出液转移到分液漏斗中。
3. 加入碳酸钠溶液 (25 cm³) 并小心摇动。(参见问题 2)。
4. 定期倒置漏斗并打开活塞以释放压力。让液体沉淀并分离两层。丢弃水层(问题 3 - 确保保留正确的层!)。
5. 向漏斗中的有机层中加入氯化钙溶液(12.5 g 无水 CaCl2 在 12.5 cm³ 水中)并剧烈摇动(问题 4)。让液体分离并流出,丢弃下层水层。将乙酸乙酯流入一个小锥形瓶中,并加入少量颗粒状氯化钙。静置约 10-20 分钟,偶尔摇动(问题 5)。
6. 将液体通过折叠滤纸过滤到烧瓶 (100 cm³) 中,加入一些防暴沸颗粒,并安装蒸馏装置。
7. 丢弃在 35-40oC 范围内蒸馏出的馏分(问题 6)。
8. 收集在 74 - 79 oC 范围内蒸馏出的馏分。
9. 记录最终产物的颜色和气味。
- 为什么要将混合物煮沸,为什么要在回流状态下煮沸?
- 说明加入碳酸钠时观察到的现象,并解释为什么使用它。
- 你如何判断哪一层是水层?
- 氯化钙在此阶段的作用是什么?
- 氯化钙在此阶段的作用是什么?
- 在该温度范围内可能会蒸馏出什么?
- 记录你的产率并计算你的产率百分比。
氧化反应是有机化学中非常重要的一类反应。大多数氧化反应需要处于还原状态的杂原子(O in -OH、N in -NH2 等)或碳-碳 π 键。
芳香环侧链的氧化不需要这些因素。只需要一个苄基碳,该碳至少与一个氢原子相连。可用于氧化的试剂有重铬酸(在硫酸和水中使用 Na2Cr2O7 或 CrO3)或高锰酸钾 (KMnO4)。每种情况下产物都是苯甲酸或苯甲酸衍生物。高锰酸钾反应需要用酸进行后处理,因为高锰酸钾反应会生成碱性溶液作为副产物)。
- C6H5CH3 + 2 KMnO4 → C6H5COOK + 2 MnO2 + H2O + KOH
我们将使用高锰酸钾将甲苯 (甲苯) 氧化成苯甲酸。与含铬化合物相比,高锰酸钾溶液危害较小,铬化合物通常具有致癌性。[2]
- 高锰酸钾 (高锰酸盐) 是一种强氧化剂,具有腐蚀性,操作时请戴手套(它也会染污皮肤和衣物)。
- 亚硫酸氢钠 (亚硫酸氢钠) 是一种刺激物——操作时请戴手套。
- 浓盐酸具有腐蚀性和毒性——操作时请戴手套,并确保在操作后清洗手套和双手。
- 甲苯 (甲苯) 是一种易燃液体,有毒,其蒸气具有麻醉性——实验室不允许明火,操作时请戴手套,避免吸入其蒸气。[2]
[2] 第一天:制备苯甲酸。
在 100 cm³ 圆底烧瓶中(这样液体量将不到反应容器容量的一半),混合以下物质:
- 3.0 g KMnO4(注意不要接触皮肤)
- 约 0.7 g 甲苯(约 0.8 cm³ 液体)
- 35 g(cm³)水。
将反应混合物回流(添加一些防爆沸颗粒)最多 4 小时。
回流时间少于此时间可能会导致高锰酸盐 (VII) 残留。由于甲苯的挥发性,需要对回流冷凝器进行有效的冷却。
- C6H5CH3 + 2 KMnO4 → C6H5OOK + 2 MnO2 + H2O + KOH [3]
停止,并将您的仪器留至下一节实验课,以便进行纯化。
第二天:分离苯甲酸
使用布氏漏斗进行抽滤(过滤热的溶液,但不要用冷水或热水洗涤)。收集滤液(通过滤纸的液体)。
不溶性的 MnO2 将被滤纸保留,而滤液被收集在抽滤瓶中。可以将其丢弃。
如果滤液仍然呈紫色(表明仍然存在 MnO4- 离子),将滤液转移到一个新的烧瓶中,如果仍然很热,则在冰浴中冷却。
缓慢加入少量固体亚硫酸氢钠 (NaHSO3) 以还原任何剩余的高锰酸盐离子。
小心操作,因为亚硫酸氢钠与高锰酸钾的反应是强放热的(释放热量)。
当不再出现紫色时(混合物将呈棕色悬浮液),表示您已添加了足够的亚硫酸氢钠。
当紫色不再出现时,将悬浮液在 3-4000 rpm 下离心 5 分钟。(在这个阶段形成的 MnO2 太细,无法有效过滤)。离心会使沉淀形成沉淀物,其余的溶液可以小心地倾倒。
如果溶液不是无色的(仍然呈紫色),则需要添加更多亚硫酸氢钠,并重复离心,以生成澄清溶液(轻微的棕色色调是可以接受的,但不能是紫色)。
将澄清无色的溶液(轻微的棕色色调是可以接受的)放入冰浴中。加入约 2.5 cm³ 浓盐酸使混合物酸化。逐滴添加酸,直到形成白色苯甲酸沉淀。(如果没有添加足够的酸,它可能会重新溶解)。只需 4-5 滴就足以使溶液酸化,并启动固体材料的形成。添加更多酸不会影响您的结果,因为您无法添加过量的酸。
- C6H5COOK + KOH + 2 HCl → C6H5COOH + H2O + 2 KCl [3]
使用真空过滤和布氏漏斗收集沉淀的有机产物。您可以在干燥前使用少量冷水洗涤固体材料并将固体从结晶容器中取出,放在表面皿上。
固体产物将被储存在干燥箱中,直到下一节实验课进行重结晶。
停止,并将您的固体材料储存在干燥箱中,直到下一节实验课进行纯化。如果您在本节实验课中无法生成固体材料,您可以将样品保存到下一节实验课。
第三天:重结晶和苯甲酸分析
纯化方法包括重结晶。有必要选择一种合适的溶剂,在该溶剂中
- 苯甲酸在高温下非常易溶,但在低温下难溶,并且...
- 杂质在任何温度下都不溶,或者....
- 杂质在任何温度下都可溶
满足本实验这些标准的溶剂是水。
这是一个如何记录工作的示例。重复此实验——或者如果你觉得能够改进,就改进它。请注意,并非所有数据都是为您记录的(例如,使用的热水量)。
苯甲酸收集在一个烧杯中(250 cm³)。
向烧杯中倒入少量水,并将混合物在本生灯上加热至沸腾。搅拌混合物以促进溶解。
并非所有的苯甲酸都溶解。加入更多水,保持混合物搅拌并微沸。重复此过程,直到所有苯甲酸似乎都溶解。
然后将混合物快速通过预热的布氏漏斗过滤。任何不溶性杂质将作为残留物留在滤纸上。
将滤液在冰浴中冷却,这会导致大部分苯甲酸结晶。可溶性杂质留在溶液中。
将混合物再次在泵上过滤,这次在冷的情况下进行。滤纸上的残留物是纯化的苯甲酸。
通过在残留物上浇少量去离子水以去除盐溶液来洗涤该残留物。在过滤后运行泵一小段时间,有助于干燥残留物。
然后小心地将残留物从滤纸上刮到表面皿上,并在 60 oC 的烘箱中干燥。干燥后,称量最终产品。
结果
苯甲酸的起始质量为 4.00 g
苯甲酸产品的质量为 3.50 g
通过确定熔点来分析苯甲酸。将您观察到的值与文献值进行比较。根据限制性试剂(甲苯)确定百分比产率。
显示甲苯中甲基碳、酸的羰基碳以及高锰酸根离子中的 Mn 和 MnO2 中的 Mn 的氧化态。
您可能希望记录实验的其他细节,这些细节不自然地属于任何其他类别,例如可能发生的错误;一些对您来说是新理论的理论;您可能希望记录以供将来参考的一些有趣的应用或细节等。