A-level 化学/AQA/模块 1/原子结构
希腊哲学家德谟克利特认为,所有物质都是由小的不可分割的粒子组成的,他称之为原子。原子这个词来源于希腊语 a,意思是“不”或“没有”,以及 tom,意思是“切割”。因此,原子这个词的意思是:不可切割。他理论化,如果一个人把一块奶酪切成两半,然后再次切成两半,再切成两半,等等,那么最终就会得到一块无法再分割的奶酪。这就是他的单个原子。
我们现在知道,原子是物质的最小部分,它保持自身的特性,尽管原子本身可以被细分。换句话说,一旦我们开始观察原子的内部,我们就不再能确定这个原子属于哪种元素。
原子本身包含一个中心的原子核,大部分质量集中在这里,电子围绕着这个原子核的外部运行。这个中心的原子核由质子和中子组成。这三种粒子的性质如下表所示。
| 粒子 | 相对电荷 | 相对质量 | 绝对电荷 | 绝对质量 |
|---|---|---|---|---|
| 质子 | +1 | 1 | ||
| 中子 | 0 | 1 | 0 | |
| 电子 | -1 | 0(可忽略,或约为 ) |
在中性原子或元素原子中,质子和电子的数量相等。这使得原子没有净电荷。
我们可以从原子的原子核中获得两条有用的信息。第一个是原子序数。这使我们能够识别原子是哪种元素。原子序数通常用字母 Z 表示,是原子核中质子的数量。正是它将元素放在元素周期表中。
第二个是质量数。它等于质子的数量加上中子的数量(记住,电子的质量可以忽略不计)。它用符号 A 表示。因此,原子中中子的数量等于质量数(A)减去原子序数(Z)。
有时,原子的质子数表明它是一种特定元素,但它的质量数与该元素的其他原子不同。具有相同质子数但质量数不同的原子被称为该元素的同位素。质量数的差异是由原子核中存在额外或更少的中子造成的。
由于质子(因此电子)的数量相同,这些物质的化学性质与标准元素的化学性质相同。物理性质(熔点/沸点等)确实会发生变化。
我们通常用元素名称后跟质量数来指代同位素。例如,质量数为 12(6 个质子和 6 个中子)的碳原子被称为碳-12。它用以下方式表示:
碳-14 是最有用的同位素之一。它是原子。它是放射性的,可以用来确定有机物质的年代,可以追溯到 60,000 年前!其他同位素在医学上用作示踪剂,以确定体内任何阻塞的位置。
质谱法是一种用来确定样品中各种同位素的相对丰度的技术。它可以分为四个阶段。
1. **汽化和电离** 将待分析的样品引入真空室。样品被汽化。如果接下来的步骤要成功,这一点至关重要。真空非常重要,因为要发射到样品上的电子必须有一个“畅通无阻”的路径。如果不在真空状态下,它们就会与空气分子发生碰撞。
现在对样品进行电离。为此,使用电子枪。本质上,它是一种向样品发射高能电子的装置。这些电子将样品中的电子撞出轨道,使其电离。样品中的粒子现在带正电,如下所示。
这两个方程展示了第一次电离阶段。然而,离子也有可能被第二个电子电离。这不太可能,因为第二次电离比第一次电离高得多,不太可能达到。这个罕见的事件由这个方程表示
2. **加速**
由于相反的电荷相互吸引,我们可以使用电场来移动粒子。这些粒子带正电(电子已被移除),因此我们使用带负电的电极板来加速粒子穿过机器。
3. **偏转**
我们现在使用电磁铁来偏转粒子。当粒子加速穿过磁场时,它们会改变方向。质荷比(m/z)大的粒子偏转量小,而质荷比小的粒子偏转量大。这将不同质荷比的离子分离。
4. **检测**
样品中的各种物质现在已经分离。粒子加速进入检测板。由于它们带电,在撞击检测板时会产生微弱的电流。记录下这种电流。检测时磁场的相对强度可以用来计算检测到的离子的 m/z 值。这使我们能够确定样品的组成离子。然而,无法区分具有相同 m/z 值的离子,因为它们将被相同地偏转!
此页面提供有关质谱的更多信息:http://www.chemguide.co.uk/analysis/masspec/howitworks.html#top.
相对质量
[edit | edit source]以下两个定义需要在模块一中学习,尽管它们一开始可能看起来很深奥。
相对原子质量 ()
[edit | edit source]
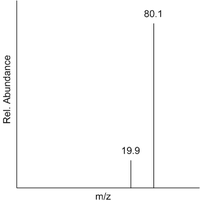
这可以通过将每个峰的 m/z 值乘以其相对丰度来从样品的质谱中计算出来。然后将此总和除以总相对丰度。以下是硼的质谱示例,其中两个峰分别代表 和 。
这也可以从表格中的数据计算出来,如铅的例子所示。
| m/z | 相对丰度 |
|---|---|
| 204 | 1.55 |
| 206 | 23.6 |
| 207 | 22.6 |
| 208 | 52.3 |
(这里需要注意的是,相对丰度加起来是 100.05,而不是 100。)
相对分子质量 ()
[edit | edit source]
这可以通过从质谱中获取最右侧峰的 m/z 值来计算,例如,氨的例子如下所示。
电子构型
[edit | edit source]在 GCSE 水平上,电子被呈现为围绕原子核运行的点状实体,第一个轨道可以容纳两个电子,第二个可以容纳八个电子,第三个可以容纳十八个电子。我们现在知道这并不完全准确,在 A 级需要一个更复杂的模型。
我们认为电子轨道位于主能级内的亚能级。每个亚能级能够容纳一个形状的轨道,用字母 s、p、d 和 f 表示。亚能级本身通常用它们可以容纳的轨道类型的字母来表示。例如,你不会说第四主能级的第三个亚能级,而是会说第四能级的 d 亚能级。
在下表中,你可以看到第三主能级的第三个亚能级 (d) 可以包含 5 个 d 型轨道。由于每个轨道最多可以容纳 2 个电子,这意味着这个亚能级可以容纳 10 个电子。
| 主能级 | 亚能级 | 电子 |
|---|---|---|
| n=1 | → 1 个 s 型轨道 | 2 |
| 能级中的最大电子数 | 2 | |
| n=2 | → 1 个 s 型轨道 | 2 |
| → 3 个 p 型轨道 | 6 | |
| 能级中的最大电子数 | 8 | |
| n=3 | → 1 个 s 型轨道 | 2 |
| → 3 个 p 型轨道 | 6 | |
| → 5 个 d 型轨道 | 10 | |
| 能级中的最大电子数 | 18 | |
| n=4 | → 1 个 s 型轨道 | 2 |
| → 3 个 p 型轨道 | 6 | |
| → 5 个 d 型轨道 | 10 | |
| → 7 个 f 型轨道 | 14 | |
| 能级中的最大电子数 | 32 | |
如表所示,每种类型的亚能级中的最大轨道数与其类型有关。一个 “s” 亚能级只能包含一个轨道 (2 个电子),一个 “p” 亚能级最多可以包含 3 个轨道 (6 个电子);一个 “d” 最多可以包含 5 个轨道 (10 个电子);一个 “f” 最多可以包含 7 个 (14 个电子)。
每个主能级的容量是其亚能级容量的总和。你可以看到,主能级的容量等同于 GCSE 电子壳层模型的更简单模型。
有一些规则需要了解这些轨道的填充方式。
- 轨道按表格的顺序从上到下填充。这是按能量升序排列的;也就是说,每个连续的能级(表格中越往下)比前一个能级具有更高的能量。
- 每个轨道必须在电子被放入下一个轨道之前被填满。例如,一个原子必须 *始终* 在其 1s 亚能级中有两个电子,然后才能将任何电子放入 2s 轨道。
对于 AQA A 级化学,你需要能够填充到 4s 能级的能级图。