A-level 化学/OCR (Salters)/光谱学
光谱学是研究辐射(电磁辐射或粒子辐射)与物质相互作用的学科。在化学理念中,第 6 章:辐射与物质全面阐述了光谱学。它涵盖了辐射与物质如何以及为什么相互作用,以及这些相互作用如何被应用。
Salters 高级化学中讨论了多种光谱技术。它们是
- 红外光谱(IR)
- 核磁共振谱(NMR)
- 紫外可见光谱(UV-Vis)
- 质谱(MS)
此外,化学故事线章节按设计着色中简要提到了激光显微光谱分析(LMA)。
科学家们每天使用许多其他光谱学方法,但这里提到的方法对整个化学领域而言最为重要。
我们将考虑物质颜色产生的主要原因:吸收光。物质还可以通过其他方式呈现颜色——例如,它可以散射或发射光——但这些效应最好在其他地方讨论。
物质之所以有颜色,通常是因为它们吸收了可见光中的某些能量,但透射或反射了其余能量。除了被吸收的能量之外,所有能量都会被我们的眼睛检测到。然后,我们的大脑将这种不同能量光子的分布解释为特定的颜色。
色轮有助于预测我们的大脑如何解释不同光子能量的分布。白光(例如阳光)包含所有可能能量的光子,即整个可见光谱。这种光子能量分布以我们感知为白色的方式刺激眼睛和大脑。
-
色轮 -
蓝色溶液吸收橙色光
-
无色溶液透射所有可见光
当我们在科学中谈论光时,通常指的是所有形式的电磁辐射。这不仅包括可见光,还包括整个电磁频谱,涵盖从 γ 射线到无线电波的一切。
电磁辐射由称为光子的粒子组成。任何特定光子都具有特定的能量,该能量决定了它的频率和波长。
所有物质中都存在电子,电子占据能级。所有物质中也包含能够容纳电子但未被占据的空能级。
物质中的电子可以从它所占据的能级移动到能量更高的空能级。这种移动需要电子获得精确数量的能量。如果光子具有该确切数量的能量,电子可以吸收该光子。通过吸收光子,电子能量恰好增加正确的数量,并移动到空能级。
吸收可见光的物质是那些具有两个能级的物质,这两个能级的能量差在可见光范围内,即 2.8 × 10−19 J − 5.0 × 10−19 J。这种物质可以吸收此能量范围的光子。
能量在 2.8 × 10−19 J − 5.0 × 10−19 J 之间的光子的波长在 700 纳米和 400 纳米之间,频率在 4.3 × 1014 赫兹和 7.5 × 1014 赫兹之间。
简而言之,
在过渡金属配合物中,我们可以更仔细地定义能级。能级指的是轨道。过渡金属配合物中的电子可以从它们正常的轨道移动到更高能量的轨道。
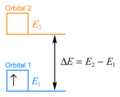
在它的正常轨道中,称为轨道 1,电子具有特定数量的能量,.
在更高能量的轨道中,称为轨道 2,电子具有更大的能量,.
两种情况之间的能量差为 .
-
轨道 1 被电子占据,而轨道 2 是空的 -
电子吸收具有正确能量的光子,并从轨道 1 跃迁到轨道 2 -
轨道 1 现在为空,轨道 2 被占据
当光子到达轨道 1 时,电子可能能够吸收该光子。
如果 ,光子能量不足以将电子从轨道 1 跃迁到轨道 2,因此电子无法吸收光子。
如果 ,光子能量过高,无法将电子从轨道 1 跃迁到轨道 2,因此电子无法吸收光子。
如果 ,光子能量恰好足以将电子从轨道 1 跃迁到轨道 2。电子可以并且确实吸收光子。电子获得光子的能量,并从轨道 1 跃迁到轨道 2。