分子生物学/细胞周期导论
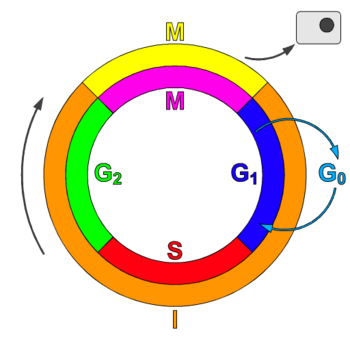
细胞周期,或称细胞分裂周期 (cdc),是指细胞中发生的一系列事件,最终导致细胞分裂和复制。在没有细胞核的细胞(原核生物)中,细胞周期通过称为二元分裂的过程进行。在有细胞核的细胞(真核生物)中,细胞周期可以分为两个简短的时期:间期——在此期间,细胞生长,积累有丝分裂所需的营养物质并复制其 DNA——以及有丝分裂 (M) 期,在此期间,细胞将自身分裂成两个不同的细胞,通常称为“子细胞”。细胞分裂周期是单细胞受精卵发育成为成熟生物体的必要过程,也是头发、皮肤、血液细胞以及一些内部器官更新的过程。[1]
细胞周期包含四个不同的阶段:G1 (Gap1) 期、S 期 (合成期)、G2 (Gap2) 期(统称为间期)和 M 期(有丝分裂期)。M (有丝分裂) 期本身由两个紧密耦合的过程组成:有丝分裂,在此期间,细胞的染色体在两个子细胞之间分配;胞质分裂,在此期间,细胞的胞质分裂成两半,形成不同的细胞。每个阶段的激活都取决于先前阶段的正常进展和完成。暂时或可逆地停止分裂的细胞被称为进入一种称为 G0 期的静止状态。[1]
暂时停止分裂的细胞被称为进入一种称为G0 期的静止状态。G0 期被认为是延长了的 G1 期,在此期间,细胞既不分裂也不准备分裂,或者是一种与细胞周期无关的独特静止阶段。G0 有时被称为“有丝分裂后”状态,因为 G0 期的细胞处于细胞周期外的非分裂阶段。一些类型的细胞,例如神经细胞和心肌细胞,在达到成熟期(即终末分化)时会进入有丝分裂后状态,但会继续执行它们的主要功能,直到生物体的生命结束。不发生胞质分裂的多核肌细胞通常也被认为处于 G0 阶段。有时,会在 G0 细胞和“有丝分裂后”细胞(例如心肌细胞和神经元)之间进行术语区分,前者永远不会进入 G1 期,而后者则可能进入 G1 期。[2]
间期的第一个阶段是 G1 期,从上一次有丝分裂期结束到 DNA 复制开始,称为 G1 期(G 代表间隙)。它也被称为生长期。在此阶段,细胞的生物合成活动在 M 期已大大减缓,现在恢复到高水平。该阶段的标志是合成 S 期所需的各种酶,主要是 DNA 复制所需的酶。G1 的持续时间变化很大,即使在同一物种的不同细胞之间也是如此。[1]
DNA 复制的开始是 S 期的标志;当它完成时,所有的染色体都已复制,此时每条染色体都有两个(姐妹)染色单体。因此,在此阶段,细胞中的 DNA 量实际上翻了一番,但细胞的倍性保持不变。RNA 转录和蛋白质合成的速率在此阶段非常低。一个例外是组蛋白的产生,它主要发生在 S 期。[1]
在 S 期或复制后,细胞进入 G2 期,持续到细胞进入有丝分裂。同样,在此阶段会发生大量的生物合成,主要涉及微管的产生,微管在有丝分裂过程中是必需的。抑制 G2 期的蛋白质合成会阻止细胞进行有丝分裂。
细胞周期分析
细胞周期分析是细胞生物学中的一种方法,它利用流式细胞术来区分处于不同细胞周期阶段的细胞。在分析之前,细胞会被透化并用一种荧光染料进行处理,该染料可以定量地染色 DNA,通常是碘化丙啶 (PI)。因此,染色细胞在特定波长下的荧光强度将与它们所含的 DNA 量相关。由于细胞在细胞周期的 S 阶段会复制 DNA,因此可以确定处于 G0 期和 G1 期(S 阶段之前)、S 阶段、以及 G2 期和 M 期(S 阶段之后)的细胞比例,因为 G2/M 期的细胞的荧光强度将是 G0/G1 期的细胞的两倍。细胞周期异常可能是各种细胞损伤的症状,例如 DNA 损伤,会导致细胞在某些检查点中断细胞周期,以防止其转化为癌细胞(致癌作用)。异常的其他可能原因包括缺乏营养物质,例如在血清剥夺之后。细胞周期分析首次于 1969 年在洛斯阿拉莫斯国家实验室由加州大学的一个小组使用 Feulgen 染色技术进行描述。使用碘化丙啶染色的细胞周期分析的第一个方案是由哈佛医学院的 Awtar Krishan 于 1975 年提出的,至今仍然被广泛引用。[3]
有丝分裂是有丝分裂真核细胞将细胞核中的染色体分离成两个相同组并形成两个细胞核的过程。它通常紧随细胞质分裂,细胞质分裂将细胞核、细胞质、细胞器和细胞膜分成两个细胞,包含这些细胞成分的几乎相等的份额。有丝分裂和细胞质分裂一起定义了细胞周期的有丝分裂 (M) 期 - 母细胞分裂成两个子细胞,在遗传上彼此相同,也与其亲代细胞相同。这约占细胞周期的 10%。有丝分裂仅发生在真核细胞中,但在不同物种中以不同的方式发生。例如,动物经历“开放式”有丝分裂,其中核膜在染色体分离之前破裂,而真菌如曲霉和酿酒酵母(酵母)经历“封闭式”有丝分裂,其中染色体在完整的细胞核内分裂。原核细胞没有细胞核,通过称为二元裂变的过程分裂。有丝分裂过程是复杂的,并且受到高度调控。事件的顺序被划分为阶段,对应于一组活动的完成和下一组活动的开始。这些阶段分别是前期、前中期、中期、后期和末期。在有丝分裂过程中,染色体对会浓缩并附着在将姐妹染色单体拉到细胞两侧的纤维上。然后细胞在细胞质分裂中分裂,产生两个相同的子细胞。由于细胞质分裂通常与有丝分裂同时发生,因此“有丝分裂”经常与“M 期”互换使用。然而,在许多细胞中,有丝分裂和细胞质分裂会分开发生,形成多个核的单细胞。这在真菌和粘菌中最为突出,但在各种不同的群体中都有发现。即使在动物中,细胞质分裂和有丝分裂也可能独立发生,例如在果蝇胚胎发育的某些阶段。有丝分裂中的错误会导致细胞凋亡而死亡,或者会导致可能导致癌症的突变。[4]
前期


前期来自古希腊语 pro(之前)和 phase(阶段),是有丝分裂的一个阶段,其中染色质浓缩(它变得更短更粗)成高度有序的结构,称为染色体,其中染色质变得可见。这个过程称为染色质浓缩,是由凝聚素复合体介导的。由于遗传物质在细胞周期的早期阶段已经复制,因此细胞中每条染色体有两个相同的副本。相同的染色体被称为姐妹染色单体,彼此附着在每个染色体上存在的 DNA 元件上,称为着丝粒。在前期,可以应用吉姆萨染色以在染色体中引发 G 带。前期约占细胞周期持续时间的 3%。有丝分裂中一个重要的细胞器是中心体,它是后生动物中微管的组织中心。在前期,两个中心体在有丝分裂中独立复制,由于 γ-微管的募集,它们的微管活性增加。中心体将通过作用于微管的分子马达的作用被推到细胞核的两端。核膜分解以允许微管到达染色体上的动粒,标志着前期的结束。前中期是紧接有丝分裂的下一步,将看到染色体被微管捕获。[5]
植物细胞中的前期
在这个有丝分裂的第一阶段,植物细胞经历一系列被称为青春期的变化。在高液泡植物细胞中,收缩液泡必须迁移到细胞中心,有丝分裂才能开始。这在细胞周期的 G2 期实现。横向的细胞质片将细胞沿未来的细胞分裂平面一分为二。植物细胞中的前期之前是一个仅在植物中发现的阶段,即在未来有丝分裂纺锤体的赤道平面下方形成微管和肌动蛋白丝环,并预测末期细胞板融合的位置。在动物细胞的末期,会形成一个胞质分裂沟。尽管有相反的看法,但前期带在核膜分解和前中期纺锤体形成过程中消失。高等植物的细胞缺乏中心粒。相反,核膜充当微管组织中心。纺锤体微管在前期和前期期间聚集在核膜表面,形成前期纺锤体。[5]
中期
中期来自古希腊语 meta(之间)和 phase(阶段),是真核细胞周期中有丝分裂的一个阶段,其中浓缩的、高度螺旋的染色体携带遗传信息,在被分离到两个子细胞中的每一个之前,排列在细胞的中间。中期约占细胞周期持续时间的 4%。在前期发生的事件之前,并且在后期之后,前期形成的微管已经在中期找到了并附着在动粒上。染色体的着丝粒会在中期板(或赤道板)上汇聚,中期板是距离两个中心体极等距的假想线。这种均匀的排列是由于相反的动粒产生的拉力产生的平衡,类似于两个力量相等的人之间的拔河。在某些类型的细胞中,染色体不会排列在中期板上,而是随机地在两极之间来回移动,只是大致排列在中间线。中期的早期事件可能与前中期的后期事件同时发生,因为具有连接动粒的染色体将在其他具有未连接动粒的染色体(它们仍然徘徊在前中期事件中)之前单独开始中期的事件。细胞周期检查点之一发生在前中期和中期。只有当所有染色体都排列在中期板上,每个动粒都正确地附着在一个微管束上时,细胞才会进入后期。据认为,未附着或未正确附着的动粒会产生一个信号来阻止过早进入后期,即使大多数动粒已经附着并且大多数染色体已经排列。这样的信号产生了有丝分裂纺锤体检查点。这将通过调节后期促进复合体、安全蛋白和分离酶来实现。[6]
后期(ana(向上)和 phase(阶段))
后期以中期向后期的过渡的调控触发而突然开始,约占细胞周期持续时间的 1%。此时,后期开始。这通过切割和使 M 期细胞周期蛋白失活来终止活性,M 期细胞周期蛋白对于 M 期细胞周期蛋白依赖性激酶 (M-Cdks) 的功能是必需的。它还会切割安全蛋白,安全蛋白抑制称为分离酶的蛋白酶。分离酶然后切割凝聚素,凝聚素是负责将姐妹染色单体连接在一起的蛋白质。在后期早期(或后期 A),染色单体突然分离并移向纺锤体极。这是通过纺锤体微管的缩短来实现的,其中力主要在动粒处施加。后期是染色单体彼此分离并移动到细胞两端的时间。当染色单体完全分离时,后期后期(或后期 B)开始。这涉及极性微管的伸长,并相对于彼此滑动以将纺锤体极驱动到细胞的两端。后期 B 通过三种力驱动姐妹中心体分离到相反的两极。附着在极性微管上的驱动蛋白会将微管推到彼此的旁边。第二种力涉及微管被皮质相关的胞质动力蛋白拉动。染色体分离的第三种力涉及极性微管在其正端的延长。这两个过程最初是根据它们对药物的不同敏感性来区分的,它们在机械上是不同的。后期早期(后期 A)涉及通过在其正端解聚而缩短动粒微管。在这个过程中,滑动套允许染色单体运动。没有参与的运动蛋白,因为 ATP 耗竭不会抑制后期早期。后期后期(后期 B)涉及重叠微管的伸长以及两组不同的运动蛋白的使用:一组将重叠微管拉到彼此的旁边,另一组拉动附着在细胞皮质上的星体微管。后期早期和后期后期对整个后期的贡献因细胞类型而异。在哺乳动物细胞中,后期后期紧随后期早期之后,将纺锤体延伸到大约中期长度的两倍;相比之下,酵母和某些原生动物使用后期中期作为染色体分离的主要手段,在此过程中,它们可以将纺锤体延伸到中期长度的 15 倍。[7]
细胞周期蛋白
[edit | edit source]细胞周期蛋白是一组通过激活Cyclin-dependent kinase (Cdk) 酶来控制细胞通过细胞周期进程的蛋白质。细胞周期蛋白于 1982 年由R. Timothy Hunt在研究海胆细胞周期时发现。
细胞周期蛋白的类型
[edit | edit source]有几种不同的细胞周期蛋白在细胞周期的不同部分处于活跃状态,并且会导致 Cdk 磷酸化不同的底物。
有两种细胞周期蛋白
G1/S 细胞周期蛋白 – 这些细胞周期蛋白对于控制细胞周期在 G1/S 转变时的作用至关重要,细胞周期蛋白 A / CDK2 – 在 S 期活跃。细胞周期蛋白 D / CDK4、细胞周期蛋白 D / CDK6 和细胞周期蛋白 E / CDK2 – 调节从 G1 到 S 期的过渡。
G2/M 细胞周期蛋白 – 在 G2/M 转换(有丝分裂)期间控制细胞周期的必需物质。G2/M 细胞周期蛋白在 G2 期间稳定积累,并在细胞退出有丝分裂(在 M 期的末尾)时突然被破坏。细胞周期蛋白 B/CDK1 – 调节从 G2 到 M 期的进展。
还有一些尚未确定 Cdk 伴侣的“孤儿”细胞周期蛋白。例如,细胞周期蛋白 F 是一种孤儿细胞周期蛋白,对 G2/M 转换至关重要。[8]
细胞周期蛋白依赖性激酶 (CDKs)
[edit | edit source]CDKs 是一系列蛋白激酶。CDKs 存在于所有已知的真核生物中,它们在细胞周期中的调节功能在进化上是保守的。CDKs 也参与转录调控、mRNA 加工和神经细胞的分化。一个有趣的事实是,当酵母细胞的 CDK 基因被同源的人类基因取代时,它们可以正常增殖。CDKs 是相对较小的蛋白质,分子量在 34 到 40 kDa 之间,并且只包含激酶结构域。CDK 与称为细胞周期蛋白的调节蛋白结合。没有细胞周期蛋白,CDK 几乎没有激酶活性,只有细胞周期蛋白-CDK 复合物才是活性激酶。CDKs 在其底物的丝氨酸和苏氨酸上磷酸化,因此它们是丝氨酸-苏氨酸激酶。CDK 底物氨基酸序列中磷酸化位点的共有序列是 [S/T*]PX[K/R],其中 S/T* 是磷酸化的丝氨酸或苏氨酸,P 是脯氨酸,X 是任何氨基酸,K 是赖氨酸,R 是精氨酸。[9]
表: 控制模式生物细胞周期的细胞周期蛋白依赖性激酶。[10]
| 物种 | 名称 | 原始名称 | 大小(氨基酸) | 功能 |
|---|---|---|---|---|
| 酿酒酵母 | Cdk1 | Cdc28 | 298 | 所有细胞周期阶段 |
| 裂殖酵母 | Cdk1 | Cdc2 | 297 | 所有细胞周期阶段 |
| 果蝇 | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | Cdc2c | 314 | G1/S、S,可能还有 M | |
| Cdk4 | Cdk4/6 | 317 | G1,促进生长 | |
| 非洲爪蟾 | Cdk1 | Cdc2 | 301 | M |
| Cdk2 | 297 | S,可能还有 M | ||
| 智人 | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | 298 | G1、S,可能还有 M | ||
| Cdk4 | 301 | G1 | ||
| Cdk6 | 326 | G1 |
细胞周期蛋白和 CDKs 的功能
[edit | edit source]两类关键的调节分子,细胞周期蛋白和细胞周期蛋白依赖性激酶 (CDKs),决定了细胞在细胞周期中的进展。莱兰·H·哈特维尔、R·蒂莫西·亨特和保罗·M·纳斯因发现这些核心分子获得了 2001 年诺贝尔生理学或医学奖。编码细胞周期蛋白和 CDKs 的许多基因在所有真核生物中都是保守的,但总的来说,更复杂的生物体具有更精细的细胞周期控制系统,包含更多单独的组分。许多相关基因最初是通过研究酵母(特别是酿酒酵母)而发现的;酵母的遗传命名法将许多这些基因称为 cdc(代表“细胞分裂周期”),后面跟着一个标识号,例如 cdc25 或 cdc20。
细胞周期蛋白构成活性异二聚体的调节亚基,而 CDKs 构成催化亚基;细胞周期蛋白没有催化活性,而 CDKs 在没有伴侣细胞周期蛋白的情况下是无活性的。当被结合的细胞周期蛋白激活时,CDKs 执行一种称为磷酸化的常见生化反应,该反应激活或失活目标蛋白以协调进入细胞周期的下一阶段。不同的细胞周期蛋白-CDK 组合决定了被靶向的下游蛋白。CDKs 在细胞中组成性表达,而细胞周期蛋白在细胞周期的特定阶段合成,以响应各种分子信号。
在接收到促有丝分裂的细胞外信号后,G1 细胞周期蛋白-CDK 复合物被激活,为细胞准备进入 S 期,促进转录因子的表达,这些转录因子反过来促进 S 细胞周期蛋白和 DNA 复制所需的酶的表达。G1 细胞周期蛋白-CDK 复合物还通过靶向它们进行泛素化来促进作为 S 期抑制剂起作用的分子降解。一旦蛋白质被泛素化,它就会被蛋白酶体靶向进行蛋白水解降解。活性 S 细胞周期蛋白-CDK 复合物磷酸化构成 G1 期在 DNA 复制起点上组装的预复制复合物的蛋白质。磷酸化有两个目的:激活每个已组装的预复制复合物,并防止形成新的复合物。这确保了细胞基因组的每个部分都会被复制一次且只有一次。阻止复制缺口的原因相当清楚,因为缺少所有或部分关键基因的子细胞将死亡。然而,由于与基因拷贝数效应有关的原因,某些基因的额外拷贝对子细胞也有害。有丝分裂细胞周期蛋白-CDK 复合物在 S 和 G2 期合成但处于失活状态,通过刺激与染色体凝聚和有丝分裂纺锤体组装相关的下游蛋白来促进有丝分裂的启动。在此过程中激活的关键复合物是一种称为后期促进复合物 (APC) 的泛素连接酶,它促进与染色体着丝粒相关的结构蛋白降解。APC 还靶向有丝分裂细胞周期蛋白进行降解,确保可以进行末期和胞质分裂。间期:间期在哺乳动物组织中通常持续至少 12 到 24 小时。在此期间,细胞不断合成 RNA,产生蛋白质并生长。通过研究细胞中的分子事件,科学家已经确定间期可以分为 4 个步骤:间隙 0 (G0)、间隙 1 (G1)、S (合成) 期、间隙 2 (G2)。
细胞周期蛋白 D 是细胞周期中第一个产生的细胞周期蛋白,以响应细胞外信号(例如生长因子)。细胞周期蛋白 D 与现有的 CDK4 结合,形成活性细胞周期蛋白 D-CDK4 复合物。细胞周期蛋白 D-CDK4 复合物反过来磷酸化视网膜母细胞瘤易感蛋白 (Rb)。过度磷酸化的 Rb 从 E2F/DP1/Rb 复合物(与 E2F 响应基因结合,有效地“阻断”它们转录)中分离出来,激活 E2F。E2F 的激活导致各种基因的转录,例如细胞周期蛋白 E、细胞周期蛋白 A、DNA 聚合酶、胸腺嘧啶激酶等。由此产生的细胞周期蛋白 E 与 CDK2 结合,形成细胞周期蛋白 E-CDK2 复合物,将细胞从 G1 推入 S 期(G1/S 转换)。细胞周期蛋白 B 以及 cdc2(cdc2 - 裂殖酵母(CDK1 - 哺乳动物))形成细胞周期蛋白 B-cdc2 复合物,启动 G2/M 转换。细胞周期蛋白 B-cdc2 复合物的激活导致核膜的破裂和前期启动,随后,它的失活导致细胞退出有丝分裂。[1]
细胞周期失调
[edit | edit source]细胞周期组分的失调会导致肿瘤形成。如上所述,一些基因(如细胞周期抑制剂、RB、p53 等)在发生突变时,可能会导致细胞无限制地增殖,形成肿瘤。尽管肿瘤细胞的细胞周期持续时间等于或长于正常细胞周期,但肿瘤中处于活跃细胞分裂状态的细胞(与处于 G0 期的静止细胞相比)的比例远高于正常组织。因此,由于通过凋亡或衰老死亡的细胞数量保持不变,细胞数量净增加。处于活跃细胞周期中的细胞是癌症治疗的靶点,因为 DNA 在细胞分裂过程中相对暴露,因此容易受到药物或辐射的损伤。这一事实被用于癌症治疗;通过称为去瘤的程序,去除大量肿瘤,这会导致剩余肿瘤细胞中相当一部分从 G0 期进入 G1 期(由于营养物质、氧气、生长因子等的可用性增加)。去瘤程序后的放射治疗或化疗会杀死这些新进入细胞周期的细胞。培养中最快速循环的哺乳动物细胞,肠上皮隐窝细胞,其周期时间短至 9 到 10 小时。静止小鼠皮肤中的干细胞的周期时间可能超过 200 小时。这种差异的主要原因是 G1 的长度不同,G1 是周期中最不稳定的阶段。M 和 S 的变化不大。一般来说,细胞在 M 期后期和 G2 期最敏感,在 S 期后期最耐受。对于具有较长细胞周期时间和明显较长 G1 期的细胞,在 G1 期后期存在另一个耐受峰。耐受和敏感性模式与细胞中硫氢基化合物的水平相关。硫氢基是天然的放射防护剂,其水平在 S 期最高,而在有丝分裂附近最低。[1]
细胞周期检查点
[edit | edit source]G1/S 检查点
[edit | edit source]
G1/S 转换,更常被称为出芽酵母中的起始检查点(其他生物体中的限制点),调节细胞周期承诺。在这个检查点,细胞要么在 DNA 复制之前停滞(由于营养物质限制或信息素信号),要么延长 G1 期(大小控制),要么开始复制并通过细胞周期的其余部分。出芽酵母中的 G1/S 调节网络或调节子包括 G1 周期蛋白 Cln1、Cln2 和 Cln3、Cdc28(Cdk1)、转录因子 SBF 和 MBF 以及转录抑制因子 Whi5。[11] Cln3 与 Cdk1 相互作用,通过磷酸化大量靶标(包括 SBF、MBF 和 Whi5)来启动一系列事件。Whi5 的磷酸化导致它从细胞核中转运出去,防止它抑制 SBF 和 MBF。活跃的 SBF/MBF 通过开启 B 型周期蛋白并启动 DNA 复制、芽形成和纺锤体复制来驱动 G1/S 转换。此外,SBF/MBF 驱动 Cln1 和 Cln2 的表达,它们也可以与 Cdk1 相互作用以促进其靶标的磷酸化。
最初认为这个 G1/S 开关以从 Cln3 开始并以 S 期结束的线性事件序列起作用。[12] 然而,任何一个 Clns 都足以激活调节子的观察表明,Cln1 和 Cln2 可能能够参与正反馈来激活它们自身的转录。这将导致一个不断加速的循环,该循环可以充当不可逆的双稳态触发器。Skotheim 等人使用出芽酵母中的单细胞测量表明这种正反馈确实存在。少量的 Cln3 会诱导 Cln1/2 表达,然后反馈回路接管,导致 Whi5 从细胞核中快速而突然地退出,并因此导致 G1/S 调节子基因的连贯表达。在没有连贯基因表达的情况下,细胞需要更长的时间才能退出 G1 期,并且相当一部分甚至在 S 期之前停滞,这突出了正反馈在锐化 G1/S 开关中的重要性。
G1/S 细胞周期检查点控制真核细胞从第一个间隙期 G1 期进入 DNA 合成期 S 期。在哺乳动物细胞中的这种转换中,有两个细胞周期激酶有助于控制检查点:细胞周期激酶 CDK4/6-细胞周期蛋白 D 和 CDK2-细胞周期蛋白 E。包含 Rb 和 E2F 的转录复合物在控制此检查点中很重要。在第一个间隙期,Rb-HDAC 抑制复合物与 E2F-DP1 转录因子结合,因此抑制下游转录。CDK4/6 和 CDK2 对 Rb 的磷酸化解离了 Rb-抑制复合物,并作为细胞周期的开/关开关。一旦 Rb 被磷酸化,对 E2F 转录活性的抑制就会解除。这使得能够转录编码放大 G1 到 S 期转换的蛋白质的 S 期基因。[13]
许多不同的刺激应用检查点控制,包括 TGFb、DNA 损伤、接触抑制、复制性衰老和生长因子撤回。前四个通过诱导 INK4 或 Kip/Cip 家族的细胞周期激酶抑制剂成员来起作用。TGFb 抑制 Cdc25A 的转录,Cdc25A 是一种激活细胞周期激酶的磷酸酶,而生长因子撤回激活 GSK3b,GSK3b 磷酸化细胞周期蛋白 D。这导致其快速泛素化。[14]
G2/M 检查点
[edit | edit source]这种转换是由 E2F 介导的细胞周期蛋白 A 的转录开始的,形成细胞周期蛋白 A-Cdk2 复合物。这在调节前期事件中很有用。为了通过前期,细胞周期蛋白 B-Cdk1 复合物(最初被称为 MPF 或 M 相促进因子)被 Cdc 25(一种蛋白质磷酸酶1)激活。随着有丝分裂开始,核膜崩解,染色体浓缩并变得可见,细胞为分裂做好准备。细胞周期蛋白 B-Cdk1 的激活导致核膜分解,这是有丝分裂开始的特征。很明显,细胞周期蛋白 A 和 B 与 Cdk 的复合物有助于调节 G2/M 转换时的有丝分裂事件。[15]
如上所述,进入有丝分裂是由细胞周期蛋白 B-Cdk1 复合物控制的(最初被称为 MPF 或 M 相促进因子;Cdk1 在裂殖酵母中也被称为 Cdc2,在出芽酵母中被称为 Cdc28)。该复合物构成了一个有趣的调节回路的一部分,其中 Cdk1 可以磷酸化并激活其激活剂,磷酸酶 Cdc25(正反馈),并磷酸化并失活其失活剂,激酶 Wee1(双负反馈)。有人提出,该回路可以充当双稳态触发器[16],在 G2 期(Cdk 和 Cdc25 关闭,Wee1 打开)有一个稳定的稳态,而在 M 相(Cdk 和 Cdc25 活跃,Wee1 关闭)有一个稳定的稳态。一旦细胞进入有丝分裂,细胞周期蛋白 B-Cdk1 就会激活后期促进复合物 (APC),它反过来通过降解细胞周期蛋白 B 来失活细胞周期蛋白 B-Cdk1,最终导致退出有丝分裂。将双稳态 Cdk1 响应函数与来自 APC 的负反馈耦合可以产生所谓的弛豫振荡器,[17] 其中 Cdk1 活性的急剧峰值触发了强大的有丝分裂周期。然而,在弛豫振荡器中,控制参数相对于系统的响应动力学缓慢移动,这可能是对有丝分裂进入的准确描述,但不一定是对有丝分裂退出的准确描述。
为了退出细胞周期的有丝分裂阶段,必须失活细胞周期蛋白 B-Cdk1 复合物。然后,细胞可以返回第一个间隙期 G1 期,并等待周期再次进行。

2003 年,Pomerening 等人通过证明非洲爪蟾卵母细胞胞质提取物中 Cdk1 激活的滞后现象和双稳态现象,为该假设提供了强有力的证据。[17] 他们首先证明了 Cdk1 对不可破坏细胞周期蛋白 B 浓度变化的非连续急剧响应(以将 Cdk1 响应网络与 APC 介导的负反馈分离)。然而,这种响应与单稳态超敏感转变和双稳态转变都一致。为了区分这两种可能性,他们测量了响应于细胞周期蛋白水平变化的活性 Cdk1 的稳态水平,但在两个单独的实验中,一个从间期提取物开始,另一个从已经进入有丝分裂的提取物开始。在细胞周期蛋白的中间浓度下,他们发现两种活性 Cdk1 的稳态浓度。哪一种稳态被占据取决于系统的历史,即它们是从间期提取物还是有丝分裂提取物开始,有效地证明了滞后现象和双稳态现象。
同年,Sha 等人[18] 独立地得出了相同的结论,也使用非洲爪蟾卵提取物揭示了滞后循环。在这篇文章中,为了得出滞后现象是“细胞周期进入和退出有丝分裂的驱动力”的结论,测试了 Novak-Tyson 模型的三个预测。Novak-Tyson 模型的预测对于所有鞍节点分岔来说都是通用的。鞍节点分岔在不完美的世界中是非常有用的分岔,因为它们有助于描述不完美的生物系统。第一个预测是,进入有丝分裂的细胞周期蛋白阈值浓度高于退出有丝分裂的细胞周期蛋白阈值浓度,这通过补充循环卵提取物以不可降解的细胞周期蛋白 B 并测量添加环己酰亚胺 (CHX) 后的激活和失活阈值得到证实,环己酰亚胺 (CHX) 是一种蛋白质合成抑制剂。此外,Novak-Tyson 模型的第二个预测也得到验证:未复制的脱氧核糖核酸或 DNA 会增加进入有丝分裂所需的细胞周期蛋白阈值浓度。为了得出这一结论,细胞静止因子释放的提取物补充了 CHX、APH(一种 DNA 聚合酶抑制剂)或两者,并添加了不可降解的细胞周期蛋白 B。本文中测试并证明为真的第三个也是最后一个预测是,Cdc2 激活速率在接近细胞周期蛋白的激活阈值浓度时会减慢。这些预测和实验证明了动态系统中的滞后现象可以描述的类似切换的切换行为。[19]
中期-后期检查点
[edit | edit source]
从纺锤体检查点 | 中期到后期的转变中,确保姐妹染色单体正确且同时分离到细胞的两端至关重要。姐妹染色单体的分离最初受到强烈抑制,以防止有丝分裂后期过早分离,但这种抑制通过后期促进复合物 (APC) 在姐妹染色单体双定向后破坏抑制元件而解除。这些抑制元件之一是安全蛋白,它通过结合蛋白酶分离酶来阻止凝聚素的破坏,凝聚素是将姐妹染色单体连接在一起的复合物,分离酶靶向凝聚素复合物的一个亚基 Scc1 进行破坏。在这个系统中,磷酸酶 Cdc14 可以从安全蛋白中去除抑制性磷酸,从而促进 APC 摧毁安全蛋白,释放分离酶。正如 Uhlmann 等人所述,在染色体附着到有丝分裂纺锤体期间,染色单体保持配对,因为姐妹之间的凝聚力阻止了分离。[20]凝聚力是在 DNA 复制过程中建立的,依赖于凝聚素,凝聚素是一个由 Scc1、Scc3、Smc2 和 Smc3 组成的多亚基复合物。在酵母中,在中期到后期的转变过程中,Scc1 从染色体上解离,姐妹染色单体分离。这个过程受 Esp1 蛋白的控制,Esp1 蛋白与后期抑制剂 Pds1 紧密结合,而 Pds1 被后期促进复合物摧毁。为了验证 Esp1 是否确实在调节 Scc1 染色体关联中发挥作用,细胞株被用α因子阻滞在 G1 期。这些细胞在发育过程中保持阻滞状态。使用 Esp1-1 突变体细胞并重复实验,Scc1 成功地结合到染色体上,即使在合成终止后也保持关联。这对于表明 Esp1 阻碍了 Scc1 在 G1 期间稳定地与染色体结合的能力,以及 Esp1 实际上可以直接从染色体上移除 Scc1 至关重要。[13]
Holt 等人已经证明[21],分离酶激活 Cdc14,而 Cdc14 反过来作用于安全蛋白,从而形成一个正反馈回路,增强了中期到后期的转变的清晰度和姐妹染色单体分离的协调。[21]Holt 等人利用酵母的突变“安全蛋白”菌株探测了正反馈在安全蛋白磷酸化中的作用基础,并测试了安全蛋白磷酸调节的变化如何影响姐妹染色单体分离的同步性。他们的结果表明,干扰这种安全蛋白-分离酶-cdc14 的正反馈回路会降低姐妹染色单体分离的同步性。这种正反馈可以假设地在向后期的转变中产生双稳态,导致细胞做出不可逆转的决定来分离姐妹染色单体。
裂殖酵母的细胞分裂
[edit | edit source]裂殖酵母是一种单细胞真菌,具有简单、完全特征化的基因组和快速的生长速度。它长期以来被用于酿造、烘焙和分子遗传学。粟酒裂殖酵母是一种杆状细胞,直径约 3 µm,完全通过端部伸长生长。有丝分裂后,分裂发生在细胞中央形成隔膜或细胞板,将细胞在中部分开。
细胞繁殖的核心事件是染色体复制,发生在 S(合成)期,然后是染色体分离和核分裂(有丝分裂)以及细胞分裂(胞质分裂),这些事件统称为 M(有丝分裂)期。G1 是 M 和 S 期之间的间隙,G2 是 S 和 M 期之间的间隙。在出芽酵母中,G2 期特别延长,胞质分裂(子细胞分离)直到启动新的 S(合成)期才发生。
裂殖酵母通过与多细胞动物相似的机制控制有丝分裂。它通常以单倍体状态增殖。当饥饿时,相反交配类型的细胞(P 和 M)融合形成一个二倍体合子,立即进入减数分裂以产生四个单倍体孢子。当条件改善时,这些孢子萌发产生增殖的单倍体细胞。[22]
需要记住的事实
[edit | edit source]| 状态 | 阶段 | 缩写 | 描述 |
|---|---|---|---|
| 静止 / 衰老 |
间隙 0 | G0 | 细胞离开周期并停止分裂的静止阶段。 |
| 间期 | 间隙 1 | G1 | 细胞在间隙 1 中增大。G1 检查点控制机制确保一切准备就绪,以便进行DNA合成。 |
| 合成 | S | 在此阶段进行DNA 复制。 | |
| 间隙 2 | G2 | 在 DNA 合成和有丝分裂之间的间隙中,细胞将继续生长。G2 检查点控制机制确保一切准备就绪,以便进入 M(有丝分裂)期并进行分裂。 | |
| 细胞分裂 | 有丝分裂 | M | 细胞生长在此阶段停止,细胞能量集中在有序地分裂成两个子细胞。有丝分裂中期的检查点(中期检查点)确保细胞已准备好完成细胞分裂。 |
有丝分裂的阶段 [4]
通过染色真实的有丝分裂细胞,用荧光抗体和染料可以在显微镜下观察到它们。这些光学显微照片包含在下面。
-
前期早期:非着丝点微管,显示为绿色细丝,已在蓝色降解的细胞核周围建立了基质。绿色小体是中心体。
-
前中期早期:核膜刚刚降解,使微管能够快速与染色体上的着丝点相互作用,染色体刚刚凝集。
-
中期后期:中心体已移动到细胞的两极并建立了有丝分裂纺锤体。染色体,以浅蓝色显示,都已组装在中期板处,除了一个。
-
后期:伸长的非着丝点微管将两套染色体进一步推开。
参考文献
[edit | edit source]- ↑ a b c d e f 细胞周期
- ↑ G0 期
- ↑ 细胞周期分析
- ↑ a b 有丝分裂
- ↑ a b 前期
- ↑ 中期
- ↑ 后期
- ↑ 周期蛋白
- ↑ 周期蛋白依赖性激酶
- ↑ Morgan,David O.(2007)。细胞周期:控制原理。伦敦:新科学出版社,第一版。
- ↑ Skotheim, J.M.; Di Talia, S.; Siggia, E.D.; Cross, F.R. (2008), "G1 周期蛋白的正反馈确保了细胞周期进入的连贯性",自然,454 (7202): 291,检索于 2009-12-11
- ↑ Stuart, D.; Wittenberg, C. (1995), "CLN3,而不是正反馈,决定了循环细胞中 CLN2 转录的时间" (PDF),基因与发育,9 (22): 2780,检索于 2009-12-11
- ↑ a b 细胞周期中的生化开关
- ↑ Harper JW. 细胞周期控制中磷酸化驱动的泛素化开关. TrendsCell Biol. 2002 年 3 月;12(3):104-7. PMID 11859016
- ↑ 细胞周期中的生化开关
- ↑ Novak, B.; Tyson, J.J. (1993), "非洲爪蟾卵母细胞提取物和完整胚胎中 M 期控制的综合模型的数值分析", Journal of Cell Science, 106 (4): 1153, 检索于 2009-12-11
- ↑ a b Pomerening, J. R., E. D. Sontag 等人 (2003)。“构建细胞周期振荡器:Cdc2 激活中的滞后现象和双稳态”。Nat Cell Biol 5(4): 346-351。
- ↑ Sha, W.; Moore, J.; Chen, K.; Lassaletta, A.D.; Yi, C.S.; Tyson, J.J.; Sible, J.C. (2003), "滞后现象驱动非洲爪蟾卵提取物中的细胞周期转变", Proceedings of the National Academy of Sciences, 100 (3): 975, 检索于 2009-12-11
- ↑ Cooper, G. (2000),“细胞:分子方法”。检索于 2010-11-21
- ↑ Uhlmann F.; Lottspeich F.; Nasmyth K. (1999),“粘连亚基 Scc1 的裂解促进了后期开始时的姐妹染色单体分离”,Nature 400: 37-42,检索于 2010-9-25
- ↑ a b Holt, L. J., A. N. Krutchinsky 等人 (2008)。“正反馈使后期开关变得敏锐”。Nature 454(7202): 353-357。
- ↑ 裂殖酵母




