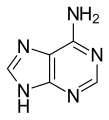
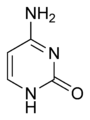
分子生物学/RNA 简介:核糖核酸
核糖核酸俗称 RNA。RNA 是三种主要的大分子(连同 DNA 和蛋白质)之一,对所有已知的生命形式至关重要。RNA 的化学结构与 DNA 非常相似,有两个区别——(a) RNA 包含糖核糖,而 DNA 包含稍微不同的糖脱氧核糖(一种缺少一个氧原子的核糖),以及 (b) RNA 包含核碱基尿嘧啶,而 DNA 包含胸腺嘧啶(尿嘧啶和胸腺嘧啶具有相似的碱基配对性质)。信使 RNA (mRNA) 是一种 RNA,它将信息从 DNA 传递到核糖体,核糖体是细胞中蛋白质合成(翻译)的场所。mRNA 的编码序列决定了所产生蛋白质中的氨基酸序列。然而,许多 RNA 不编码蛋白质(大约 97% 的转录输出在真核生物中是非蛋白质编码的)。这些所谓的非编码 RNA(“ncRNA”)可以由它们自己的基因(RNA 基因)编码,但也可以来自 mRNA 内含子。最突出的非编码 RNA 示例是转移 RNA (tRNA) 和核糖体 RNA (rRNA),它们都参与翻译过程。还有一些非编码 RNA 参与基因调控、RNA 加工和其他作用。某些 RNA 能够催化化学反应,例如切割和连接其他 RNA 分子,以及核糖体中肽键形成的催化作用;这些被称为核酶。[1]

核酸于 1868 年由弗里德里希·米歇尔发现,他称这种物质为“核素”,因为它是在细胞核中发现的。[2] 后来发现,没有细胞核的原核细胞也含有核酸。RNA 在蛋白质合成中的作用早在 1939 年就已受到怀疑。[3] 塞韦罗·奥乔亚在发现一种能够在实验室中合成 RNA 的酶后,获得了 1959 年诺贝尔生理学或医学奖(与阿瑟·科恩伯格分享)。[4] 具有讽刺意味的是,奥乔亚发现的酶(多核苷酸磷酸化酶)后来被证明是负责 RNA 降解,而不是 RNA 合成。
1965 年,罗伯特·W·霍利发现了酵母 tRNA 的 77 个核苷酸序列,[5] 使霍利获得了 1968 年诺贝尔生理学或医学奖(与哈尔·戈宾德·科拉纳和马歇尔·尼伦伯格分享)。
1967 年,卡尔·沃斯假设 RNA 可能具有催化作用,并建议最早的生命形式(自我复制分子)可能依赖于 RNA 来携带遗传信息和催化生化反应——RNA 世界。[6][7]
在 20 世纪 70 年代初期,逆转录病毒和逆转录酶被发现,首次表明酶可以将 RNA 复制成 DNA(与遗传信息传递的通常路线相反)。由于这项工作,大卫·巴尔的摩、雷纳托·杜尔贝科和霍华德·特明于 1975 年获得了诺贝尔奖。1976 年,沃尔特·费尔斯和他的团队确定了第一个完整的 RNA 病毒基因组核苷酸序列,即噬菌体 MS2 的基因组序列。[8]
1977 年,内含子和 RNA 剪接在哺乳动物病毒和细胞基因中都被发现,导致菲利普·夏普和理查德·罗伯茨获得了 1993 年诺贝尔奖。催化 RNA 分子(核酶)在 20 世纪 80 年代初被发现,导致托马斯·切赫和西德尼·奥特曼获得了 1989 年诺贝尔奖。1990 年,在矮牵牛中发现,引入的基因可以沉默植物自身相似的基因,现在已知是 RNA 干扰的结果。[9][10]
大约在同一时间,发现 22 个核苷酸长的 RNA(现在称为 microRNA)在秀丽隐杆线虫的发育中发挥作用。[11] 关于 RNA 干扰的研究使安德鲁·法厄和克雷格·梅洛获得了 2006 年诺贝尔奖,同年,罗杰·科恩伯格因对 RNA 转录的研究而获得了另一个诺贝尔奖。基因调控 RNA 的发现导致人们试图开发由 RNA 制成的药物,例如 siRNA,来沉默基因。[12]
信使 RNA (mRNA) 是一种 RNA 分子,编码蛋白质产物的化学“蓝图”。mRNA 从 DNA 模板转录而来,并将编码信息携带到蛋白质合成的场所:核糖体。在这里,核酸聚合物被翻译成氨基酸聚合物:蛋白质。在 mRNA 中,就像在 DNA 中一样,遗传信息编码在排列成密码子的核苷酸序列中,每个密码子由三个碱基组成。每个密码子编码一个特定的氨基酸,除了终止蛋白质合成的终止密码子。这个过程需要另外两种类型的 RNA:转移 RNA (tRNA) 介导对密码子的识别并提供相应的氨基酸,而核糖体 RNA (rRNA) 是核糖体蛋白质制造机器的核心成分。

核糖体核糖核酸 (rRNA) 是核糖体的 RNA 成分,核糖体是所有活细胞中蛋白质合成的场所。核糖体 RNA 提供了一种将 mRNA 解码为氨基酸的机制,并在翻译过程中与 tRNA 相互作用,通过提供肽基转移酶活性。tRNA 带来了与相应 mRNA 密码子对应的必要氨基酸。
-
rRNA
转运 RNA (tRNA) 是一种小型的 RNA 分子(通常约 73-95 个核苷酸),它在翻译过程中将特定的活性氨基酸转移到核糖体上正在生长的多肽链上。它有一个 3' 端位点用于氨基酸的连接。这种共价连接是由氨酰 tRNA 合成酶催化的。它还包含一个称为反密码子的三个碱基区域,可以与 mRNA 上相应的三个碱基密码子区域配对。每种类型的 tRNA 分子只能连接到一种类型的氨基酸,但由于遗传密码包含多个指定相同氨基酸的密码子,因此带有不同反密码子的 tRNA 分子也可以携带相同的氨基酸。
-
tRNA 的三级结构。CCA 尾部为黄色,受体茎为紫色,可变环为橙色,D 臂为红色,反密码子臂为蓝色,反密码子为黑色,T 臂为绿色。
-
tRNA 和 mRNA 在蛋白质合成中的相互作用。
小核 RNA (snRNA) 是一类在真核细胞核中发现的小型 RNA 分子。它们由 RNA 聚合酶 II 或 RNA 聚合酶 III 转录,并参与多种重要过程,例如 RNA 剪接(从 hnRNA 中去除内含子)、转录因子的调控(7SK RNA)或 RNA 聚合酶 II(B2 RNA),以及维持端粒。它们总是与特定的蛋白质相关联,这些复合体被称为小核核糖核蛋白 (snRNP) 或有时被称为 snurps。这些元素富含尿嘧啶。
小核仁 RNA (snoRNA) 是一类主要指导其他 RNA 化学修饰的小型 RNA 分子,主要包括核糖体 RNA、转运 RNA 和小核 RNA。snoRNA 主要分为两类,C/D 盒 snoRNA 与甲基化相关,H/ACA 盒 snoRNA 与假尿嘧啶化相关。snoRNA 通常被称为引导 RNA,但不要与引导锥虫中 RNA 编辑的引导 RNA 混淆。
转录后,新生 rRNA 分子(称为 pre-rRNA)需要经过一系列加工步骤才能生成成熟的 rRNA 分子。在被外切核酸酶和内切核酸酶切割之前,pre-rRNA 会经历复杂的核苷修饰模式。这些修饰包括甲基化和假尿嘧啶化,由 snoRNA 指导。甲基化是在各种底物上添加或取代甲基。人类的 rRNA 包含大约 115 个甲基修饰。其中大多数是 2'O-核糖甲基化(甲基连接到核糖基)。假尿嘧啶化是将核苷尿嘧啶转化(异构化)为不同的异构形式假尿嘧啶 (Ψ)。成熟的人类 rRNA 包含大约 95 个 Ψ 修饰。每个 snoRNA 分子只作为靶 RNA 中一个(或两个)单独修饰的引导。为了进行修饰,每个 snoRNA 与至少四个蛋白质分子在 RNA/蛋白质复合体中结合,称为小核仁核糖核蛋白 (snoRNP)。与每个 RNA 相结合的蛋白质取决于 snoRNA 分子的类型(见下面的 snoRNA 引导家族)。snoRNA 分子包含一个反义元件(一段 10-20 个核苷酸),它与 pre-RNA 分子中被修饰的碱基 (核苷酸) 周围的序列互补。这使 snoRNP 能够识别并结合到靶 RNA 上。一旦 snoRNP 结合到靶位点,相关的蛋白质就会处于正确的位置以催化靶碱基的化学修饰。[13]
核糖核酸酶 P (RNase P) 是一种核糖核酸酶,它切割 RNA。RNase P 与其他 RNase 的独特之处在于它是一种核酶——一种像蛋白质酶一样起催化作用的核糖核酸。它的作用是切割 tRNA 分子上额外的或前体 RNA 序列。
-
预测的 RNaseP_bact_a 的二级结构和序列保守性。
端粒酶 RNA 组件,也称为 TERC,是真核生物中发现的 RNA 基因,它是端粒酶的组成部分,用于延长端粒。端粒酶 RNA 在脊椎动物、纤毛虫和酵母之间在序列和结构上差异很大,但它们在模板序列附近共享一个 5' 假结结构。脊椎动物端粒酶 RNA 具有一个 3' H/ACA snoRNA 样域。
-
端粒酶 RNA 组件部分的 3D 表示。这是人端粒酶 RNA 中 P2b-P3 假结的溶液结构。
反义 RNA 是一种单链 RNA,它与细胞内转录的信使 RNA (mRNA) 链互补。反义 RNA 可以被引入细胞以通过与互补 mRNA 配对并物理阻碍翻译机制来抑制互补 mRNA 的翻译。因此,这种效果是化学计量的。自然发生的 mRNA 反义机制的一个例子是大肠杆菌 R1 质粒的 hok/sok 系统。反义 RNA 长期以来被认为是一种很有前景的疾病治疗技术;唯一进入市场的此类案例是药物福米维森。一位评论员将反义 RNA 描述为“数十种在概念上很美妙,但在实际应用中却令人沮丧的技术”之一。总的来说,反义 RNA 仍然缺乏有效的设计、生物活性以及有效的给药途径。[14]
微小 RNA (miRNA) 是一种短的核糖核酸 (RNA) 分子,平均只有 22 个核苷酸长,存在于所有真核细胞中。miRNA 是转录后调节因子,它们结合到靶信使 RNA 转录本 (mRNA) 上的互补序列,通常导致翻译抑制和基因沉默。人类基因组可能编码超过 1000 个 miRNA,它们可能靶向大约 60% 的哺乳动物基因,并且在许多人类细胞类型中含量丰富。
-
来自甘蓝的 pre-microRNA 的茎环二级结构。
小干扰 RNA (siRNA),有时称为短干扰 RNA 或沉默 RNA,是一类双链 RNA 分子,长度为 20-25 个核苷酸,在生物学中发挥着多种作用。最值得注意的是,siRNA 参与 RNA 干扰 (RNAi) 途径,它干扰特定基因的表达。除了它们在 RNAi 途径中的作用外,siRNA 还作用于 RNAi 相关途径,例如,作为一种抗病毒机制或在塑造基因组的染色质结构方面;这些途径的复杂性才刚刚被阐明。siRNA 最初是由英国诺里奇塞恩斯伯里实验室的大卫·鲍尔科姆团队发现的,作为植物转录后基因沉默 (PTGS) 的一部分。
小干扰 RNA 的识别
通过作图研究表明,靶转录本的切割对应于与dsRNA互补的区域,并且发生在21-22-nt的间隔处,看起来与dsRNA衍生的siRNA大小相同。为了测试siRNA是否介导RISC活性,合成了具有对称2-nt 3'悬垂的21-22-nt RNA双链体以模拟dsRNA加工产物。当然,这些合成的寡核苷酸在与小RNA中部相对应的位置诱导了靶mRNA的切割。因此,这些dsRNA衍生的siRNA被命名为小干扰RNA(siRNA)。然而,一项最重要的贡献是由证明通过将合成的siRNA转染到哺乳动物细胞中沉默靶转录本而做出的。这项工作为众多基于RNAi的应用奠定了基础,包括强大的“关闭”功能策略和一种新的潜在治疗方法。因此,这些里程碑式的研究为基础科学(包括传统生物化学)在产生生物医学应用的新领域方面的重要性提供了一个壮观的例子。
RNA的结构
[edit | edit source]

RNA中的每个核苷酸都包含一个核糖糖,其碳原子从1'到5'编号。碱基通常连接在1'位置,通常是腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)或尿嘧啶(U)。腺嘌呤和鸟嘌呤是嘌呤,胞嘧啶和尿嘧啶是嘧啶。一个磷酸基团连接到一个核糖的3'位置和下一个核糖的5'位置。磷酸基团在生理pH值下都带负电荷,使RNA成为带电分子(聚阴离子)。碱基可以在胞嘧啶和鸟嘌呤之间、腺嘌呤和尿嘧啶之间以及鸟嘌呤和尿嘧啶之间形成氢键。但是,其他相互作用也是可能的,例如一组腺嘌呤碱基在凸起中相互结合,或者具有鸟嘌呤-腺嘌呤碱基对的GNRA四环。
RNA的一个重要结构特征是它与DNA的区别,即核糖糖的2'位置存在一个羟基。该官能团的存在导致螺旋采用A型几何形状,而不是在DNA中最常观察到的B型几何形状。这导致一个非常深而窄的主沟和一个浅而宽的次沟。2'-羟基存在的第二个结果是在RNA分子构象灵活的区域(即不参与双螺旋形成),它可以化学攻击相邻的磷酸二酯键以断裂主链。
核糖是一种醛戊糖,即含有五个碳原子的单糖,在开链形式中,在一个末端具有醛官能团。在单糖的常规编号方案中,碳原子从C1'(在醛基中)到C5'编号。脱氧核糖衍生物(存在于DNA中)与核糖的不同之处在于碳原子C2'处羟基被氢原子取代。像许多单糖一样,核糖在水中以直链形式H-(C=O)-(CHOH)4-H存在,以及两种环形式中的任何一种:呋喃核糖(“C3'-内消旋”),具有五元环,和吡喃核糖(“C2'-内消旋”),具有六元环。呋喃核糖形式在水溶液中占主导地位。名称D-核糖中的“D-”指的是最远离醛基(C4')的手性碳原子的立体化学。在D-核糖中,与所有D-糖一样,这个碳原子具有与D-甘油醛相同的构型。核糖构成了RNA的主链,RNA是一种生物聚合物,是基因转录的基础。它与DNA中发现的脱氧核糖有关。一旦磷酸化,核糖可以成为ATP、NADH和其他几种对代谢至关重要的化合物的亚基。[15]
RNA碱基
[edit | edit source]腺嘌呤 (A)
腺嘌呤 (A,) 是一种核碱基(嘌呤衍生物),在生物化学中有多种作用,包括细胞呼吸(以能量丰富的腺苷三磷酸 (ATP) 和辅酶烟酰胺腺嘌呤二核苷酸 (NAD) 和黄素腺嘌呤二核苷酸 (FAD) 的形式),以及蛋白质合成(作为 DNA 和 RNA 的化学成分)。腺嘌呤的形状与 DNA 中的胸腺嘧啶或 RNA 中的尿嘧啶互补。
-
腺嘌呤
胞嘧啶 (C)
胞嘧啶 (C) 是 DNA 和 RNA 中发现的四种主要碱基之一,其他三种是腺嘌呤、鸟嘌呤和胸腺嘧啶(RNA 中的尿嘧啶)。它是一种嘧啶衍生物,具有杂环芳香环和两个连接的取代基(位置 4 处的胺基和位置 2 处的酮基)。胞嘧啶的核苷是胞苷。
-
胞嘧啶
鸟嘌呤 (G)
鸟嘌呤 (G) 是 DNA 和 RNA 中发现的四种主要核碱基之一,其他三种是腺嘌呤、胞嘧啶和胸腺嘧啶(RNA 中的尿嘧啶)。在 DNA 中,鸟嘌呤与胞嘧啶配对。鸟嘌呤的化学式为 C5H5N5O,是嘌呤的衍生物,由一个稠合的嘧啶-咪唑环系组成,具有共轭双键。
-
鸟嘌呤
尿嘧啶 (U)
-
尿嘧啶

存在于 RNA 中,它与腺嘌呤配对,并在 DNA 转录过程中取代胸腺嘧啶。尿嘧啶的甲基化产生胸腺嘧啶。它变成胸腺嘧啶以保护 DNA 并提高 DNA 复制的效率。尿嘧啶可以与任何碱基配对,具体取决于分子在螺旋上的排列方式,但很容易与腺嘌呤配对,因为甲基被排斥到固定位置。[16] 尿嘧啶通过氢键与腺嘌呤配对。尿嘧啶是氢键受体,可以形成两个氢键。尿嘧啶还可以与核糖糖结合形成核苷尿苷。当磷酸连接到尿苷时,会生成尿苷 5'-单磷酸。[17]
尿嘧啶经历酰胺-亚胺酸互变异构体转变,因为分子可能由于缺乏正式的芳香性而具有的任何核不稳定性都会得到环状酰胺稳定性的补偿。酰胺互变异构体被称为内酰胺结构,而亚胺酸互变异构体被称为内酰亚胺结构。这些互变异构体在 pH 7 处占主导地位。内酰胺结构是尿嘧啶最常见的形式。
尿嘧啶还通过一系列磷酸核糖基转移酶反应自身循环以形成核苷酸。尿嘧啶的降解产生天冬氨酸、二氧化碳和氨作为底物。
- C4H4N2O2 → H3NCH2CH2COO- + NH4+ + CO2
在 H2O2 和 Fe2+ 的存在下或在双原子氧和 Fe2+ 的存在下,尿嘧啶的氧化降解会生成尿素和马来酸。
尿嘧啶是一种弱酸;尿嘧啶的第一个电离位点尚不清楚。[18] 负电荷放在氧阴离子上,产生小于或等于 12 的 pKa。碱性 pKa = -3.4,而酸性 pKa = 9.389。在气相中,尿嘧啶有 4 个比水更酸性的位点。[19]
尿嘧啶是一种常见且天然存在的嘧啶衍生物。它最初于 1900 年被发现,是通过水解牛胸腺和脾脏、鲱鱼精子和麦胚中发现的酵母核蛋白而分离出来的。它是一种平面、不饱和化合物,能够吸收光。
DNA 与 RNA
[edit | edit source]
RNA 和 DNA 都是核酸,但在三个主要方面有所不同。
首先,与通常是双链的 DNA 不同,RNA 在其许多生物学作用中是单链分子,并且具有更短的核苷酸链。
其次,虽然 DNA 包含脱氧核糖,但 RNA 包含核糖(在脱氧核糖中,在 2' 位置的戊糖环上没有连接羟基)。这些羟基使 RNA 比 DNA 不稳定,因为它更容易发生水解。
第三,与腺嘌呤互补的碱基不是胸腺嘧啶(如 DNA 中那样),而是尿嘧啶,它是胸腺嘧啶的未甲基化形式。
第四,DNA 通常在碱性条件下稳定,而 RNA 在碱性条件下不稳定。
与 DNA 类似,大多数具有生物活性的 RNA,包括 mRNA、tRNA、rRNA、snRNA 和其他非编码 RNA,都包含自互补序列,这些序列允许 RNA 的部分折叠并与自身配对以形成双螺旋。对这些 RNA 的结构分析表明它们具有高度结构化。与 DNA 不同,它们的结构不包含长双螺旋,而是包含短螺旋的集合,这些短螺旋被包装在一起形成类似于蛋白质的结构。通过这种方式,RNA 可以实现化学催化,就像酶一样。例如,核糖体(催化肽键形成的酶)结构的确定表明,其活性位点完全由 RNA 组成。
snRNA 和 snRNP
[edit | edit source]snRNPs(发音为“snurps”),即小核核糖核蛋白,是一种 RNA-蛋白质复合物,它与未修饰的 pre-mRNA 和各种其他蛋白质结合形成剪接体,剪接体是一种大型 RNA-蛋白质分子复合物,pre-mRNA 的剪接发生在其上。snRNPs 的作用对于从 pre-mRNA 中去除内含子至关重要,这是 RNA 转录后修饰的一个关键方面,仅发生在真核细胞的细胞核中。snRNPs 的两个基本组成部分是蛋白质分子和 RNA。snRNP 颗粒中发现的 RNA 被称为小核 RNA 或 snRNA,其长度通常约为 150 个核苷酸。snRNP 中的 snRNA 组件通过“识别”内含子 5' 端和 3' 端以及分支位点的关键剪接信号序列,赋予单个内含子特异性。snRNPs 中的 snRNA 与核糖体 RNA 类似,因为它直接包含酶促作用和结构作用。snRNPs 由迈克尔·R·勒纳和琼·A·施泰茨发现。托马斯·R·切赫和西德尼·奥尔特曼也参与了这项发现,他们因独立发现 RNA 在细胞发育中可以作为催化剂而于 1989 年获得了诺贝尔化学奖。
至少五种不同类型的 snRNPs 加入剪接体以参与剪接。它们可以通过凝胶电泳观察,分别被称为:U1、U2、U4、U5 和 U6。它们的 snRNA 成分分别被称为:U1 snRNA、U2 snRNA、U4 snRNA、U5 snRNA 和 U6 snRNA。在 20 世纪 90 年代中期,人们发现存在一种变异类型的 snRNPs,它有助于剪接仅在后生动物中发现的一类内含子,这些内含子具有高度保守的 5' 剪接位点和分支位点。这种变异类型的 snRNPs 包括:U11 snRNA、U12 snRNA、U4atac snRNA 和 U6atac snRNA。虽然不同,但它们分别执行与 U1、U2、U4 和 U6 相同的功能。[20]
完成的核心 snRNP-snurportin 1 复合物通过蛋白 importin β 转运到细胞核。在细胞核内,核心 snRNPs 出现在卡哈尔小体中,snRNPs 的最终组装发生在那里。这包括特定于特定 snRNP(U1、U2、U4、U5)的其他蛋白质和其他修饰。U6 snRNP 的生物发生发生在细胞核中,尽管在细胞质中发现了大量的游离 U6。LSm 环可能首先组装,然后与 U6 snRNA 结合。
小核核糖核酸 (snRNA) 是一类在真核细胞细胞核中发现的小 RNA 分子。它们由 RNA 聚合酶 II 或 RNA 聚合酶 III 转录,参与各种重要的过程,例如 RNA 剪接(从 hnRNA 中去除内含子)、转录因子的调节 (7SK RNA) 或 RNA 聚合酶 II (B2 RNA),以及维持端粒。它们始终与特定蛋白质相关联,并且这些复合物被称为小核核糖核蛋白 (snRNP) 或有时被称为 snurps。这些元素富含尿嘧啶。一大类 snRNA 被称为小核仁 RNA (snoRNA)。这些是小的 RNA 分子,在 RNA 生物发生中起着至关重要的作用,并指导核糖体 RNA (rRNA) 和其他 RNA 基因 (tRNA 和 snRNA) 的化学修饰。它们位于真核细胞的核仁和卡哈尔小体中(RNA 合成的主要部位)。
RNA 作为一种酶
[edit | edit source]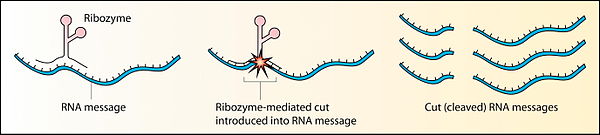
在发现核酶之前,酶被定义为催化蛋白质,[21] 是唯一已知的生物催化剂。1967 年,卡尔·沃斯、弗朗西斯·克里克和莱斯利·奥格尔最先提出 RNA 可以作为催化剂。这个想法是基于 RNA 可以形成复杂二级结构的发现。[22] 第一个核酶是在 20 世纪 80 年代由托马斯·R·切赫发现的,他当时正在研究纤毛原生动物四膜虫的 RNA 剪接,以及西德尼·奥尔特曼,他当时正在研究细菌 RNase P 复合物。这些核酶存在于 RNA 转录本的内含子中,内含子从转录本中去除自身,以及 RNase P 复合物的 RNA 成分中,RNase P 复合物参与 pre-tRNA 的成熟。1989 年,托马斯·R·切赫和西德尼·奥尔特曼因其“发现 RNA 的催化特性”而获得了诺贝尔化学奖。[23] 术语“核酶”是由凯利·克鲁格等人首次提出的。1982 年发表在《细胞》杂志上的一篇论文中。[24]
RNA 酶或核酶仍然存在于当今的 DNA 形式生命中,可能是活化石的例子。核酶发挥着至关重要的作用,例如核糖体中的作用,核糖体对蛋白质合成至关重要。许多其他核酶功能存在,例如:锤头核酶进行自我裂解,[25] 以及 RNA 聚合酶核酶可以自分裂合成自身。[26]
在生命起源中重要的酶促特性包括
- 自我复制或复制其他 RNA 分子的能力。能够复制其他 RNA 分子的相对较短的 RNA 分子已在实验室中人工产生。最短的是 165 个碱基长,尽管估计只有部分碱基对该功能至关重要。一个版本,189 个碱基长,其保真度为 98.9%,[27] 这意味着它将每八个拷贝中复制一个与自身一样长的 RNA 分子的精确拷贝。这种 189 个碱基对的核酶可以聚合最多 14 个核苷酸长的模板,这对于复制来说太短了,但它是进一步研究的有希望的线索。核酶聚合酶最长的引物延伸为 20 个碱基。[28]
- 催化简单化学反应的能力,这将增强构成 RNA 分子的分子的产生,即使创建更多 RNA 链更容易的 RNA 链。在实验室中人工形成了具有这种能力的相对较短的 RNA 分子。[29] [30]
- 催化肽键形成的能力,以产生短肽或最终产生完整的蛋白质。现代细胞中,这是由核糖体完成的,核糖体是两种称为 rRNA 的大型 RNA 分子以及许多蛋白质的复合物。两种 rRNA 分子被认为是其酶促活性的原因。在实验室中形成了一个更短的 RNA 分子,它具有形成肽键的能力,并且有人推测 rRNA 是从类似的分子进化而来的。[31] 也有人推测,氨基酸最初可能是与 RNA 分子结合作为辅因子,增强或多样化它们的酶促能力,然后才进化为更复杂的肽。mRNA 可能从这样的 RNA 分子进化而来,而 tRNA 可能从催化氨基酸转移到它们的 RNA 分子进化而来。[32]
虽然大多数核酶在细胞中相当罕见,但它们的作用有时对生命至关重要。例如,核糖体的功能部分,即将 RNA 翻译成蛋白质的分子机器,本质上是一种核酶,由 RNA 三级结构基序组成,这些基序通常与金属离子(如 Mg2+)配位作为辅因子。在能够催化四核苷酸底物的反式苯丙氨酸化反应的五核苷酸 RNA 中,不需要二价阳离子,该底物与催化剂具有三个碱基互补序列。催化剂和底物是通过截断 C3 核酶而设计的。
核糖核酸酶
[edit | edit source]

核糖核酸酶(通常缩写为 RNase)是一种催化 RNA 降解为更小成分的核酸酶。核糖核酸酶可以分为内切核糖核酸酶和外切核糖核酸酶,并且包含 EC 2.7 类 (磷酸解酶) 和 3.1 类 (水解酶) 酶中的几个亚类。
内切核糖核酸酶 内切核糖核酸酶是一种核糖核酸酶内切酶。它根据酶的不同,可以切割单链或双链 RNA。示例包括单个蛋白质,例如 RNase III、RNase A、RNase T1 和 RNase H,但也包括蛋白质复合物,例如 RNase P 和 RNA 诱导的沉默复合物。
外切核糖核酸酶 外切核糖核酸酶是一种外切核糖核酸酶,它们是通过从 RNA 分子的 5' 端或 3' 端去除末端核苷酸来降解 RNA 的酶。从 5' 端去除核苷酸的酶被称为 5'-3' 外切核糖核酸酶,而从 3' 端去除核苷酸的酶被称为 3'-5' 外切核糖核酸酶。
外切核糖核酸酶可以使用水来切割核苷酸之间的键(称为水解活性),也可以使用无机磷酸盐(称为磷解活性)。水解外切核糖核酸酶在 EC 号码 3.1 下分类,而磷解外切核糖核酸酶在 EC 号码 2.7.7 下分类。由于磷解酶使用无机磷酸盐来切割键,因此它们会释放核苷酸二磷酸盐,而水解酶(使用水)则会释放核苷酸单磷酸盐。外切核糖核酸酶存在于所有生物界中,包括细菌、古细菌和真核生物。外切核糖核酸酶参与许多不同 RNA 种类的降解,包括信使 RNA、转运 RNA、核糖体 RNA 和 miRNA。外切核糖核酸酶可以是单个蛋白质(如 RNase D 或 RNase PH),也可以是多个蛋白质的复合物,如外泌体复合物(其中代表了四个主要的核糖核酸酶家族)[33]
RNase A RNase A 是一种相对较小的蛋白质(124 个残基,约 13.7 kDa)。它可以被描述为一种双层 α + β 蛋白质,折叠成两半,类似于一个玉米卷,有一个深的裂缝用于结合 RNA 底物。第一层由来自蛋白质 N 末端一半的三个 α 螺旋组成(残基 3-13、24-34 和 50-60)。第二层由三个 β 发夹组成(残基 61-74、79-104 和 105-124 来自 C 末端一半),排列成两个 β 片层。发夹 61-74 和 105-124 形成了一个四链的反平行 β 片层,位于螺旋 3(残基 50-60)上。最长的 β 发夹 79-104 与一条短的 β 链(残基 42-45)配对,形成一个三链的反平行 β 片层,位于螺旋 2(残基 24-34)上。RNase A 在其天然状态下有四个二硫键:Cys26-Cys84、Cys58-110、Cys40-95 和 Cys65-72。前两个(26-84 和 58-110)对于构象折叠至关重要;每个都将第一层的 α 螺旋连接到第二层的 β 片层,在其附近形成一个小的疏水核心。后两个二硫键(40-95 和 65-72)对于折叠来说不太重要;其中任何一个都可以被还原(但不能同时还原)而不会影响生理条件下的天然结构。这些二硫键连接环段,并且相对暴露在溶剂中。有趣的是,65-72 二硫键具有非常高的形成倾向,远远超过肽和全长蛋白质中预期的环熵。这表明 61-74 β 发夹具有很高的构象折叠倾向。RNase A 是一种碱性蛋白质(pI = 8.63);它的大量正电荷与其结合 RNA(一种多阴离子)一致。更普遍地说,RNase A 异常极性,或者说,异常缺乏疏水基团,尤其是脂肪族基团。这可能是其需要四个二硫键来稳定其结构的原因。低疏水含量还可以减少高度带电基团(其自身和其底物 RNA 的基团)与低介电常数区域(非极性残基)之间的物理排斥。RNase A 的 N 末端 α 螺旋(残基 3-13)通过一个灵活的连接体(残基 16-23)连接到 RNase A 的其余部分。如 F. M. Richards 所示,该连接体可以通过枯草杆菌蛋白酶在残基 20 和 21 之间被切割,而不会导致 N 末端螺旋从 RNase A 的其余部分解离。肽-蛋白质复合物称为 RNase S,肽(残基 1-20)称为 S-肽,其余部分(残基 21-124)称为 S-蛋白质。S-肽对 S-蛋白质的解离常数约为 30 pM;这种紧密的结合可用于蛋白质纯化,方法是将 S-肽连接到目标蛋白质上,并将混合物通过一个带有结合的 S-蛋白质的亲和柱。[一个更小的 C-肽(残基 1-13)也可以工作。] RNase S 模型系统也被用于研究蛋白质折叠,方法是将折叠和缔合耦合在一起。S-肽是第一个来自天然蛋白质的肽,被证明在分离状态下具有(闪烁的)二级结构(由 Klee 和 Brown 在 1967 年发现)。[34]
RNase H 在分子生物学实验室中,由于 RNase H 特异性地降解 RNA:DNA 杂交体中的 RNA,而不会降解 DNA 或非杂交 RNA,因此它通常用于在逆转录酶逆转录合成第一链互补 DNA(cDNA)后破坏 RNA 模板,以及核酸酶保护测定等程序。RNase H 也可以用于在 cDNA 寡核苷酸杂交时降解特定的 RNA 链,例如从与 oligo(dT) 杂交的 mRNA 中去除 poly(A) 尾巴,或破坏活细胞内部或外部的选定非编码 RNA。为了终止反应,通常添加螯合剂,如 EDTA,以螯合反应混合物中所需的金属离子。RNase H 酶是一种非特异性内切核酸酶,并通过水解机制催化 RNA 的切割。RNase H 家族的成员几乎可以在所有生物体中找到,从古细菌和原核生物到真核生物。
RNase H 的 3-D 结构通常由一个被 α 螺旋分布包围的 5 链 β 片层组成。在一些 RNase H 中,例如在 HIV-1 中发现的 RNase H,该酶缺少一个称为 C 螺旋的螺旋,这是一个带正电的 α 螺旋,其突出形状增加了底物结合能力。该酶的活性位点围绕一个保守的 DEDD 基序(由残基组成:D443、E478、D498 和 D549)集中,该基序执行 RNA 底物的水解。镁离子通常用作水解步骤中的辅因子。这是一种可能的但未经证实的机制,其中多个离子对于执行水解是必要的。该酶还包含一个大约 60 Å 长的核酸结合裂缝,可以包含 18 个结合的 RNA/DNA 碱基对区域。RNase H 的核糖核酸酶活性切割 DNA/RNA 双链中 RNA 的 3’-O-P 键,产生 3’-羟基和 5’-磷酸终止产物。在 DNA 复制中,RNase H 负责去除 RNA 引物,从而完成新合成的 DNA。[35]
RNAi
[edit | edit source]
RNAi 的发现早于反义 RNA 在转基因植物中表达导致转录抑制的观察[37],更直接地说是由 1990 年代初美国和荷兰的植物科学家在实验中观察到的意外结果[38]。为了改变牵牛花的花色,研究人员将编码查耳酮合酶的基因的额外拷贝(一种花色素沉着的重要酶)引入到通常为粉红色或紫色的牵牛花中。过表达的基因预计会导致更深的花朵,但相反,它产生了色素沉着更少的,完全或部分白色的花朵,表明查耳酮合酶的活性已大幅下降;事实上,白色花朵中的内源基因和转基因都被下调。不久之后,在真菌粗糙脉孢霉中观察到了一种相关的事件,称为抑制[39],尽管当时并没有立即认识到它与之相关。对植物中这种现象的进一步研究表明,下调是由于通过增加 mRNA 降解速率导致的基因表达的转录后抑制[40]。这种现象被称为基因表达的共抑制,但其分子机制仍然未知[41]。

不久之后,从事提高植物抗病毒病能力的植物病毒学家观察到类似的意外现象。虽然众所周知,表达病毒特异性蛋白质的植物表现出增强的对病毒感染的耐受性或抵抗力,但人们没有想到的是,仅携带病毒 RNA 序列的短片段非编码区域的植物会表现出类似的保护水平。研究人员认为,转基因产生的病毒 RNA 也可以抑制病毒复制[43]。反向实验,其中将植物基因的短序列引入病毒,表明目标基因在受感染的植物中被抑制。这种现象被称为“病毒诱导的基因沉默”(VIGS),而这一系列现象统称为转录后基因沉默[44]。
在植物中观察到这些初步现象后,世界各地的许多实验室开始研究这种现象是否也存在于其他生物体中。[45] [46] 1998 年,克雷格·梅洛和安德鲁·法尔在《自然》杂志上发表了一篇论文,报道了将双链 RNA 注入秀丽隐杆线虫后,观察到了一种强大的基因沉默效应。在研究肌肉蛋白产生的调控过程中,他们发现无论是 mRNA 还是反义 RNA 注射都没有影响蛋白的产生,但双链 RNA 成功地沉默了目标基因。基于这项研究,他们创造了“RNAi”这个术语。法尔和梅洛的发现尤为突出,因为它首次确定了这种现象的致病因子。由于他们的工作,法尔和梅洛获得了 2006 年诺贝尔生理学或医学奖。
RNAi 是一种依赖于 RNA 的基因沉默过程,由 RNA 诱导沉默复合物 (RISC) 控制,由细胞质中的短双链 RNA 分子引发,这些分子与催化性 RISC 成分 Argonaute 相互作用。当 dsRNA 来自外源 (来自具有 RNA 基因组的病毒感染或实验室操作) 时,RNA 会直接导入细胞质并被 Dicer 酶切割成短片段。引发性 dsRNA 也可能来自内源 (起源于细胞),就像基因组中编码 RNA 的基因表达的 pre-microRNA 一样。来自这些基因的初级转录本首先在细胞核中被加工成 pre-miRNA 的特征性茎环结构,然后被转运到细胞质中,并被 Dicer 切割。因此,外源和内源的两种 dsRNA 途径在 RISC 复合物处汇聚。[47]
dsRNA 切割
内源 dsRNA 通过激活核糖核酸酶蛋白 Dicer 来启动 RNAi,Dicer 结合并切割双链 RNA (dsRNA) 来产生 20-25 个碱基对的双链片段,并在 3' 端具有 2 个核苷酸的突出部分。对多种生物基因组进行的生物信息学研究表明,这种长度最大限度地提高了靶基因的特异性并最大限度地减少了非特异性效应。[10] 这些短的双链片段被称为小干扰 RNA (siRNA)。这些 siRNA 然后被分离成单链并整合到一个活性 RISC 复合物中。整合到 RISC 后,siRNA 与其靶 mRNA 配对并诱导 mRNA 切割,从而阻止其用作翻译模板。
RISC
RNA 诱导沉默复合物 (RISC) 是一种多蛋白复合物,包含一小干扰 RNA (siRNA) 或 micro RNA (miRNA) 的一条链。RISC 使用 siRNA 或 miRNA 作为模板来识别互补的 mRNA。当它找到互补链时,它就会激活 RNase 并切割 RNA。此过程在 microRNA 调控基因表达和抵御病毒感染方面都至关重要,病毒感染通常使用双链 RNA 作为感染载体。
RNA 诱导沉默复合物 (RISC) 的活性成分是称为 Argonaute 蛋白的内切核酸酶,它们切割与其结合的 siRNA 互补的靶 mRNA 链。由于 Dicer 产生的片段是双链的,因此理论上它们每个都可以产生一个功能性 siRNA。然而,只有两条链中的一条 (被称为引导链) 结合 Argonaute 蛋白并引导基因沉默。另一条反引导链或乘客链在 RISC 活化过程中被降解。
Dicer
Dicer 是 RNase III 家族中的一种核糖核酸内切酶,它将双链 RNA (dsRNA) 和 pre-microRNA (miRNA) 切割成称为小干扰 RNA (siRNA) 的短双链 RNA 片段,长度约为 20-25 个核苷酸,通常在 3' 端具有两个碱基的突出部分。Dicer 包含两个 RNase III 结构域和一个 PAZ 结构域;这两个区域之间的距离由连接螺旋的长度和角度决定,并决定了它产生的 siRNA 的长度。Dicer 催化 RNA 干扰途径中的第一步,并启动 RNA 诱导沉默复合物 (RISC) 的形成,其催化成分 Argonaute 是一种能够降解信使 RNA (mRNA) 的内切核酸酶,该 mRNA 的序列与其 siRNA 指导链互补。[48] 该基因的人类版本是 DICER1。
RNAi 和疾病控制
[编辑 | 编辑源代码]在治疗中利用 RNA 干扰可能是可行的。虽然由于干扰素反应很难将长的 dsRNA 链引入哺乳动物细胞,但使用短干扰 RNA 模拟物取得了更大的成功。在进入临床试验的首批应用中,包括治疗黄斑变性症和呼吸道合胞病毒,RNAi 还被证明可以有效逆转小鼠模型中诱导的肝衰竭。
其他提出的临床应用集中在抗病毒治疗上,包括使用 RNAi 来治疗感染的局部微杀剂治疗 (在哈佛大学医学院;目前在小鼠中),例如抑制 2 型单纯疱疹病毒感染,以及抑制癌细胞中病毒基因表达,敲除 HIV 的宿主受体和辅助受体,沉默乙型肝炎和丙型肝炎基因,沉默流感病毒基因表达,以及抑制麻疹病毒复制。还提出了用于治疗神经退行性疾病的潜在疗法,尤其关注亨廷顿氏舞蹈症等多聚谷氨酰胺疾病。RNA 干扰通常被认为是一种很有前景的治疗癌症的方法,通过沉默在肿瘤细胞中差异上调的基因或参与细胞分裂的基因来实现。在将 RNAi 用于临床应用的研究中,一个关键领域是开发安全的递送方法,到目前为止,这主要涉及类似于基因治疗的病毒载体系统。
MicroRNA (miRNA)
[编辑 | 编辑源代码]MicroRNA 于 1993 年由维克多·安布罗斯、罗莎琳德·李和罗达·费恩鲍姆在研究秀丽隐杆线虫发育中的 lin-14 基因时发现。他们发现 LIN-14 蛋白的丰度受 lin-4 基因编码的短 RNA 产物调控。来自 lin-4 基因的 61 个核苷酸前体成熟成一个 22 个核苷酸的 RNA,该 RNA 包含与 lin-14 mRNA 3' UTR 中多个序列部分互补的序列。这种互补性足以且有必要抑制 lin-14 mRNA 翻译成 LIN-14 蛋白。回顾过去,lin-4 小 RNA 是第一个被识别的 microRNA,尽管当时人们认为它只是线虫的一种特异性现象。直到 2000 年,人们才鉴定了第二个 RNA:let-7,它在秀丽隐杆线虫发育阶段转换过程中抑制了 lin-41、lin-14、lin-28、lin-42 和 daf-12 的表达。let-7 很快被发现保存在许多物种中,表明存在更广泛的现象。
MicroRNA (miRNA) 是短的核糖核酸 (RNA) 分子,平均只有 22 个核苷酸长,存在于所有真核细胞中。miRNA 是转录后调节因子,它们与靶信使 RNA 转录物 (mRNA) 上的互补序列结合,通常导致翻译抑制和基因沉默。
miRNA 的功能似乎是基因调控。为此,miRNA 与一个或多个信使 RNA (mRNA) 的一部分互补。动物 miRNA 通常与 3' UTR 中的一个位点互补,而植物 miRNA 通常与 mRNA 的编码区互补。与靶 RNA 完美或几乎完美的碱基配对促进 RNA 的切割。这是植物 microRNA 的主要模式。在动物中,microRNA 更常只部分配对并抑制靶 mRNA 的蛋白质翻译 (这在植物中也存在,但不太常见)。部分互补的 microRNA 也可以加速去腺苷化,导致 mRNA 更快地降解。对于部分互补的 microRNA 来识别其靶标,miRNA 的 2-7 个核苷酸 (其“种子区”) 仍然必须完美互补。[68] miRNA 有时也会引起启动子位点的组蛋白修饰和 DNA 甲基化,从而影响靶基因的表达。动物 microRNA 特别针对发育基因。相反,参与所有细胞共同功能 (例如基因表达) 的基因只有很少的 microRNA 靶位点,似乎在选择中避免被 microRNA 靶向。dsRNA 也可以激活基因表达,这种机制被称为“小 RNA 诱导的基因激活”或 RNAa。靶向基因启动子的 dsRNA 可以诱导相关基因的强力转录激活。这在人类细胞中使用称为小激活 RNA (saRNA) 的合成 dsRNA 进行了证明,但对于内源 microRNA 也得到了证明。[49]
miRNA 和疾病
正如 miRNA 参与真核细胞的正常功能一样,miRNA 的失调也与疾病相关。一个手动整理的、公开可用的数据库 miR2Disease 记录了已知的 miRNA 失调与人类疾病之间的关系。
**miRNA 和癌症** 已经发现几种 miRNA 与某些类型的癌症有关。一项对改造后的产生过量 c-Myc 的小鼠 (一种与多种癌症相关的突变形式蛋白) 的研究表明,miRNA 对癌症的发展有影响。被改造为产生淋巴瘤细胞中发现的过量类型 miRNA 的小鼠在 50 天内患上了该疾病,并在两周后死亡。相比之下,没有过量 miRNA 的小鼠存活了 100 多天。白血病可能是由于病毒基因组插入到 microRNA 的 17-92 阵列旁边导致这种 microRNA 表达增加引起的。另一项研究发现,两种类型的 miRNA 抑制 E2F1 蛋白,该蛋白调节细胞增殖。miRNA 似乎在信使 RNA 被翻译成开启和关闭基因的蛋白质之前就与信使 RNA 结合。通过测量编码 miRNA 的 217 个基因的活性,可以辨别出可以区分癌症类型的基因活性模式。miRNA 特征可能使癌症分类成为可能。这将使医生能够确定产生癌症的原始组织类型,并能够根据原始组织类型进行靶向治疗方案。miRNA 谱分析已经能够确定慢性淋巴细胞白血病患者的癌症是缓慢生长还是侵袭性。过表达或缺乏特定 miRNA 的转基因小鼠为深入了解小 RNA 在各种恶性肿瘤中的作用提供了见解。一种新的基于 miRNA 谱分析的早期结直肠癌检测筛选方法已经开发出来,目前正在进行临床试验。早期结果表明,从早期、可切除 (II 期) 结直肠癌患者收集的血浆样本可以与性别和年龄匹配的健康志愿者区分开来。使用少量 (小于 1 毫升) 的血液样本可以实现足够的选择性和特异性。该测试有可能成为一种经济高效、无创的方法,用于识别应进行结肠镜检查的高风险患者。
miRNA 和心脏病 通过条件性抑制小鼠心脏中的 miRNA 成熟,已阐明了 miRNA 在心脏中的全局作用,并揭示了 miRNA 在心脏发育中的重要作用。miRNA 表达谱分析表明,特定 miRNA 的表达水平在患病的人类心脏中发生变化,这表明它们与心肌病有关。此外,对动物模型中特定 miRNA 的研究已经确定了 miRNA 在心脏发育和病理条件下的不同作用,包括对心肌生成、肥大生长反应和心脏传导的重要因子的调节。
miRNA 和神经系统 miRNA 似乎调节着神经系统。神经 miRNA 参与突触发育的各个阶段,包括树突形成(涉及 miR-132、miR-134 和 miR-124)、突触形成和突触成熟(据认为 miR-134 和 miR-138 参与其中)。一些研究发现精神分裂症患者的 miRNA 表达发生改变。
这是一个自然界中RNA 列表。其中一些类别很宽泛,另一些则是单个 RNA 家族。
| 类型 | 缩写 | 功能 | 分布 | 参考 |
|---|---|---|---|---|
| 信使 RNA | mRNA | 编码蛋白质 | 所有生物体 | |
| 核糖体 RNA | rRNA | 翻译 | 所有生物体 | |
| 信号识别颗粒 RNA | 7SL RNA 或 SRP RNA | 膜整合 | 所有生物体 | [50] |
| 转运 RNA | tRNA | 翻译 | 所有生物体 | |
| 转运-信使 RNA | tmRNA | 拯救停滞的核糖体 | 细菌 | [51] |
| 类型 | 缩写 | 功能 | 分布 | 参考 |
|---|---|---|---|---|
| 小核 RNA | snRNA | 剪接和其他功能 | 真核生物和古细菌 | [52] |
| 小核仁 RNA | snoRNA | RNA 的核苷酸修饰 | 真核生物和古细菌 | [53] |
| SmY RNA | SmY | mRNA 转剪接 | 线虫 | [54] |
| 小卡哈尔体特异性 RNA | scaRNA | snoRNA 类型;RNA 的核苷酸修饰 | ||
| 引导 RNA | gRNA | mRNA 核苷酸修饰 | 动基体线粒体 | [55] |
| 核糖核酸酶 P | RNase P | tRNA 成熟 | 所有生物体 | [56] |
| 核糖核酸酶 MRP | RNase MRP | rRNA 成熟,DNA 复制 | 真核生物 | [57] |
| Y RNA | RNA 加工,DNA 复制 | 动物 | [58] | |
| 端粒酶 RNA | 端粒合成 | 大多数真核生物 | [59] |
| 类型 | 缩写 | 功能 | 分布 | 参考 |
|---|---|---|---|---|
| 反义 RNA | aRNA | 转录衰减/mRNA 降解/mRNA 稳定/翻译阻滞 | 所有生物体 | [60][61] |
| 顺式天然反义转录本 | 基因调控 | |||
| CRISPR RNA | crRNA | 抵抗寄生虫,可能是通过靶向其 DNA | 细菌和古细菌 | [62] |
| 长非编码 RNA | Long ncRNA | 多种多样 | 真核生物 | |
| 微小 RNA | miRNA | 基因调控 | 大多数真核生物 | [63] |
| Piwi 相互作用 RNA | piRNA | 转座子防御,可能还有其他功能 | 大多数动物 | [64][65] |
| 小干扰 RNA | siRNA | 基因调控 | 大多数真核生物 | [66] |
| 反式作用 siRNA | tasiRNA | 基因调控 | 陆地植物 | [67] |
| 重复相关 siRNA | rasiRNA | piRNA 类型;转座子防御 | 果蝇 | [68] |
| 7SK RNA | 7SK | 负向调节 CDK9/cyclin T 复合物 |
| 类型 | 功能 | 分布 | 参考 |
|---|---|---|---|
| 逆转座子 | 自我复制 | 真核生物和一些细菌 | [69] |
| 病毒基因组 | 信息载体 | 双链 RNA 病毒、正链 RNA 病毒、负链 RNA 病毒、许多卫星病毒和逆转录病毒 | |
| 类病毒 | 自我复制 | 受感染的植物 | [70] |
| 卫星 RNA | 自我复制 | 受感染的细胞 |
| 类型 | 缩写 | 功能 | 分布 | 参考 |
|---|---|---|---|---|
| 拱顶 RNA | vRNA | 可能排出异生素 | [71] |
- ↑ RNA
- ↑ Dahm R (2005). "Friedrich Miescher and the discovery of DNA". Developmental Biology. 278 (2): 274–88. doi:10.1016/j.ydbio.2004.11.028. PMID 15680349.
- ↑ Caspersson T, Schultz J (1939). "Pentose nucleotides in the cytoplasm of growing tissues". Nature. 143: 602–3. doi:10.1038/143602c0.
- ↑ Ochoa S (1959). "Enzymatic synthesis of ribonucleic acid" (PDF). Nobel Lecture.
- ↑ Holley RW; et al. (1965). "Structure of a ribonucleic acid". Science. 147 (1664): 1462–65. doi:10.1126/science.147.3664.1462. PMID 14263761.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ↑ Siebert S (2006). "Common sequence structure properties and stable regions in RNA secondary structures" (PDF). Dissertation, Albert-Ludwigs-Universität, Freiburg im Breisgau. p. 1.
- ↑ Szathmáry E (1999). "The origin of the genetic code: amino acids as cofactors in an RNA world". Trends Genet. 15 (6): 223–9. doi:10.1016/S0168-9525(99)01730-8. PMID 10354582.
- ↑ Fiers W 等人 (1976)。“噬菌体 MS2-RNA 的完整核苷酸序列:复制酶基因的初级和二级结构”。自然。260 (5551): 500–7。 doi:10.1038/260500a0。 PMID 1264203.
{{cite journal}}: 在 |author= 中显式使用 et al. (帮助) - ↑ Napoli C, Lemieux C, Jorgensen R (1990)。“将嵌合查尔酮合酶基因导入矮牵牛会导致转座同源基因的可逆共抑制”。植物细胞。2 (4): 279–89。 doi:10.1105/tpc.2.4.279。 PMC 159885。 PMID 12354959.
{{cite journal}}: CS1 maint: 多个名称:作者列表 (链接) - ↑ Dafny-Yelin M, Chung SM, Frankman EL, Tzfira T (2007)。“pSAT RNA 干扰载体:用于植物中多个基因下调的模块化系列”。植物生理。145 (4): 1272–81。 doi:10.1104/pp.107.106062。 PMC 2151715。 PMID 17766396.
{{cite journal}}: 未知参数 |month= 被忽略 (帮助)CS1 maint: 多个名称:作者列表 (链接) - ↑ Ruvkun G (2001)。“微小 RNA 世界的瞥见”。科学。294 (5543): 797–99。 doi:10.1126/science.1066315。 PMID 11679654.
- ↑ Fichou Y, Férec C (2006)。“寡核苷酸在治疗应用中的潜力”。生物技术趋势。24 (12): 563–70。 doi:10.1016/j.tibtech.2006.10.003。 PMID 17045686.
- ↑ 小核仁 RNA
- ↑ 反义 RNA
- ↑ RNA
- ↑ http://www.madsci.org
- ↑ Horton,Robert H.;等人。生物化学原理。第 3 版。新泽西州上鞍河:普伦蒂斯·霍尔,2002 年。
- ↑ Zorbach,W.W. 核酸化学合成程序:结构测定的物理和物理化学辅助。第 2 卷。纽约:Wiley-Interscience,1973 年。
- ↑ Lee,J.K.;Kurinovich,Ma。J Am Soc Mass Spectrom.13(8),2005 年,985-95。
- ↑ SnRNP
- ↑ 酶定义 Dictionary.com 2007 年 4 月 6 日访问
- ↑ Carl Woese,遗传密码(纽约:Harper and Row,1967 年)。
- ↑ 1989 年诺贝尔化学奖颁发给了 Thomas R. Cech 和 Sidney Altman,以表彰他们“发现 RNA 的催化特性”。
- ↑ Kruger K, Grabowski PJ, Zaug AJ, Sands J, Gottschling DE, Cech TR (1982)。“自剪接 RNA:四膜虫核糖体 RNA 插入序列的自动切除和自动环化”。细胞。31 (1): 147–57。 PMID 6297745.
{{cite journal}}: 未知参数 |month= 被忽略 (帮助)CS1 maint: 多个名称:作者列表 (链接) - ↑ Forster AC, Symons RH (1987)。“病毒体及其结构模型的正反义 RNA 的自剪切”。细胞。49 (2): 211–220。 doi:10.1016/0092-8674(87)90562-9。 PMID 2436805.
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001)。“RNA 催化的 RNA 聚合:准确且通用的 RNA 模板引物延伸” (PDF)。科学。292 (5520): 1319–25。 doi:10.1126/science.1060786。 PMID 11358999.
{{cite journal}}: CS1 maint: 多个名称:作者列表 (链接) - ↑ W. K. Johnston,P. J. Unrau,M. S. Lawrence,M. E. Glasner 和 D. P. Bartel RNA 催化的 RNA 聚合:准确且通用的 RNA 模板引物延伸。科学 292,1319 (2001)
- ↑ Hani S. Zaher 和 Peter J. Unrau,选择具有优越延伸性和保真度的改进的 RNA 聚合酶核酶。RNA (2007),13:1017-1026
- ↑ Huang,Yang 和 Yarus,具有两种小分子底物的 RNA 酶。化学与生物学,第 5 卷,669-678,1998 年 11 月
- ↑ Unrau, P. J. (1998). "RNA 催化的核苷酸合成". 自然. 395 (6699): 260–263. doi:10.1038/26193. PMID 9751052.
{{cite journal}}: 引文格式有错误:缺少参数:|month=(帮助); 忽略了未知参数:|coauthors=(|author=建议用) (帮助) - ↑ Zhang, Biliang (1997). "体外选择的核酶介导的肽键形成". 自然. 390 (6655): 96–100. doi:10.1038/36375. PMID 9363898.
{{cite journal}}: 引文格式有错误:缺少参数:|month=(帮助); 忽略了未知参数:|coauthors=(|author=建议用) (帮助) - ↑ Szathmary, E. (1999). "遗传密码的起源:RNA 世界中的氨基酸作为辅因子". 遗传学趋势. 15 (6): 223–229. doi:10.1016/S0168-9525(99)01730-8. PMID 10354582.
{{cite journal}}: 引文格式有错误:缺少参数:|month=和|coauthors=(帮助) - ↑ 核糖核酸酶
- ↑ http://en.wikipedia.org/w/index.php?title=Ribonuclease_A&oldid=417169401
- ↑ http://en.wikipedia.org/w/index.php?title=RNase_H&oldid=422163070
- ↑ Macrae I, Zhou K, Li F, Repic A, Brooks A, Cande W, Adams P, Doudna J (2006). "Dicer 介导的双链 RNA 加工的结构基础". 科学. 311 (5758): 195–8. doi:10.1126/science.1121638. PMID 16410517.
{{cite journal}}: CS1 maint: 多个名字:作者列表 (链接) - ↑ Ecker JR, Davis RW (1986). "通过反义 RNA 表达抑制植物细胞基因表达". 美国国家科学院院刊. 83 (15): 5372–5376. doi:10.1073/pnas.83.15.5372. PMC 386288. PMID 16593734.
- ↑ Napoli C, Lemieux C, Jorgensen R (1990). "将嵌合查尔酮合酶基因导入矮牵牛会导致同源基因反式沉默的可逆性". 植物细胞. 2 (4): 279–289. doi:10.1105/tpc.2.4.279. PMC 159885. PMID 12354959.
{{cite journal}}: CS1 maint: 多个名字:作者列表 (链接) - ↑ Romano N, Macino G (1992). "沉默:通过同源序列转化使链孢霉基因表达短暂失活". 分子微生物学. 6 (22): 3343–53. doi:10.1111/j.1365-2958.1992.tb02202.x. PMID 1484489.
- ↑ Van Blokland R, Van der Geest N, Mol JNM, Kooter JM (1994). "矮牵牛中转基因介导的查尔酮合酶表达抑制是由 RNA 周转率增加引起的". 植物杂志. 6: 861–77. doi:10.1046/j.1365-313X.1994.6060861.x/abs/.
{{cite journal}}: CS1 maint: 多个名字:作者列表 (链接) - ↑ Mol JNM, van der Krol AR (1991). 反义核酸和蛋白质:基础和应用. M. Dekker. pp. 4, 136. ISBN 0824785169.
- ↑ Matzke MA, Matzke AJM. (2004). "播下新范式的种子". PLOS 生物学. 2 (5): e133. doi:10.1371/journal.pbio.0020133. PMC 406394. PMID 15138502.
- ↑ Covey S,Al-Kaff N,Lángara A,Turner D(1997)。“植物通过基因沉默对抗感染”。自然。385:781–2。 doi:10.1038/385781a0.
{{cite journal}}:CS1 维护:多个名称:作者列表 (link) - ↑ Ratcliff F,Harrison B,Baulcombe D(1997)。“植物病毒防御与基因沉默之间的相似性”。科学。276:1558–60。 doi:10.1126/science.276.5318.1558。 PMID 18610513.
{{cite journal}}:CS1 维护:多个名称:作者列表 (link) - ↑ Guo S,Kemphues K(1995)。“par-1,一个建立秀丽隐杆线虫胚胎极性的基因,编码一个不对称分布的推定Ser/Thr激酶”。细胞。81(4):611–20。 doi:10.1016/0092-8674(95)90082-9。 PMID 7758115.
- ↑ Pal-Bhadra M,Bhadra U,Birchler J(1997)。“果蝇中的共抑制:白色-Adh 转基因对酒精脱氢酶的基因沉默依赖于多梳蛋白”。细胞。90(3):479–90。 doi:10.1016/S0092-8674(00)80508-5。 PMID 9267028.
{{cite journal}}:CS1 维护:多个名称:作者列表 (link) - ↑ Bagasra O,Prilliman KR(2004)。“RNA 干扰:分子免疫系统” (PDF)。J. Mol. Histol。35(6):545–53。 doi:10.1007/s10735-004-2192-8。 PMID 15614608.
- ↑ Jaronczyk K,Carmichael J,Hobman T(2005)。“探索 RNA 干扰途径蛋白的功能:有些功能比其他功能更冒险?”。Biochem J。387(第 3 部分):561–71。 doi:10.1042/BJ20041822。 PMC 1134985。 PMID 15845026.
{{cite journal}}:CS1 维护:多个名称:作者列表 (link) - ↑ 微小RNA
- ↑ Gribaldo1 S,Brochier-Armanet C(2006)。“古菌的起源和进化:现状”。Philos Trans R Soc Lond B Biol Sci。361(1470):1007–22。 doi:10.1098/rstb.2006.1841。 PMC 1578729。 PMID 16754611.
- ↑ Gillet R,Felden B(2001)。“关于 tmRNA 介导的蛋白质标记和核糖体拯救的新观点”。分子微生物学。42(4):879–85。 doi:10.1046/j.1365-2958.2001.02701.x。 PMID 11737633.
- ↑ Thore S,Mayer C,Sauter C,Weeks S,Suck D(2003)。“深海热液球菌Sm 核心的晶体结构及其与 RNA 的复合物”。J. Biol. Chem。278(2):1239–47。 doi:10.1074/jbc.M207685200。 PMID 12409299.
{{cite journal}}:CS1 维护:多个名称:作者列表 (link) - ↑ Kiss T(2001)。“小核仁 RNA 引导的细胞 RNA 转录后修饰”。欧洲分子生物学组织杂志。20(14):3617–22。 doi:10.1093/emboj/20.14.3617。 PMC 125535。 PMID 11447102.
- ↑ Jones TA, Otto W, Marz M, Eddy SR, Stadler PF (2009). "线虫 SmY RNA 的调查". RNA Biol. 6 (1): 5–8. doi:10.4161/rna.6.1.7634. PMID 19106623.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Alfonzo JD, Thiemann O, Simpson L (1997). "动基体线粒体中 U 插入/缺失 RNA 编辑的机制". Nucleic Acids Research. 25 (19): 3751–59. doi:10.1093/nar/25.19.3751. PMC 146959. PMID 9380494.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Pannucci JA, Haas ES, Hall TA, Harris JK, Brown JW (1999). "一些古细菌的 RNase P RNA 具有催化活性". Proc Natl Acad Sci USA. 96 (14): 7803–08. doi:10.1073/pnas.96.14.7803. PMC 22142. PMID 10393902.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Woodhams MD, Stadler PF, Penny D, Collins LJ (2007). "RNase MRP 和真核祖先的 RNA 加工级联". BMC Evolutionary Biology. 7: S13. doi:10.1186/1471-2148-7-S1-S13. PMC 1796607. PMID 17288571.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Perreault J, Perreault J-P, Boire G (2007). "后生动物中 Ro 相关的 Y RNA:进化和多样化". Molecular Biology and Evolution. 24 (8): 1678–89. doi:10.1093/molbev/msm084. PMID 17470436.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Lustig AJ (1999). "危机干预:端粒酶的作用". Proc Natl Acad Sci USA. 96 (7): 3339–41. doi:10.1073/pnas.96.7.3339. PMC 34270. PMID 10097039.
- ↑ Brantl S (2002). "反义 RNA 调节和 RNA 干扰". Biochimica et Biophysica Acta. 1575 (1–3): 15–25. PMID 12020814.
- ↑ Brantl S (2007). "顺式编码反义 RNA 采用的调控机制". Curr. Opin. Microbiol. 10 (2): 102–9. doi:10.1016/j.mib.2007.03.012. PMID 17387036.
- ↑ Brouns SJ,Jore MM,Lundgren M 等人。 (2008)。“Small CRISPR RNAs guide antiviral defense in prokaryotes”。科学。321 (5891): 960–4。doi:10.1126/science.1159689。PMID 18703739.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Lin S-L,Miller JD,Ying S-Y (2006)。“内含子 microRNA (miRNA)”。生物医学与生物技术杂志。2006 (4): 1–13。doi:10.1155/JBB/2006/26818。PMC 1559912。PMID 17057362.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Horwich MD,Li C Matranga C,Vagin V,Farley G,Wang P,Zamore PD (2007)。“果蝇 RNA 甲基转移酶,DmHen1,修饰生殖系 piRNA 和 RISC 中的单链 siRNA”。当代生物学。17 (14): 1265–72。doi:10.1016/j.cub.2007.06.030。PMID 17604629.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Ghildiyal M,Zamore PD (2009)。“小型沉默 RNA:一个不断扩展的宇宙”。自然遗传学评论。10 (2): 94–108。doi:10.1038/nrg2504。PMC 2724769。PMID 19148191.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Ahmad K,Henikoff S (2002)。“核小体动力学的表观遗传学后果”。细胞。111 (3): 281–84。doi:10.1016/S0092-8674(02)01081-4.
- ↑ Vazquez F,Vaucheret H (2004)。“内源性反式作用 siRNA 调节拟南芥 mRNA 的积累”。分子细胞。2006 (16): 1–13。doi:10.1155/JBB/2006/26818。PMC 1559912。PMID 17057362.
- ↑ Desset S,Buchon N,Meignin C,Coiffet M,Vaury C (2008)。“在黑腹果蝇中,COM 基因座通过 Piwi 依赖性和非依赖性途径指导两种逆转录转座子的体细胞沉默”。PLoS ONE。3 (2): e1526。doi:10.1371/journal.pone.0001526。PMC 2211404。PMID 18253480.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Boeke JD (2003)。“逆转录转座子的非寻常系统发育分布:一种假设”。基因组研究。13 (9): 1975–83。doi:10.1101/gr.1392003。PMID 12952870.
- ↑ Flores R,Hernández C,Martínez de Alba AE,Daròs JA,Di Serio F(2005)。“类病毒和类病毒-宿主相互作用”。植物病理学年度评论。43:117–39。 doi:10.1146/annurev.phyto.43.040204.140243。 PMID 16078879.
{{cite journal}}:CS1 维护:作者列表有多个名称 (link) - ↑ Gopinath SC,Matsugami A,Katahira M,Kumar PK(2005)。“人类拱顶相关非编码 RNA 与化疗药物米托蒽醌结合”。核酸研究。33(15):4874–81。 doi:10.1093/nar/gki809。 PMC 1201340。 PMID 16150923.
{{cite journal}}:CS1 维护:作者列表有多个名称 (link)