分析化学发光/化学发光成像
化学发光成像结合了化学发光的灵敏检测与定位和量化发光的能力,但最重要的是,它提供了被分析物的平行测定。数字图像由数千个像素组成,每个像素由一个独立的传感器生成,检测和测量落在其上的光。这使得可以同时测量多个样品或被分析物以进行高通量筛选。
化学发光成像显微镜比荧光更简单、更准确地检测标记探针。它可能成为快速、早期诊断各种疾病的重要工具。整个动物体内化学发光成像使得实时监测病理和生物现象成为可能,我们可以预期在药物发现、生物技术和医学领域取得重大突破。[1]
过去二十年,我们在从分析信号中形成图像的能力方面取得了稳步进展。成像利用化学发光的灵敏度和特异性、低背景和宽动态范围来量化和定位被分析物,直到通过单光子发射实现的水平。早期系统由一个低光真空管设备[2] 连接到光学显微镜。CCD (电荷耦合器件) 和 CMOS (互补金属氧化物半导体) 图像传感器利用不同的技术,这两项技术都在 1960 年代后期和 1970 年代发明,用于以数字方式捕捉图像。两种类型的成像器都将光转换为电荷,并将其处理为电子信号,就像数码相机一样。它们都有各自的优势和劣势。就大多数方面而言,CCD 技术与 CMOS 技术相当。成本也类似。
对于化学发光成像,当被分析物空间分布至关重要时,必须生成一张发光图像以充分表达数据。这可以通过 CCD 来实现,它必须具有高光收集效率。CCD 将光亮度转换为电幅度信号。CCD 是在集成电路 (IC) 或芯片上形成的半导体栅极阵列。栅极分别收集、暂时存储和传输电荷,它代表图像的像素。当光照射到 CCD 传感器时,每个像素会产生一个小的电荷,每个电荷通过光电效应转换为电压并作为模拟信号输出,模拟信号可以通过额外的电路转换为数字信息。所有像素都可以用于光捕获。CCD 相机,例如数码相机,包括位于光学系统焦平面的 CCD 成像器 IC 和安装在印刷组件上的控制电路。捕捉到的图像数据存储在存储介质中,例如闪存或 IC 存储卡,并可以显示在显示器上,例如液晶显示器 (LCD)。CCD 历来提供最高的图像质量(以量子效率和噪声衡量)。增强型 CCD (ICCD) 相机通过光学方式连接到图像增强器。在图像增强器中,来自光源的光子落在光电阴极上,从而产生光电子。通过施加在光电阴极和 MCP 之间的电压,光电子被加速朝向微通道板 (MCP)。电子通过 MCP 被倍增,并被加速朝向磷光屏,磷光屏将它们转换回光子,光子通过光纤或透镜引导到 CCD。ICCD 相机允许高速帧率和实时可视化,其局限性是放大产生的噪声增加。非增强型慢扫描 CCD 相机,冷却以降低热噪声,允许在较长时间内积分信号,适用于稳态信号。
CMOS 图像传感器已经成为 CCD 传感器的替代品。它们由包含像素传感器阵列的集成电路 (IC) 组成,每个像素包含光电探测器、放大器和用于将电荷(代表光强度)转换为电压的附加电路。放大、噪声校正和数字化通常也在芯片上进行。这些其他功能增加了设计复杂性,并减少了可用于光捕获的区域。与 CCD 传感器不同,每个像素都进行自己的转换,因此均匀性较低,这会影响图像质量。但该芯片需要的芯片外电路更少。“金属氧化物半导体”一词意味着晶体管结构具有在氧化物绝缘体顶部的金属栅极电极,而氧化物绝缘体又在半导体顶部。CMOS 传感器用一个 p 型器件来补充每个 n 型晶体管,将一对栅极和漏极连接起来。因为理想情况下,除门输入被切换时外,电流不会流动,这极大地降低了功耗,并避免了过热,这是所有 IC 中的一个主要问题。与 CCD 相比,CMOS 可以用更少的组件实现,消耗更少的功率,并提供更快的读出速度。CMOS 成像器还提供更高的集成度(芯片上更多功能)和更小的尺寸。
可以使用 CMOS 传感器芯片作为化学发光检测的微型接触成像器和定量光度计。已研究了其在通过与玻璃盖玻片上制造的 1 毫米直径孔中的专用试剂反应,检测 ATP 的化学发光检测中的适用性,该玻璃盖玻片直接放置在成像传感器上。[3] 环境光被排除在外。对于每个孔,化学发光强度在一个 1 x 100 像素的感兴趣区域内平均,并在 200 毫秒的曝光时间内积分。它与 0.1-1 毫摩尔/dm−3 范围内的 ATP 浓度很好地相关。检测限(<1 纳摩尔 ATP)不如使用更昂贵的 CCD 相机获得的那么好,但有可能得到改善。当检测系统的成本是一个必须优化的因素时,例如在“即时”检测或诊断中,CMOS 芯片适合用于液滴微流控或芯片实验室设备。
适用于发光成像的相机应能够在 10−6 lux 的亮度下形成图像(1 lux = 550 nm 光的 1/621 W m−3)。最灵敏的相机可以探测到单个光子,效率约为 20%,平均噪声水平为 2 x 10−11 lux = 8 个光子 s−1 cm−2。可用的超低光成像系统包括与具有高数值孔径 (NA) 物镜的显微镜一起使用的成像光子探测器 (IPD)。高 NA 镜头比低 NA 镜头收集的光更多。收集的光聚焦到 IPD 上。光子被记录并存储为由 IPD 处理器创建的时间和空间坐标列表。图像可以重建为任何所需时间间隔内的点阵。这允许在任何时间间隔内进行连续记录;1 小时内 100 个光子/秒可以存储在 1 MB 的内存中(以图像形式存储每帧需要 0.3 MB)。化学发光图像基于少量光子,尤其是在曝光时间很短的情况下;虽然 10 分钟的曝光时间为每秒 100 个光子可以建立一个 60000 个光子的图像,但 1 秒的曝光时间仅提供 100 个光子,因此图像仅包含散布在图像区域的 100 个点[4] 一个高分辨率(高达 1392 x 1040)单光子计数相机系统适用于极低光子发射应用,例如某些化学发光应用。该系统包括一个带有数据采集和图像处理软件的控制单元。帧速率可达 100 Hz。
光子计数相机设计的概念化在 DELTA 相机中得到了很好的体现;该相机最初是为天文学设计的,它在各种高分辨率问题中具有优势。它是一种高灵敏度阵列探测器,可以提供光子事件的空间和时间坐标,其持续计数率优于每秒一百万个[5] 它具有平面场、非常高的分辨率(对于原型:空间 512 x 591 像素,时间 2.6 μs)和高通量。每个光子都会产生一个增强的磷光图像,该图像在二维场中的位置与光子相同。该图像聚焦到三个一维 CCD 上,这些 CCD 将其位置记录为三个相互垂直的坐标轴上的坐标。软件将这些坐标转换为正交轴上的 (x, y) 坐标,时钟信号将事件的时间 (t) 添加到生成 (x, y, t) 坐标,这些坐标被列出并存储;由于过度公差或同时光子事件造成的伪影也从数据中去除。
a(iv). 化学发光成像系统
[edit | edit source]一个高分辨率 CCD 相机(高达约 6.0 兆像素),冷却到约 -70 °C,可以提供最优质的图像、更好的精度、更长的曝光时间(高达 24 小时)、最小的暗噪声和增强的稳定性。应该有一个防光暗室和一个可调高度的样品平台,该平台具有一个数字计数器,用于在特定的可重复位置进行精确定位。另一种选择是先进的电机化机器人相机,它可以上下移动,允许相机靠近样品放置,性能优于标准变焦镜头,视野更广,操作更轻松、更快捷,灵敏度更高。这些优势对于微弱的样品尤其有用。图像采集和分析软件为凝胶、板和膜的简单图像捕获和分析以及菌落计数提供了全面的工具。图像可以增强,用户首选项可以定义,报告可以生成,数据可以导出。一些系统包括一个顶部白光,因此化学发光可以叠加在反射光图像上(所谓的“实时图像”),并结合了荧光、化学发光和比色应用的功能。
并非所有化学发光反应都适合成像;主要要求,尤其是对于成像显微镜,是微米级定位[1] 寿命短的激发态物质很适合,可以优化条件(尤其是反应物浓度)以最小化激发产物的扩散。由达到稳态产生的辉光型动力学促进了测量过程。酶标记被广泛使用。
D6b. 高通量筛选 (HTS)
[edit | edit source]成像非常适合高通量筛选。具有极高样品通量的检测方法示例包括生物利用度汞的测定,该测定已使用在汞诱导型启动子控制下表达荧光素酶的大肠杆菌在尿液中测定。通量超过每小时 5000 个样品,检测限为 10-13 mol dm−3。可以使用乙酰胆碱酯酶、胆碱氧化酶和辣根过氧化物酶 (HRP) 检测乙酰胆碱酯酶抑制剂。用每小时 180-360 个样品的通量进行鲁米诺化学发光的动力学分析。
b(i). 微阵列
[edit | edit source]使用平面场校正透镜的成像可以用于读取微孔板(高达 4 块 384 孔板),速度快于比色计,但比色计的灵敏度更高,并且能够测量快速、闪光型反应。抗体或基因探针的微阵列可以点在 96 孔微孔板上,并使用酶标记的检测试剂和化学发光底物进行检测。用 CCD 相机对整个板成像以测量每个孔的光发射。该原理已应用于细胞因子的夹心式酶联免疫吸附测定 (ELISA) 和基于杂交的 mRNA 测定,每个孔最多有 16 个点;16 x 96 阵列包含 1536 个点,可以使用标准板及其相关的样品处理设备进行高通量多分析物检测。
针对人乳头瘤病毒 (HPV) 基因型的寡核苷酸探针已用于一种多分析物化学发光成像检测方法,用于同时测定多达 7 种 HPV DNA。在存在地高辛标记核苷酸 (dUTP) 的情况下,通过聚合酶链反应 (PCR) 进行扩增,然后使用新型聚苯乙烯微孔板进行 ELISA,该微孔板具有 24 个主孔(包含地高辛标记 PCR 产物)的阵列,每个孔又分成 7 个子孔(包含固定化的探针)。地高辛标记随后用过氧化物酶标记抗体和化学发光底物检测。使用超灵敏 CCD 相机进行成像[6] 结果与传统的比色 PCR-ELISA 相当。
b(ii). 微阵列
[edit | edit source]通过对阵列密度高达每平方厘米数百个点的化学发光进行高分辨率成像,可以进行数千次同时测定。基于阵列的基因表达分析就是一个很好的例子。基于抗原-抗体或配体-受体相互作用的蛋白质分析越来越多地应用于临床和研究工作以及药物发现。除了用于蛋白质表达谱分析外,还有一些高通量蛋白质微阵列可以检测多达 35 种细胞因子。将特异性抗体点在膜上,然后与样品一起孵育,捕获的分析物通过增强化学发光使用 HRP 标记的抗体和 HRP 底物进行检测。用于肿瘤标记物平行 ELISA 的蛋白质芯片可以发现可以提高诊断敏感性和特异性的模式[7] 芯片上固定了 12 种针对不同肿瘤标记物的单克隆抗体,通过将芯片与血清样品一起孵育进行捕获。HRP 偶联的二抗用于通过化学发光成像进行检测。该芯片已成功应用于癌症诊断和对高危无症状人群进行筛查。
b(iii). 小型分析设备
[edit | edit source]小型分析仪器使用极小的样品量,因此需要非常灵敏的检测技术;化学发光成像具有所需的高分辨率和高灵敏度。分析方法包括使用镀金表面或玻璃毛细管对多个样品中除草剂 2,4-D 进行 ELISA 测定,以及在五分钟内对牛奶中最多十种抗生素进行测定:将样品与混合单克隆抗体一起孵育,然后使用 HRP 标记的二抗和合适的化学发光底物进行检测。可以在包含一排垂直玻璃通道的三维芯片中进行多次杂交。特异性基因探针固定在通道内壁上。这通过提供比二维微阵列中可用的更大的探针固定区域来增强信号。样品流过通道,并通过酶标记抗体和化学发光底物检测分析物。发射物种的横向扩散被微通道壁阻止;这提高了图像的分辨率。微型分析仪器的化学发光成像也适用于多重分析(同时对不同分析物或不同样品进行定量),方法是将化学发光在每个分析物或样品的不同目标区域上进行积分。
化学发光成像检测与 CCD 相机可用于发生在凝胶和膜上的反应。这允许在宽动态范围内进行强度测量,并且存在软件可用于计算图像特定区域的总发射量以进行分析目的。图像可以存储在磁盘上或打印出来。
电泳是带电分子的移动,因此是分离,在电场中;聚丙烯酰胺凝胶电泳 (PAGE) 特别适合分离低浓度分子。分离的分子可以通过电印迹转移到硝酸纤维素膜上 - 电泳方向垂直于凝胶表面;这也被称为蛋白质印迹,用于检测组织匀浆或提取物样品中的特定蛋白质。通过类似的程序,Southern 印迹识别复杂混合物中的特定 DNA 序列,Northern 印迹定位 RNA。在蛋白质印迹中,电印迹之后是免疫染色,其中特定蛋白质通过标记抗体识别。DNA 和 RNA 可以通过与标记探针杂交以类似方式识别。
斑点印迹是一种免疫技术,用于用抗体检测混合物或组织裂解液等样品中的特定蛋白质。它基于蛋白质印迹,但蛋白质在 SDS-PAGE 上没有分离。一种这样的分析方法是检测 B19 细小病毒。将样品点在膜上后,与地高辛偶联的 DNA 探针杂交并用 HRP 或 AP 标记的地高辛抗体处理,化学发光成像比使用比色法提供了十倍的检测限。
细胞色素可以通过使用十二烷基硫酸钠 (SDS-PAGE) 的 PAGE 分离并转移到硝酸纤维素膜上;细胞色素 c(包含催化血红素基团)通过过氧化物酶-鲁米诺化学发光检测。[8] CCD 成像产生的检测灵敏度是 3,3',5,5'-四甲基联苯胺染色方法的 50 倍。需要不到 1 毫升的细菌培养物样品。类似的分析方法基于鲁米诺/过氧化氢化学发光,使用过硫酸铵增强,检测 PAGE 后 15 μL 样品中的血红蛋白表型。[9] 其他含铁蛋白,如过氧化氢酶和铁蛋白,也可以被检测到。与传统的染色方法相比,所提出的检测方法非常快(几分钟对几小时)。
MIPs 具有与分析物形状、大小和功能互补的人工识别位点,因此它优先于其他密切相关的结构被选择。它们比抗体、酶和生物受体更便宜、更耐用,并且可以在这些生物分子不可用时使用。识别位点是围绕合适的模板(最好是分析物本身)制造的,该模板在聚合后被提取。
通常,当模板分子和功能单体在有机溶剂中混合时,模板和单体之间会通过极性相互作用形成络合物。与交联剂的聚合固定了极性基团的位置。用合适的溶剂去除模板会留下特定的识别位点。选择功能单体以促进与模板的氢键形成,以获得良好的选择性和可逆性。当 MIP 暴露于与聚合中使用的条件相同的条件下时,会发生最佳结合,因为它取决于印迹腔的形状以及配位功能基团的空间位置。这两者都取决于条件,并受聚合物溶胀的影响,这可以被利用来实现吸附分子的快速且可控的释放,然后进行检测。
聚合物的分子印迹已与化学发光成像检测相结合,以实现苯丙氨酸 (Phe) 的丹磺酰衍生物的手性识别。[10] 使用沉淀聚合(产生均匀的微球)以丹磺酰-L-Phe 为模板合成 MIP 微球,并将微球使用聚乙烯醇 (PVA) 作为粘合剂固定在微孔板(96 孔)上。分析物被选择性地吸附到 MIP 微球上。洗涤后,使用过氧草酸酯化学发光 (POCL) 分析对结合部分进行定量,POCL 分析是一种对所有荧光和荧光标记分析物通用的方法,其量子产率高于大多数其他化学发光系统。在存在丹磺酰-Phe 的情况下,双(2,4,6-三氯苯基)草酸酯与过氧化氢 (H2O2) 反应产生化学发光发射。信号由高度灵敏的冷却 CCD 检测和定量。使用软件对构成点的所有像素的强度进行求和,以确定板中每个孔的图像的强度。化学发光强度随着样品中 L-对映异构体的比例而增加。因此,可以通过比较混合物的强度以及相同浓度下纯 D-和 L-对映异构体的强度来确定手性组成。结果表明,基于 MIP 的化学发光成像对于快速手性识别非常有用,并且由于该方法可以在 30 分钟内同时进行许多独立测量,因此可以实现高通量筛选。
已经开发出一种简单、灵敏和特异的方法,用于激动霉素这种血管扩张剂的高通量检测。[11] 所提出的方法基于具有 MIP 识别的化学发光成像分析,提供选择性。
使用沉淀聚合以甲基丙烯酸 (MAA) 为功能单体,三羟甲基丙烷三甲基丙烯酸酯 (TRIM) 为交联剂,激动霉素为模板制备分子印迹微球。在没有模板的情况下制备非印迹聚合物 (NIP) 以用作对照。使用 0.1% PVA 作为粘合剂将微球包覆在 96 孔微孔板中。与样品孵育后,通过 POCL 确定聚合物结合的激动霉素量。使用冷却高分辨率 CCD 相机测量发射的光。每个孔的图像的强度如 c(i) 小节中所述确定。
在最佳条件下,相对化学发光强度与激动霉素浓度之间存在线性关系,范围为 0.02 到 10 μg ml−1。检测限为 0.006 μg ml−1。该方法通过测量加标尿液样品中的激动霉素浓度进行验证。在 MIP 存在的情况下,对尿液中许多正常成分的高耐受性被证明比在 NIP 存在的情况下大得多。基于 MIP 的化学发光成像对激动霉素具有高度选择性和灵敏度,并结合了高样品通量和经济性(50 μl/孔)。[12]
化学发光成像的目标分子包括抗原、DNA 序列、酶和代谢物。细胞、组织或整个动物的化学过程也可能成为目标。使用的方法包括成像显微镜、免疫组织化学 (IHC)、原位杂交 (ISH);也可以使用其他化学或酶促反应。化学发光图像叠加在可见光图像上,并通过背景扣除、对比度增强、伪彩色和对定义区域进行定量进行处理;绝对定量需要可重复的条件、校准系统和合适的样品特性。
化学发光成像显微镜使用普通显微镜,并优化了光收集。通过简单的镜头耦合系统,光损失最小化;无需盖玻片。显微镜或至少样品被置于暗箱中,以排除环境光,并有一个电机驱动的微米级载物台,允许自动调节。将样品与化学发光试剂孵育,直到获得稳态发射。物镜具有与可接受的焦散和景深相兼容的最高数值孔径 (NA)。使用干式而非油浸式物镜,并提供足够的放大倍率和空间分辨率,以定位单细胞或组织切片中的分析物;[13] HRP 的检测限约为 500 个分子/μm2。[14]
化学发光显微镜已成为生物医学研究的标准工具。光子探测器已连接到显微镜,并允许对细胞和组织中的化学发光探针和报告基因进行成像。光子计数技术允许连续成像数天,而不会创建过大的文件。然而,荧光成像比化学发光成像具有更好的空间分辨率,并且使多次测定更容易。
钙可以通过使用光蛋白水母素来确定细胞质和细胞器中的钙,水母素是一种从水母Aequorea victoria中提取的细胞内钙指示剂。天然水母素由一个多肽 (apo-水母素) 组成,它与一个疏水性辅基 (水母萤) 共价结合。使用水母素[3] 对游离细胞质钙进行成像的原理是,水母素分子在与钙结合时的构象变化,导致水母萤被氧化为水母酰胺,同时产生二氧化碳并发射蓝光 (466 nm)。水母素无法穿透细胞的质膜。微注射是确定大型细胞中细胞质钙的首选方法。对于小细胞,apo-水母素 cDNA 的克隆和转染使微注射变得不必要,从而大大简化了钙记录。基因表达的 apo-水母素不含水母萤,因此不发射光。通过将标本浸泡在水母萤中将其重建为水母素。通过将信号转运序列整合到多肽链中,apo-水母素可以靶向特定的细胞器。
水母素灵敏度高且具有特异性,尽管单个细胞中含有低浓度,但会产生微弱的化学发光。强度与细胞体积成正比,因此与直径的立方成正比。小细胞存在问题,因为水母素的量很少。在直径为 10 μm 的细胞中,静息钙浓度导致每小时发射不到一个光子 - 因此必须使用荧光。但是,可以使用光子计数相机通过化学发光对升高的钙浓度或大量细胞进行成像。天然水母素可以准确测量 Ca2+ 浓度,范围为 0.5 到 10 μmol dm−3,适用于瞬时变化,但对于更高的浓度,已经构建了一种突变体形式,通过提高其解离常数并降低其对钙的亲和力,将工作范围扩展到 100 到 1000 μmol dm−3。它比钙特异性荧光探针具有优势,因为它可以长时间进行实时测量;这是可能的,因为由于水母素浓度低 (约 5 nmol dm−3),不会干扰细胞内环境 (包括 Ca2+ 缓冲能力),但它的分辨率较差,并且会因高钙浓度而迅速消耗。然而,水母素化学发光具有出色的信噪比和极低的背景噪声。
使用水母素进行化学发光钙成像是探索性研究的首选方法,因为它非常灵敏,可以检测到广泛的钙浓度。化学发光反应相对于钙浓度的动力学阶数为 2.1 或更高,这提供了固有的对比度增强。与荧光不同,它不需要分析师进行预先预测或假设,从而排除了预期范围之外的钙信号。但它无法与荧光方法的高空间分辨率相媲美。此外,化学发光显微镜使用较大的景深,尚未实现光学切片。
在Aequorea victoria中,化学发光钙结合蛋白 (水母素) 与 GFP 相关。已经构建了钙敏感的生物发光报告基因,这些基因融合了 GFP 和水母素,以提高钙诱导的生物发光的量子产率。[15] GFP 与游离水母素的共表达不会产生相同的效果。通过在 GFP 和水母素之间包含不同长度的肽间隔子来改变构建体;在所有情况下,都发射了更多光,并且构建体在细胞质中更加稳定,并且对钙的敏感性高于单独的重组 apo-水母素。
共振 (非辐射) 能量从水母萤的激发氧化产物传递到 GFP 发色团取决于它们的相对位置。因此,肽间隔子是灵活的,并且长度可变。在将报告基因引入细胞 (转染) 后 48 小时测量不同构建体发射的光的绿色:蓝色比率 (500 nm:450 nm)。通过 GFP 与水母素的共价连接,绿色:蓝色比率增加,当添加连接子时,绿色:蓝色比率进一步增加;随着连接子变长,最大发射波长增加,光谱带宽减小。由于连接子使更合乎需要的构型成为可能,因此分子内能量转移的效率得到了提高,达到与体内共振能量转移相当的水平。
使用 GFP-水母素融合体,可以在单个细胞中检测到生理钙信号。对细胞进行转染,然后用水母萤重建水母素。结果是钙诱导的光子发射,可以使用冷却的 ICCD 相机检测,积分时间仅为一秒。以前,细胞质水母素仅通过使用光电倍增管检测 Ca2+ 活性,光电倍增管更灵敏,但缺乏任何空间分辨率,或者通过使用靶向荧光探针,这些探针反应更快。在使用转基因中,水母素报告 Ca2+ 活性,而 GFP 增强生物发光,这可能导致对完整动物中整合的神经回路以及特定亚细胞区室中的钙振荡进行实时成像。水母素和 GFP 增强探针以及合成荧光染料可以靶向内质网 (ER);[16] 内质网是细胞质中的一种膜网络,参与细胞物质的合成、修饰和转运;这使内质网的作用得以澄清。
如果样品的酶活性得以保留,并且样品处于底物可以进入活性位点的状态,则可以通过化学发光成像定位酶活性。通过将化学发光底物直接应用于酶,可以获得最佳的空间分辨率,例如,可以通过二氧杂环丁烷磷酸酯检测碱性磷酸酶。与化学发光耦合的酶反应可用于代谢物定位,但分辨率较低。可以在冲击冷冻的组织活检中以飞摩尔级和微米级分辨率确定代谢物。在组织中尽快冷冻,以停止酶活性并固定代谢物。然后将标本放置在温度可控的显微镜载物台上,并添加化学发光试剂。发射强度在温度升高到足以记录的水平后立即记录,并转换为代谢物浓度。
测量[17] 快速冷冻组织中代谢物(如 ATP、葡萄糖和乳酸)的空间分布是基于酶促反应,将代谢物与萤光素酶连接,随后产生光发射。使用阵列,冰冻切片以可重复的方式与酶接触,诱导切片中发出与代谢物浓度成正比的光,具有高空间分辨率。ATP 的分布与细胞活力之间存在密切相关性;肿瘤和正常组织之间也存在分布差异。使用基于萤光素酶的化学发光成像,已在动脉壁冰冻切片中以显微水平和高空间分辨率确定了 ATP、葡萄糖、糖原和乳酸。[18] 这是一种测量能量代谢物的强大工具。它已被用于量化动脉环中局部代谢物浓度。在缺氧体外条件下,能量代谢物的分布是不均匀的。氧气和营养物质的扩散距离可能很长,并且可能使血管容易在能量代谢中形成局部缺陷,这可能导致动脉粥样硬化。
e(ii). 萤光素酶在活细胞和生物体中的表达
[edit | edit source]萤光素酶是在氧气和萤光素(添加链接)存在下发出光的酶。它们已被用于基因表达的实时低光成像;编码序列已通过萤光素酶标记的基因探针检测到。[19] 这些标签包括细菌 lux 和真核萤光素酶 luc 和 ruc 基因。不同的萤光素酶在发射信号的稳定性/可变性方面有所不同。在许多启动子搜索和靶向基因表达实验中,萤光素酶一直充当报告基因。例如,萤光素酶的光子计数 CCD 成像已被用于显示单个胰岛β细胞的启动子活性以及人类免疫缺陷病毒 (HIV) 和巨细胞病毒的调节。萤光素酶成像也被用于体内追踪细菌和病毒感染,以及可视化动物模型中肿瘤细胞的增殖。受感染的细胞在百万分之一的细胞发生率下很容易检测到。单个细菌细胞,无论是转化的还是自然发光的,也已被成像,并且由于代谢活性的波动,随着时间的推移,表达的变化已被证明。低光 CCD 成像本身是一种非侵入性技术,可用于观察(见小节 b(iv)。凝胶和膜的记录 添加链接)细胞内基因表达和小型测定,如原位杂交 (ISH) 以及免疫测定、凝胶和印迹 [添加链接]、DNA 探针和体内成像(见第 D6h 节,添加链接)。对于长曝光的高分辨率成像,慢扫描液氮冷却 CCD 相机更可取,但对于较短的曝光时间,光子计数 CCD 相机更好。ICCD 相机可以检测到大于 1 Hz 的频率闪烁。
e(iii). 生物发光成像的其他应用
[edit | edit source]生物发光成像已应用于实验生物医学研究,例如坏死的发生,以及生物学的其他领域。[20] 它也特别用于临床肿瘤学中的肿瘤活检。与免疫组织化学、放射自显影或原位杂交相结合,它可能特别强大。已证明对于鳞状细胞癌,原发病灶中乳酸的积累与高转移风险相关。通过这种方式,代谢图谱表明恶性程度和肿瘤的预后;它促进了许多基础研究。
e(iv). 确定代谢物的其他方法
[edit | edit source]存在许多其他确定活细胞和组织中代谢物的示例,包括代谢物产生的实时成像。使用与胆碱氧化酶和辣根过氧化物酶偶联的反应,已在大鼠冠状脑切片中检测到内源性乙酰胆碱酯酶 (ACE) 活性。[21] 试剂经过优化,最大限度地减少了发射物质的扩散,从而实现了清晰的定位和非常低的背景。这种成像测定比体外系统更具预测性;并且可以用于确定 ACE 分布的病理生理变化或体内 ACE 抑制剂的作用,这对于筛选候选药物可能有用。
通过与鲁米诺和过氧化氢反应释放来自细胞培养物和活组织的一氧化氮 (NO) 已被可视化,以产生光子,这些光子使用与光子计数相机耦合的显微镜计数,从而对释放时间过程和扩散曲线有了新的认识。[22] 该方法允许积分时间为分钟级,以提高信噪比。然而,这种方法的高灵敏度也使其能够在几秒钟内生成图像,从而允许生成实时动态图像。这种方法已经证明了对 NO 形成进行实时成像的潜力,具有高时间和空间分辨率。由于 NO 的半衰期短,以前对这种现象知之甚少。
D6f. 原位杂交 (ISH) 和免疫组织化学 (IHC)
[edit | edit source]ISH 和 IHC 是一种将分析物定位在各种合适的样本中的技术,例如细胞涂片,或冷冻或石蜡包埋切片。化学发光检测不需要任何特殊的样本制备,但为了可重复性,需要从 3 到 5 μm 的精确控制的切片厚度。与比色法或荧光法相比,加入化学发光检测 (CL-IHC 和 CL-ISH) 可提高灵敏度。这将可靠且准确的空间分布的定量评估添加到探针的特异性中。化学发光检测酶标记的“理论”检测限为 10−21 到 10−18 摩尔;作为 ISH 的检测器,化学发光几乎与35S 放射自显影一样灵敏,为放射性物质的使用提供了一种无毒的替代方法。[23]
可以通过与互补核酸探针杂交来实现细胞内核酸序列(例如,染色体中基因的位置)的定位。两种类型的原位杂交分别涉及核 DNA 和细胞 RNA;它们在概念上相似,但在实践细节上有所不同。该技术通常在为光学显微镜制备的样本上进行。据称,评估化学发光图像几乎不需要显微镜培训。

图 D6.1 – 执行原位杂交操作的流程图。(所有孵育均在室温下进行)。
f(i). 人乳头瘤病毒 (HPV) 的 CL-ISH 测定
[edit | edit source]ISH 涉及核酸探针与样本中内源性或外源性 (病毒/细菌) DNA 或 RNA 的杂交。该过程总结在图 D6.1 中。通过间接标记提高灵敏度,其中标记物与生物特异性化学发光试剂结合,例如,生物素与链霉亲和素结合;荧光素或地高辛与其各自的抗体结合,化学发光试剂具有共价结合的信号基团(通常是 AP 或 HRP)。HPV 的 ISH 可以使用地高辛标记的基因探针,然后使用 HRP 标记的抗地高辛抗体和化学发光试剂进行成像。[24] 为了定位病毒,化学发光图像(其强度由伪彩色表示)叠加到透射光图像上。ISH 也已使用生物素标记的 HPV 互补 DNA 探针,并通过 HRP 标记的二抗检测,对三株人类癌细胞系和 40 例人类宫颈癌前病变和癌前病变活检标本进行检测;化学发光由 ICCD 相机检测。[15] 在仅 10 分钟的光子积累后,在细胞系涂片以及连续组织切片上,化学发光与 35S 放射自显影法获得的结果相当。
CL-ISH 是定量的,因为化学发光是与标记物的酶活性成正比的,并且与每个细胞的基因拷贝数成正比。在对巨细胞病毒的单独研究中,化学发光与感染细胞的数量成正比(在病毒复制后)。
f(ii). 巨细胞病毒的 CL-ISH
[edit | edit source]早期的巨细胞病毒 DNA 在感染的人类成纤维细胞中的 ISH 检测[13] 使用了二氧杂环丁烷标记的探针和 AP 标记的抗二氧杂环丁烷抗体。使用低光成像发光计,使用 1,2-二氧杂环丁烷检测到 400 amol 的 AP。化学发光强烈而稳定,使单细胞内定量成为可能,空间分辨率为 1 μm,背景非常低。已开发出多重 CL-ISH 检测方法,其中具有不同酶标记的探针检测不同的靶标。此类技术的一个例子是使用以下方案定位同一标本中单纯疱疹病毒和巨细胞病毒的 DNA。将更快的 HRP/鲁米诺添加到标本中,并对化学发光进行成像,对标本进行短暂洗涤,然后添加 AP/二氧杂环丁烷,并记录第二个化学发光图像。如果先添加 AP,则需要更长时间的洗涤。
f(iii). 单个感染细胞中细小病毒 B19 核酸的 CL-ISH
[edit | edit source]人类细小病毒 B19 是多种疾病的病原体。CL-ISH 具有高分辨率,可提供病毒核酸在感染后不同时间单细胞培养物中的精确定位和定量检测,从而对感染过程进行客观评估,其灵敏度高于由观察者小组评估的比色 ISH 检测。CL-ISH 提高的灵敏度可检测到每个样本中更多的阳性细胞,从而可以更早地诊断。
已开发出一种肽核酸 (PNA),它具有比其他 DNA 探针更高的特异性和更快、更强的结合能力。该检测基于使用生物素标记的 PNA 探针,该探针通过链霉亲和素连接的碱性磷酸酶 (AP) 检测,使用众所周知的生物素-链霉亲和素亲和力
PNA–生物素 + 链霉亲和素–AP → PNA–生物素–链霉亲和素–AP
金刚烷基 1,2-二氧杂环丁烷磷酸盐 + AP → 激发片段产物 → 光
产生的化学发光信号使用连接到具有高透射光学元件的落射荧光显微镜的超灵敏氮冷 CCD 相机进行定量和成像,并对化学发光的采集进行了修改。使用模拟感染细胞作为阴性对照,建立了阈值信号(代表探针的非特异性结合和内源性碱性磷酸酶活性)。在 B19 病毒感染周期后,可以准确地监测感染细胞的百分比,该百分比在感染后 24 小时达到峰值。化学发光检测的优点(高检测能力和宽线性范围)允许对感染的单个细胞中病毒核酸进行定量分析,显示出感染后随着时间的推移而持续增加。此类研究可能是评估和诊断病毒感染以及测量感染细胞病毒载量的有力工具。[25]
f(iv). 具有化学发光检测 (CL-IHC) 的 IHC
[edit | edit source]IHC 涉及使用抗体,这些抗体与内源性、病毒或细菌抗原(通常是蛋白质)结合,随后通过酶偶联抗体检测。CL-IHC 通过 HRP 标记的抗体和鲁米诺/H2O2 检测甲状腺组织中的上皮,具有足够的解析度和比比色法或荧光法更高的灵敏度。CL-IHC 还可以有利地应用于幽门螺杆菌感染的胃活检标本中白介素 8 (IL-8) 的定位,幽门螺杆菌是一种与胃溃疡相关的生物体。它显示出比其他检测系统更高的灵敏度,可以显示粘膜中 IL-8 浓度的变化以及上皮细胞中高浓度区域。

图 D6.2 - 免疫组织化学操作流程图。(所有孵育都在室温下进行)。
f(v). 宫颈癌中的 HPV 和 p16(INK4A) 标记
[edit | edit source]宫颈癌(宫颈上皮内瘤变,CIN)分为低度(CIN1)或高度(CIN2 或 CIN3)以便预测早期病变进展的风险,并为手术干预做出决定。基于组织学判断的不精确在于,不同的观察者对同一个活检标本分配不同的级别。克服这一难题的一种方法是根据分析化学重新定义诊断标准。
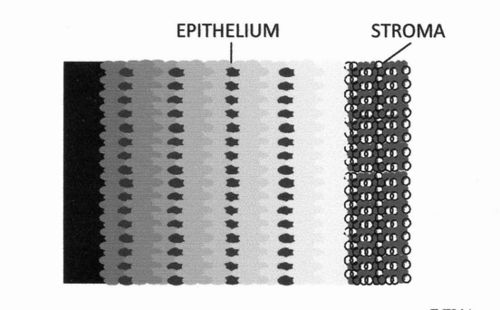
图 D6.3 - 宫颈癌活检组织切片中 p16INK4A 定位的示意图。颜色越浅,化学发光发射越强。(实际的化学发光图像显示在参考文献 27 中的图 1 中,该图是该图的依据)。
已使用具有化学发光检测 (CL-IHC) 的免疫组织化学检测方法(见图 D6.2)定量评估 p16INK4A 蛋白的过表达及其在宫颈癌和非癌性宫颈病变样本上皮中的定位。图 D6.3 显示化学发光(以及 p16INK4A 蛋白含量)通常从左到右增加。高度病变在上皮中通常发出比低度病变更强烈的化学发光信号,并且显示出 p16INK4A 蛋白不同的分布。根据化学发光信号的强度和参与 p16INK4A 过表达的上皮百分比,获得了表达评分,该评分很好地区分了不同的病变。确定了区分低度和高度的临界值。不同 CIN 等级的平均评分之间的差异具有统计学意义。[26]

图 D6.4 - 宫颈活检组织切片中 p16INK4A 和 HPV DNA 共定位的示意图。(A)透射光显微照片图像,(B)CL-IHC 图像,颜色越浅,p16INK4A 越多,(C)CL-ISH 图像,颜色越浅,HPV DNA 越多,(D)CL-ISH 图像用蓝色、黄色和红色伪彩色表示化学发光强度的增加。(B)、(C)和(D)显示叠加在透射光图像上的图像,以显示信号的定位。(实际的化学发光图像显示在参考文献 27 中的图 3 和 4 中,该图是该图的依据)。
通过 CL-IHC 确定 p16INK4A 过表达使用 AP 作为酶标记,然后在缓冲液中洗涤后,使用 HRP 作为标记来确定 HPV DNA 通过 CL-ISH[24](见图 D6.1 和部分 f(i) 添加链接)以避免两种检测方法之间的干扰。[27] 为了避免连续组织切片的非等效性,两种检测方法在同一个样本上进行。由于 ISH 中的高温步骤会使通过 IHC 测定的 p16 蛋白变性,因此这两种检测方法不能以相反的顺序进行。化学发光的高检测能力可以更好地区分病变为非癌性、CIN1 或高度 CIN。这可能成为一种客观而准确的诊断检测方法。
f(vi). 恶性黑色素瘤中的黏膜人乳头瘤病毒
[edit | edit source]高风险 (HR) 人乳头瘤病毒 (HPV) 与癌症密切相关。它已在原发性黑色素瘤和色素性皮肤斑点 (胎记、痣) 中发现,但在正常皮肤中很少报道,正常皮肤通常感染其他相对无害的 HPV 毒株。皮肤癌中的 HPV DNA 已通过聚合酶链反应 (PCR) 检测到。为了理解 HPV 与原发性黑色素瘤之间的关系,有必要了解 HPV 是否局限于癌细胞而不是肿瘤活检中存在的正常皮肤细胞,多少比例的细胞携带病毒,或者是否可能是病毒从健康皮肤污染肿瘤表面造成的。由于 PCR 方法仅测量总 DNA,因此不适合确定这一点。

图 D6.5 - 对经过 HPV DNA 的 FL-ISH 和肿瘤标记物 HMB-45 的 CL-IHC 联合处理的组织切片的示意图。大的彩色点代表细胞。红色假彩色分配给化学发光信号,黄色分配给荧光信号,不同的信号强度由不同的色调表示。HPV 和 HMB-45 的共定位由组合的假彩色橙色表示。
为了定位 HR-HPV,已经开发出一种快速、特异且非常敏感的方法,该方法将酶增强型荧光原位杂交 (FL-ISH,见图 D6.1 添加链接) 用于检测 HPV 核酸 (16 型和 18 型,这两种类型最有可能导致癌症) 与化学发光免疫组织化学 (CL-IHC,见图 D6.2 添加链接) 方法相结合,用于在肿瘤黑色素细胞标记物 HMB-45 的同一部分中顺序检测。有必要使用相同的切片,因为黑色素瘤细胞在标本中分布不均匀。HMB-45 测定是黑色素瘤细胞分化的指标,在诊断病理学中被广泛使用。FL-ISH 和 CL-IHC 的数字图像分别记录,分配不同的假彩色 (见图 D6.5),并使用特定软件进行图像分析合并。结果表明,HPV 核酸和黑色素瘤标记物在同一活检切片中的共定位非常明显 (约占标本总发光面积的 70%)。在较小的区域,检测到没有 HMB-45 的 HPV (占总量的 9.5%) 或没有 HPV 的 HMB-45 (占总量的 20.5%)。这表明病毒核酸特异性存在于黑色素瘤细胞中,并支持 HPV 在恶性黑色素瘤中可能发挥着积极作用。[28]
D6g. 荧光报告器的化学发光成像
[edit | edit source]荧光检测对于原位杂交和免疫组织化学仍然具有重要价值,特别是因为与化学发光相比,它具有更高的空间定位精度。然而,化学发光可以被用作一种激发荧光探针和标记的替代方法,而不是光激发。本节将考虑该原理的两个示例。
g(i). 过氧草酸酯化学发光
[edit | edit source]使用基于成像芯片的设备,已报道了对水性环境中草酰胺 I 水性过氧草酸酯化学发光 (POCL) 的检测[29],用于荧光标记的分析物,并且已被证明至少与使用直接荧光检测一样灵敏,直接荧光检测需要光源进行激发。使用 CCD 相机记录从 1000 倍范围内的分析物浓度发出的化学发光强度,研究了硝酸纤维素膜上荧光标记免疫球蛋白的 POCL 检测灵敏度。金黄色葡萄球菌肠毒素 B (SEB) 及其抗体的 POCL 也用于使用 CCD 相机演示免疫和亲和检测。SEB 通过免疫夹心分析法检测,其中 SEB 被固定在硝酸纤维素膜上的绵羊多克隆抗体捕获,随后被捕获的小鼠单克隆抗体捕获,随后通过荧光标记的抗小鼠抗体检测。生物素标记的抗 SEB 抗体的亲和检测使用荧光标记的链霉亲和素。
使用与 CMOS 彩色成像芯片接触成像 (添加链接),已经证明了使用两种不同荧光标记标记的牛血清白蛋白的 POCL 的同时检测。将蛋白质点在固定到盖玻片上的膜盘上,该盖玻片放置在芯片的传感表面上。它们在 8 秒曝光后分别以红色和绿色斑点可见;混合的标记样本发出黄色光。该程序可能适用于读取微阵列。
g(ii). 生物发光共振能量转移 (BRET)
[edit | edit source]一种自发光的荧光报告器,包括与 AP 结合的染料,已“原则上”证明了使用 CCD 相机或 CMOS 彩色芯片进行成像检测,从而有可能对荧光信号进行成像,而无需外部光源或复杂的 光学器件。[30] 它基于生物发光共振能量转移 (BRET),一个例子是使用 GFP 来增强来自光蛋白水母蛋白的发光 (见部分 d(iii) 添加链接)。BRET 的效率通过最小化生物发光能量供体和荧光受体之间的距离来提高,并且还发现它取决于共轭物中 AP 与荧光团的比率、所使用的荧光染料以及化学发光底物。化学发光检测成本低廉,适用于低浓度和便携式,但发光产物的扩散导致空间分辨率差。BRET 是解决此问题的潜在解决方案,但尚未应用于实际分析问题。
在演示中,固定在 CMOS 表面上的抗体捕获了一个生物素标记的目标分子,然后该目标分子与链霉亲和素标记的 AP-染料共轭物结合。AP 用于产生光,捕获的阵列图像显示在计算机监视器上。还通过使用 CCD 相机获得了图像。AP 的化学发光底物在 450 nm 处发射;来自此发射的能量被转移到荧光染料。这导致了在目标分子位置的第二个波长更长的光发射 (580 nm),避免了化学发光产物扩散的问题。通过这种方式,与传统的化学发光检测相比,图像空间分辨率得到了极大提高。被染料吸收的更短波长的第一个发射被高通滤波器去除。
D6h. 全器官和全生物体成像
[edit | edit source]使用远离光发射位置的相机可以对发生在器官和生物体内部的事件进行成像。该技术可应用于研究广泛的现象,例如肿瘤生长、转移和药物疗效,通过注射和成像重组发光肿瘤细胞进行评估[31],它可用作肿瘤位置的探针。分子成像技术的另一个应用是表达萤火虫荧光素酶 (Fluc) 报告基因的移植胚胎心肌成纤维细胞的非侵入性监测。[32] 还对发光大肠杆菌 (表达荧光素酶和底物合成所需酶) 在大鼠肠道中的运动进行了成像。[33]

图 D6.6 - 转基因烟草叶片中发光素酶表达的示意图,在黑色背景下成像。光发射由白色或灰色区域表示。(该图基于参考文献 34 图 1 中再现的图像)
用于标记细胞、病原体和基因的荧光素酶是可被外部检测到的内部指示剂。已经生产出转基因生物,其中Renilla reniformis 荧光素酶基因在烟草 (Nicotiana tabaca)、番茄 (Lycopersicon exculentum) 和马铃薯 (solanum tuberosum) 中稳定发挥作用。在将叶片、切片和幼苗 (见图 D6.6) 浸入 3 μmol dm−3 2-苄基荧光素溶液中仅仅几秒钟后,使用低光视频相机对强光发射进行成像;在该浓度下,底物无毒,没有发现其他异常。[34]
荧光素酶成像能够对复杂的基因激活效应进行建模和观察,并在活体动物中观察。[19] 用于特定生物过程的发光报告器在细胞生物学中已被广泛使用;在整个动物模型中,包括发光的转基因动物作为疾病模型,它们在药物发现和开发中非常有用。完整器官的体内成像也有助于加深对生物过程的理解。将该技术应用于感染性疾病的活体动物模型,为疾病过程、治疗效果和病原体可能逃避宿主防御的新机制提供了见解。[35] 感染的进展和治疗效果通过发光标记物进行评估,例如发光病原体。快速、便捷的高通量筛选体内对药代动力学、毒理学和靶标验证有效。时空模式的研究有助于表征药物的作用部位和时间。在基因治疗和评估基因疫苗的递送和有效性方面也可能存在临床应用。
使用体内成像有几个优点。在连续监测中,每只动物都作为自己的对照,与在不同时间分析的一组动物进行比较相比,引入的变异性更小;此外,实验中使用的动物更少。使用两种或多种报告器在同一动物中,多重体内检测也是可能的。化学发光成像通过生物发光与培养细胞计数 (例如,大肠杆菌) 的相关性得到验证。这类研究增加了数据量,并可以指导随后生化或组织学分析的组织取样。
也有一些缺点。红外线和红外线 (590-800 nm) 光穿透组织良好,但蓝绿光 (400-590 nm) 通常是生物发光发射的主要部分,衰减很强。然而,荧光素酶是最常用的报告基因,并且具有广泛的发射,包括红光。空间分辨率 (3-5 mm) 比磁共振成像或计算机断层扫描更差。
一些病理过程会自发地产生光。这是由于与氧化现象相关的弱自发光子发射,例如从活体动物中去除的整个器官中的氧自由基 (OFR) 形成(添加链接)。OFR 已在经历过缺血(血液供应阻塞)和再灌注(血液供应恢复)的大鼠肝脏中成像,显示了超氧阴离子在肝脏表面的空间和时间分布,以及抗氧化剂对它们的影响,抗氧化剂可以去除 OFR 并可以通过此模型进行筛选。衰老、乙醇消耗和脂肪沉积对肝脏 OFR 形成的作用也已评估。该系统可用于监测器官移植的保存情况,并测试保存器官的药物和程序。
- ↑ a b Roda A, Guardigli M, Pasini P, Mirasoli M, Michelini E, Musiani M, 生物和化学发光成像在分析化学中的应用,Anal. Chim. Acta,2005 年,541,25-36。
- ↑ Roda A, Pasini P, Baraldini M, Musiani M, Gentilomi G, Robert C, 使用光学显微镜-摄像机发光仪对酶标记探针进行化学发光成像,Anal. Biochem. 1998,257(1),53-62。
- ↑ a b Vykoukal D M, Stone G P, Gascoyne P R C, Alt E U 和 Vykoukal J, 使用低成本图像传感器阵列对集成微系统进行生物测定定量检测,Angew. Chem. Int. Ed.,2009 年,48,7649-7654。
- ↑ Creton R, Kreiling J A, Jaffe L F, 钙的化学发光成像,显微镜研究与技术,1999 年,46(6),390-397。
- ↑ S. Morel 和 L. Koechlin, DELTA 光子计数相机概念,Astron. Astrophys. Suppl. Ser.,1998 年,130,395-401。
- ↑ Roda A, Mirasoli M, Venturoli S, Cricca M, Bonvicini F, Baraldini M, Pasini P, Zerbini M, Musiani M, 用于同时多分析物检测的微量滴定板格式,以及用于分型人乳头瘤病毒 DNA 的 PCR-化学发光酶免疫测定法,Clin. Chem.,2002 年,48(10),1654-1660。
- ↑ Sun Z H, Fu X L, Zang L, Yang X L, Liu F Z, Hu G X, 用于平行分析多种肿瘤标志物的蛋白质芯片系统及其在癌症检测中的应用,抗癌研究,2004 年,24(2C),1159-1165。
- ↑ Feissner R, Xiang Y B, Kranz R G, 基于化学发光的检测 C 型细胞色素亚皮摩尔水平的方法,Anal. Biochem.,2003 年,315(1),90-94。
- ↑ Huang G M, Ouyang J, Delanghe J R, Baeyens W R G, Dai Z X, 聚丙烯酰胺凝胶电泳后触珠蛋白表型的化学发光图像检测,Anal. Chem.,2004 年,76(11),2997-3004。
- ↑ Wang L, Zhang Z J, Huang L G, 基于化学发光成像的分子印迹聚合物用于丹磺酰苯丙氨酸的手性识别,Anal. Bioanal. Chem.,2008 年,390(5),1431-1436。
- ↑ Holthoff E L 和 Bright F V, 化学传感中的分子模板材料,Anal. Chim. Acta,2007 年,594,147-61。
- ↑ Wang L, Zhang Z J, 基于分子印迹聚合物作为识别材料的化学发光成像测定二嘧达莫,Sensors and Actuators B-Chemical,2008 年,133(1),40-45。
- ↑ a b Roda A, Pasini P, Musiani M, Girotti S, Baraldini M, Carrea G, Suozzi A, 使用基于摄像机的发光仪对宏观和微观样品上生物特异性反应进行化学发光低光成像,Anal. Chem.,1996 年,68(7),1073-1080。
- ↑ Creton R, Jaffe L F, 化学发光显微镜作为生物医学研究工具,Biotechniques,2001 年,31(5),1098。
- ↑ a b Baubet V, Le Mouellit H, Campbell A K, Lucas-Meunier E, Fossier P, 嵌合绿色荧光蛋白-水母素作为单细胞水平的生物发光 Ca2+ 报告基因,Proc. Natl. Acad. Sci.,2000 年,97(13),7260-7265。
- ↑ Solovyova N, Verkhratsky A, 神经元内质网中游离钙的监测:现代方法概述,J. Neurosci. Meth.,2002 年,122(1),1-12。
- ↑ Mueller-Klieser W, Walenta S, 使用定量生物发光和单光子成像对生物组织中代谢物进行地理定位,Histochem. J.,1993 年,25(6),407-420。
- ↑ Levin M, Leppanen O, Evaldsson M, Wiklund O, Bondjers G, Bjornheden T , 绘制动脉壁内 ATP、葡萄糖、糖原和乳酸浓度,动脉粥样硬化、血栓形成和血管生物学,2003 年,23(10),1801-1807。
- ↑ a b Greer LF, Szalay AA, 萤光素酶在活细胞和生物体中的表达,发光,2002 年,17(1),43-74。
- ↑ Walenta S, Schroeder T, Mueller-Klieser W, 使用生物发光进行代谢定位:基础和临床相关性,生物分子工程,2002 年,18(6),249-262。
- ↑ Pasini P, Musiani M, Ruso P, Valenti P, Aicardi G, Crabtree J E, Baraldini M, Roda A, 生物分析中的化学发光成像,J. Pharm. Biomed. Anal.,1998 年,18,555。
- ↑ Wiklund N P, Iversen H H, Leone A M, Cellek S, Brundin L, Gustafsson L E, Moncada S, 细胞培养和活组织中一氧化氮形成的可视化,Acta Physiologica Scandinavica,1999 年,167(2),161-166。
- ↑ Lorimier P, Lamarcq L, Negoescu A, Robert C, LabatMoleur F, GrasChappuis F, Durrant I, Brambilla E, 在癌细胞系和人类宫颈上皮内瘤变中,比较 S-35 和化学发光用于 HPV 原位杂交,组织化学与细胞化学杂志,1996 年,44(7),665-671。
- ↑ a b 参见参考文献 1 中的图 3 和 4。
- ↑ Bonvicini F, Mirasoli M , Gallinella G, Zerbini M, Musiani M, Roda A, 用于定量化学发光原位杂交成像细胞细小病毒 B19 复制动力学的基于 PNA 的探针,分析师,2007 年,132(6),519-523。
- ↑ Venturoli S, Ambretti S, Mirasoli M, Santini D, Zerbini M, Roda A, Musiani M , 化学发光定量免疫组化 p16INK4A 定位作为宫颈上皮内瘤变的标志物,国际妇科病理学杂志,2008 年,27(4),575-581。
- ↑ Mirasoli M, Guardigli M, Simoni P, Venturoli S, Ambretti S, Musiani M, Roda A, p16INK4A 和 HPV DNA 的多重化学发光显微镜成像作为宫颈肿瘤的生物标志物,Anal. Bioanal. Chem.,2009 年,394,981-987。
- ↑ Ambretti S, Venturoli S, Mirasoli M, La Placa M, Bonvicini F, Cricca M, Zerbini M, Roda A, Musiani M, 使用荧光原位杂交和化学发光免疫组化相结合的方法评估恶性黑色素瘤中粘膜人乳头瘤病毒的存在,英国皮肤病学杂志,2007 年,156(1),38-44。
- ↑ Filanoski B, Rastogi SK, Cameron A, Cameron E, Mishra NN, Maki W, Maki G, 使用 CCD 相机和 CMOS 设备进行非酶促水性过氧草酸酯化学发光免疫检测,发光,2008 年,23(5),296-302。
- ↑ Filanoski B, Rastogi SK, Cameron E, Mishra NN, Maki W, Maki G, 用于生物分子检测的新型均相生物发光共振能量转移元件,使用 CCD 相机或 CMOS 设备,发光,2008 年,23(1),22-27。
- ↑ Soling A, Rainov NG, 体内生物发光成像 - 应用于癌症研究,Expert Opin. Biol. Ther.,2003 年,3,1163。
- ↑ Wu J C, Chen I Y, Sundaresan G, Min J J, De A, Qiao J H, Fishbein M C, Gambhir S S, 使用光学生物发光和正电子发射断层扫描对活体动物中的心脏细胞移植进行分子成像,循环,2003 年,108,1302。
- ↑ 参见参考文献 1 中的图 5。
- ↑ Mayerhofer R, Wang G, Hua D, Escher A, Illes K, Langridge W H R, Szalay A A, 可视化不同萤光素酶对转基因生物发出的光,在 Campbell A K, Kricka L J, Stanley P E(编辑)中,生物发光和化学发光:基础和应用方面。第八届生物发光和化学发光国际研讨会论文集 1994 [奇切斯特,威利。1995 年],607-612。
- ↑ Doyle TC, Burns SM, Contag CH, 体内生物发光成像,用于感染的综合研究,细胞微生物学,2004 年,6(4),303-317。
