生物化学/酶
酶是大分子,在大多数生物体的生化反应中充当有机催化剂,其功能对维持和维持生命活动至关重要。必须注意,活生物体中发生的某些化学转化的反应速率极低,因此需要催化才能维持细胞发育和分裂的合理时间。大多数功能性酶是蛋白质,如胰蛋白酶、延胡索酸酶或木瓜蛋白酶。一小部分酶由 RNA 组成,被称为核酶,例如锤头核酶,负责在 RNA 分子的特定位点进行切割和连接,或原核生物 50S 核糖体亚基的 23S rRNA 的肽酰转移酶活性。酶发挥作用的一般机制是降低开始反应所需的能量,也称为活化能。产生某些酶的微生物或单独提取和纯化的酶具有极其广泛的用途:乙醇生产(酿酒酵母、运动发酵单胞菌)、法医学(限制性内切酶)和聚合酶链式反应等。酶的用途不仅仅是科学的。这些多样的分子构成了酿造和制药等行业的重要组成部分;仅在健力士啤酒酿造过程中使用酶就为爱尔兰经济带来了超过十亿欧元的价值。
模型酶是单体球状蛋白质。大多数关于酶促反应性质的研究都是针对胰蛋白酶、糜蛋白酶或淀粉酶进行的。与所有蛋白质一样,酶需要正确的折叠才能正常工作,因此容易因变性而失活。酶活性的关键是称为活性位点的结构。多肽链氨基酸残基之间的相互作用导致它们形成具有定义的大小、形状和序列的结构。活性位点和结构域的区别在于后者能够识别(识别位点)和处理定义的分子。无论分子与识别位点之间的相互作用是空间的(基于形状)、疏水的(糜蛋白酶)还是离子的(胰蛋白酶),它总是特异性和暂时的。抑制剂通常利用与活性位点的特异性共价结合,从而永久地使酶失活。
形成了关于活性位点的两个理论。锁钥理论认为活性位点和底物的大小和形状相匹配——底物是钥匙,活性位点是锁。完美匹配的分子结合会诱导酶的构象变化,从而导致催化。第二种诱导契合理论认为活性位点和底物具有不同的、不匹配的结构。当底物遇到活性位点时,它会诱导活性位点假设某种构象,无论是通过去除结构水分子,还是使氨基酸残基之间的相互作用产生应力。
酶发挥作用的机制是降低特定酶催化的反应的活化能。每种酶都完全特定于反应物;它只对一个特定的反应起作用,这是由于每种酶都有独特的活性位点。酶的活性位点具有独特的 3D 形状,以及独特的静电荷和疏水性模式。在这里,特定的底物——酶作用的物质——会暂时与酶结合,形成酶底物复合物,或 ESC。然后反应发生,反应产物与酶分离,此时产物可以被利用。然后酶能够重复该反应数千次,尽管可能需要每隔一段时间更换一次。
酶的活性细胞中酶活性的控制可以通过改变细胞的内部环境来增强或减少酶的产生。这被称为酶诱导和抑制。酶抑制剂或酶诱导剂将与酶结合,并降低或提高酶的活性。抑制剂阻止底物进入活性位点。它可以是可逆的或不可逆的。酶活性是分隔的;这意味着一种酶活性的降低会降低另一种酶的生产力,因为它们是相关的。一些酶会被体内的环境因素激活,例如人体 pH 值的降低会改变流感病毒血凝素的活性。因此,反应的潜在能量势垒越低,具有足够能量的反应物就越多,因此反应发生的速率就越快。所有催化剂,包括酶,都通过与反应物形成过渡态来发挥作用,其自由能低于未催化反应中发现的自由能。
酶图
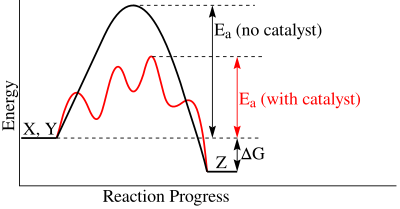
酶不会改变反应的平衡。酶只会催化或加速反应速率,通过稳定过渡态,并且不参与化学反应。过渡态是反应坐标上最高的活化能 (Ea),其中分子仅部分反应。使用催化剂(酶)时,活化能会降低。当不使用酶时,反应的活化能要高得多,这将导致反应进行的时间长得多。为了有效地促进反应,酶与过渡态互补,而不是与底物互补。催化剂存在于反应物中,也出现在最终产物中。
1. 酶对热敏感,会被过量的热量变性(或被过量的冷量失活),即它们的活性位点会永久变形,因此酶无法形成酶底物复合物。这就是你煎鸡蛋时发生的事情,蛋清(蛋白,一种蛋白质,不是酶)会被变性。2. 酶在细胞中产生,但能够在细胞外发挥作用。这使得酶能够被固定化,而不会杀死它们。3. 酶对 pH 值敏感,它们进行反应的速率取决于反应发生位置的 pH 值,例如胃中的胃蛋白酶的最适 pH 值约为 pH2。而唾液淀粉酶的最适 pH 值约为 7。4. 酶是可重复使用的,一些酶每秒能够催化数十万次反应,例如过氧化氢酶作用于过氧化氢。5. 酶只催化一个反应,例如转化酶只在葡萄糖溶液通过酶珠时产生葡萄糖和果糖(见固定化)。6. 酶的反应速率受其饱和点的限制。饱和本质上是指酶无法再加快反应速度以补偿底物浓度增加(将平衡推向产物)的点。在图形上,这表现为水平渐近线,也称为最大速度。每种酶对给定底物都有自己的最大速度。通过测量不同底物浓度下产物形成的速率,可以确定酶的最大速度的一种方法。7. 酶能够反向工作,这作为产物生成量的截止点。如果反应物过量,反应将继续进行并发生逆转,因此不会发生产物过载或积聚。酶是分解物质的催化剂,通过短暂地与物质结合。过氧化氢,它们将其分解成水和氧气的速度比自然发生的速度快得多。在体内,它们被用来分解食物并启动消化过程。它们是蛋白质,受物质的 pH 值和温度的影响。最后需要注意的是,酶的浓度显然会影响其工作效率。它们是底物特异性的,这由锁钥假说说明。
酶可以通过两种方式固定化,首先是将它们化学结合到某种刚性结构上,其次是将酶物理放置在不溶性支撑结构上,例如凝胶或珠子。第二种酶固定化方法更为常见,成本更低,但确实会降低酶催化反应的能力。
酶固定化的步骤
1. 配制 5% w/v 的海藻酸钠溶液,并静置过夜,以充分混合。
2. 将酶,或在这种情况下,细胞(例如酵母)添加到海藻酸钠溶液中,并充分混合。此时混合物会变得非常浓稠,应静置 20 分钟以消除溶液中的气泡;此类气泡会增加珠子的表面积,使其效率降低。
3. 取一支注射器,并用海藻酸钠/细胞基质填充它。
4. 配制 2% w/v 的氯化钙溶液。
5. 将注射器垂直于氯化钙溶液上方约 20 厘米处,并将海藻酸钠溶液滴入其中,尝试制作尽可能小的珠子,直径约 3-4 毫米。
6. 从氯化钙溶液中取出并丢弃任何海藻酸钠细丝或漂浮的珠子。
7. 用去离子水冲洗珠子。
8. 使用支架在彼此上方设置两个分液漏斗,将珠子放入底部漏斗,并将浓葡萄糖放入顶部。
9. 让葡萄糖流过珠子,并抽出产物。
产物是一种酒精,不应摄入,因为无法确定它是乙醇还是甲醇,后者是有毒的。
直到最近,酶的命名都是任意的,例如,唾液淀粉酶(淀粉酶),这并不能告诉我们酶作用于什么,相反,生物学家设计了一种酶命名方法,其中酶以“-ase”结尾;例如 DNA 解旋酶,它们还包含了关于酶作用于什么的线索;DNA 解旋酶的作用是分离 DNA 链中的核苷酸。其他常见的酶包括蛋白酶、脂肪酶、胃蛋白酶、淀粉酶和溶菌酶。
Berg, Jeremy M. 生物化学 第6版。纽约,W. H. Freeman and Company,2007。