化学之友/物质
要进行机械分离,物质需要手动或使用磁铁进行分离([1]p.38)。
一些混合物可以通过静置使其沉淀到容器底部来分离。这种方法通常很慢,但可以通过旋转容器来加快速度([1]p.39)。
将空气吹入化合物,使其部分起泡并浮到顶部。然后将顶部部分撇去([1]p.38)。
如果你有一个非均相混合物,其中包含混合的固体,你可以将其倒入过滤器中以将固体与液体分离([1]p.38)。

你可以在溶液中加入一种物质,这种物质可溶于溶液中的某些元素,但不能溶于所有元素([1]p.39)。
分馏是通过在不同温度下沸腾液体化合物来实现的。组成部分在不同的温度下汽化,因此可以将其分离([1]p.39)。
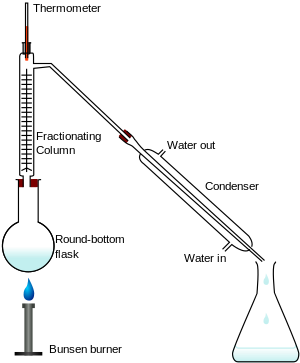
在固体溶解于液体的化合物中,冷却会形成固体元素的晶体。这在盐水或糖水中自然发生([1]p.39)。
将混合物溶解在溶剂中。溶剂通过多孔材料(如滤纸),并且化合物的元素在多孔材料中以不同的速率分离。这会产生不同元素的环或线([1]p.39)。
万物皆由元素构成。我们主要由碳、氢、氧、氮、钙和磷组成[2]。元素包含:质子、电子和中子。中子和质子停留在原子核中,而电子绕着原子核运行。
当两种或多种元素以确定的比例组合在一起时,它们被称为化合物[3]。水(H2O)和盐(NaCl)都是化合物,因为它们是由一种以上的元素组成的。
在均相混合物中,你看不到单独的成分。前缀“homo”表示相同。均相混合物通常被称为溶液,或者当颗粒稍大时被称为胶体。均相混合物中的颗粒肉眼不可见,除了某些胶体,这些胶体的颗粒在直射光下可能可见[4]。不锈钢和青铜等金属是均相混合物。
非均相混合物
[edit | edit source]非均相混合物是指不同成分可以用肉眼看到的混合物,“hetero”表示不同。悬浮液是非均相混合物,当静置时,会分离成不同的成分。混合蔬菜、海滩沙和油醋混合物都是非均相混合物的例子 [4]。
元素
[edit | edit source]元素分类
[edit | edit source]有几种方法可以写出分子的名称。元素周期表上的每种元素都有一个名称和一个符号。例如,你可以用两种方式写出氢元素。你可以直接写出名称“氢”,也可以写出它的符号“H”。符号是一个或两个(在某些情况下是三个)字母。第一个字母大写,第二个字母小写。
命名离子化合物
[edit | edit source]当元素在离子化合物中结合在一起时,有一种特殊的写法。假设有一个锌和氧的化合物。它的名称是“氧化锌”。在写名称时,我们将最后一个元素的最后一个音节改为“-ide”。当写化学式时,我们使用符号而不是完整的单词。此外,还需要指定每种化合物中锌原子和氧原子的数量。锌的电荷为2+,而氧的电荷为1-。为了形成稳定的化合物,我们需要电荷加起来为零。因此,每1个锌原子需要2个氧原子。这就是化学式:ZnO2。在用完整名称命名离子化合物时,不需要说出每个元素的数量,但是如果写符号,就需要写。
命名分子化合物
[edit | edit source]命名分子化合物与命名离子化合物非常相似。但是,在命名化合物时,需要指定每个原子的数量。例如,水的化学式是H2O。我们把它写成完整的名称“二氧化氢”。我们在氢前面加上前缀“di”,表示每个氧原子上有两个氢原子。以下是1-10的前缀列表 ([1] p.113)
- 一(你不需要写,但可以写。)
- 二
- 三
- 四
- 五
- 六
- 七
- 八
- 九
- 十
元素周期表
[edit | edit source]周期律
[edit | edit source]周期律是关于元素按其原子量排列的规律,由约翰·亚历山大·纽兰兹在1864年发现。它指出:“当元素按原子量递增的顺序排列时,化学和物理性质会形成规律,并在规律的间隔中重复出现”。([1] p.63)。
族/主族
[edit | edit source]元素周期表分为18个不同的纵列,称为“族”或“主族”。每个族元素都具有相似的特征,例如最外层轨道的电子数量或它们与其他元素反应的方式。第一族,包括钠和钫,只有一个价电子,并且都与水剧烈反应。
碱金属
[edit | edit source]碱金属是元素周期表第一族的金属元素,位于最左侧,不包括氢,氢只是为了分类目的放在这一行。这个族中的每种元素都具有1+的离子电荷,并且只有一个价电子。这意味着它们很不稳定,并且会与其他元素迅速反应。碱金属与水反应尤其剧烈。它们的原子序数越高,反应越剧烈,因为它们越不稳定。铷和钾都是碱金属。
碱土金属
[edit | edit source]碱土金属是元素周期表第二族的元素,位于左侧附近。它们具有2+的离子电荷,并且非常活泼。
过渡金属
[edit | edit source]从第三族到阶梯线的金属被称为“过渡金属”。它们具有不同的离子电荷,其中一些元素具有不止一种离子电荷,并且它们的反应活性也不同。这部分元素包含许多我们日常使用的金属,例如铁、铜和锡。
卤素
[edit | edit source]卤素是元素周期表倒数第二族的非金属元素,位于最右侧附近。由于它们具有1-的离子电荷,因此它们是高反应性元素。
惰性气体
[edit | edit source]惰性气体是元素周期表最右侧的族中的气体。它们被称为“惰性”是因为它们是唯一具有完整价层的元素,因此它们不会轻易与其他元素反应。它们是稳定存在于正常条件下的元素。当通过这些元素放电时,它们会发出不同的颜色。氦气、氖气和氩气都是惰性气体。
镧系元素
[edit | edit source]从镧开始的一系列元素被称为镧系元素。
锕系元素/超铀元素
[edit | edit source]从锕开始的一系列元素被称为锕系元素。
阶梯线
[edit | edit source]这是金属和非金属之间的分界线。它被称为阶梯线,因为它像楼梯的台阶一样。
金属
[edit | edit source]这些元素位于阶梯线右侧。
早期的希腊人只有可以识别少数元素的技术。最初识别的七种元素是金、银、铁、汞、锡、铜和铅。当时,希腊人只知道七颗行星或天体,因此他们为每种元素命名了天体并赋予了符号以表示它们。希腊人对元素的化学性质知之甚少,他们只是用它们来制造工具和艺术品。随着时间的推移,人们发现使用符号来表示所有元素是不够的,因此最终将其更改为字母。([1]p.55)。
道尔顿的理论通常被称为“台球模型”。他认为原子是中性的球体,质子和电子之间没有明显的区别。
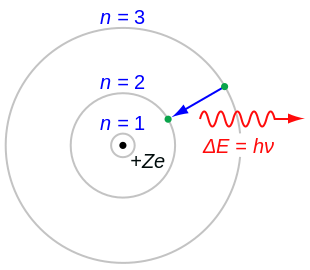 玻尔是第一个提出元素具有带正电荷的原子核和绕其运行的带负电荷的电子的化学家,电子被分成轨道组,每层具有特定数量的电子。他认为每个轨道会包含一定数量的电子,而最外层电子的数量决定了化学性质。
玻尔是第一个提出元素具有带正电荷的原子核和绕其运行的带负电荷的电子的化学家,电子被分成轨道组,每层具有特定数量的电子。他认为每个轨道会包含一定数量的电子,而最外层电子的数量决定了化学性质。
电子带负电荷。它们围绕原子核运行。每个轨道需要一定数量的电子。当没有足够的电子来填充轨道时,原子带正电荷。当发生相反的情况时,原子必须打开一个新的轨道来容纳一两个电子。这种原子带负电荷。当像钠这样的带正电荷的原子找到像氯这样的带负电荷的原子时,氯会将额外的电子给予需要一个额外电子的钠。然后它们两个形成离子化合物,即氯化钠。
原子核是原子的中心。它包含带正电荷的质子和带中性电荷的中子。原子核是原子中大部分质量的来源,因为电子的重量不足以产生显著的影响。每个质子或中子的重量为 1 个原子质量单位(AU)。通过查看摩尔质量和原子序数,可以找出元素中质子或中子的数量。原子序数是质子的数量,原子序数减去摩尔质量是中子的数量。
原子序数是元素周期表中元素的序号。它表示元素原子核周围有多少个电子,因此随着原子序数的增加,电子的数量也随之增加。例如,碳的原子序数是 12。这意味着它有 12 个电子,因此也有 12 个质子。元素根据其原子序数进行分组,因为元素中电子的数量会影响其性质。
中子是带中性电荷的亚原子粒子。它们位于原子核中,重量为 1 个原子质量单位。元素中中子的数量决定了它是否为同位素。
同位素是具有正常数量的质子和电子,但具有额外或更少的中子的元素。元素仍然带中性电荷,因为质子和电子仍然相互平衡。额外或缺失的中子会增加或减少元素的重量。同位素可以在自然界中找到,但它们通常不像元素的正常版本那样稳定。([1]p.76)。
质量数是原子的摩尔质量。它包含元素中质子和中子的总质量。在元素周期表中,摩尔质量很少是整数。这是因为它是元素所有常见同位素的平均质量。氢的常见同位素很少,因此它的原子序数是 1.01。
单原子离子是通过获得或失去电子来填充其价电子的元素。这使它们带正电或负电荷。它们也被称为离子。[1].
阳离子是通过失去电子来填充其价电子的元素。它们作为离子带正电荷,因为它们具有比电子更多的质子。所有碱金属都是阳离子,因为它们会失去电子而不是获得电子来填充其最外层电子层。
阴离子与阳离子相反,它们带负电荷,因为它们通过获得电子来填充其价电子层。大多数非金属元素都是阴离子,因为它们位于元素周期表的右侧,会获得电子而不是失去电子。记住它们区别的一个简单方法是想象一只快乐的猫。这将帮助你记住阳离子带正电荷。
以下是一个关于物质部分的简短测验
- ↑ a b c d e f g h i j k l m Jenkins, F., van Kessel, H., Tompkins, D., Lantz, O., (1996). Nelson Chemistry, British Columbia, Nelson Canada.
- ↑ Chem4Kids[1997-2012]http://www.chem4kids.com/files/elem_intro.html
- ↑ Chemistry and You! (n.d.) [1]
- ↑ a b Ophardt, C., Virtual Chembook,(2003), [2]
- ↑ Dayah, M. (1997) Dynamic Periodic Table, http://www.ptable.com

![浅蓝色元素是惰性气体,黄色元素是卤素,两者都是非金属元素的一部分,用绿色表示。类金属元素用棕色表示。过渡金属元素用淡紫色表示。周期表主体中粉红色的金属是过渡金属,周期表主体下方第一行的元素是镧系元素,镧系元素下面的元素是锕系元素,碱土金属是橙色,碱金属是红色[5]。](http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Periodic_table.svg/779px-Periodic_table.svg.png)