高中化学/周期表和电子构型
根据我们已经讨论过的内容,你可能会意识到,正如电子构型可以用来解释周期表的形状和组织方式一样,周期表的形状和组织方式反过来也可以用来预测电子构型。事实上,如果你可以在周期表上找到一个元素,你就可以利用元素的位置来确定元素价电子的能级。此外,元素在周期表上的位置告诉你元素最高能级价电子的亚层。在本课中,我们将仔细研究周期表与电子构型之间的关系。
- 将元素在周期表中的位置与它的价电子的能级联系起来(不包括过渡金属、镧系元素和锕系元素)。
- 将元素在周期表中的位置与它最高能级价电子的亚层联系起来。
- 解释为什么周期表的第一行只有两个元素。
首先,让我们试着找出我们可以从元素在周期表中的行或周期中了解到的信息。
下图显示了周期表中不同行的编号方式。过渡金属以及镧系元素和锕系元素已被省略。

为了理解这在元素的电子构型方面意味着什么,让我们考虑一下IA族金属。如果我们写下周期表中每一行IA族金属的电子构型,我们有
第2行 Li 第3行 Na 第4行 K 第5行 Rb 第6行 Cs 第7行 Fr
你看到规律了吗?对于IA族金属,元素的行似乎对应于该元素价电子的能级。例如,锂(Li)位于周期表上的第2行,它的价电子位于n = 2能级。铯(Cs)位于周期表上的第6行,它的价电子位于n = 6能级。让我们看看这种规律是否适用于IIA族金属
第2行 Be 第3行 Mg 第4行 Ca 第5行 Sr 第6行 Ba 第7行 Ra
对于 IIA 族金属,相同的规则适用!镁 (Mg) 位于元素周期表的第三周期,其价电子位于 n = 3 能级。类似地,镭 (Ra) 位于元素周期表的第七周期,其价电子位于 n = 7 能级。
到目前为止还不错 - 但是,相同的模式是否适用于 IIIA-VIIIA 族元素(也称为 13-18 族)?让我们通过编写每一周期中 IIIA 族元素的电子构型来找出答案。
第2行 B 第3行 Al 第4行 Ga 第5行 In 第6行 Tl
虽然 III A 族元素的价电子在 *s* 和 *p* 轨道中都有,但事实证明,元素的行数仍然对应于该元素价电子的能级。例如,镓 (Ga) 位于元素周期表的第 4 行,其价电子位于 *n* = 4 能级。同样,铊 (Tl) 位于元素周期表的第 6 行,其价电子位于 *n* = 6 能级。
看起来我们可以使用元素周期表中元素的行号来预测元素价电子的能级。不过,为了确保,让我们再试一个例子,通过写出每行 VII A 族元素的电子排布。
第2行 F 第3行 Cl 第4行 Br 第5行 I 第6行 At
再次,元素的行号可以用来确定该元素价电子的能级。例如,氯 (Cl) 位于元素周期表的第 3 行,其价电子位于 *n* = 3 能级。同样,碘 (I) 位于元素周期表的第 5 行,其价电子位于 *n* = 5 能级。
在能级及其与元素周期表的关系方面,您应该注意最后一点。我们使用元素周期表中的元素行号来确定元素价电子的能级的规则适用于 IA 族到 VIII A 族元素。但是,此规则*不*适用于 IB 族到 VIII B 族(也称为 III 族到 XII 族)元素。元素周期表中较低部分的元素(元素周期表中第一个图中“涂黑”的中间部分)被称为**过渡金属**。它们的性质有所不同,您不能像处理价电子一样对它们应用相同的规则。元素周期表中孤立的较低部分(在上面的元素周期表图中也“涂黑”了)也是如此。此块包含被称为*镧系元素*和*锕系元素*的元素。与过渡金属一样,**镧系元素和锕系元素**在价电子和价电子能级方面不遵循 IA 族到 VIII A 族元素的相同规则。
您可能注意到,在上一节中,我们根本没有提到第一行。相反,我们总是从第二行开始。元素周期表中的第一行是“特殊行”,原因有很多。首先,元素周期表的第一行只包含两个元素——氢和氦。你能弄清楚*为什么*第一行只有两个元素吗?
根据我们在上一节中学到的知识,元素的行号对应于该元素价电子的能级。因此,第一行必须包含价电子位于 *n* = 1 能级的元素。到目前为止,您应该知道 *n* = 1 能级中只有一个轨道。当然,这个轨道是 1*s* 轨道。氢在 1s 轨道中有一个价电子(其电子排布为 1*s*1),而氦在 1s 轨道中有两个价电子(其电子排布为 1*s*2)。由于 1*s* 轨道中不可能容纳*超过*两个电子,因此总共具有*三个或更多*电子的原子*必须*具有位于 *n* = 2 或更高能级的价电子。因此,很明显,总共具有*三个或更多*电子的原子*不*属于元素周期表的第一行。
元素周期表的第一行也是特殊的,因为其元素具有特殊的性质。例如,氢不像 IA 族中的其他元素那样是金属。相反,氢原子相互反应,形成称为*氢气*的 H2。正如在上一课中提到的,一些科学家会将氢归为一类,而不是将其放在 IA 族的顶部。我们在这里不做这种操作,但您应该始终牢记氢是“不同的”,并且您不应该将氢的化学性质与其他 IA 族元素的化学性质进行比较。
氦也是一种特殊的原子。你可能想知道为什么氦出现在元素周期表的最右边,而不是紧挨着氢。同样,氦在元素周期表中的位置反映了它特殊的化学性质。你之前学过 VIII A 族元素是“惰性”的,其中包括氦。即使氦只有两个价电子,而其他 VIII A 族元素有八个价电子,氦也被放置在 VIII A 族的最上面,因为氦的化学行为与其他惰性气体的化学行为相似,因为它具有完整的外部能量层。
到目前为止,我们知道,除了过渡金属、镧系元素和锕系元素之外,我们可以利用元素所在的行来确定该元素价电子的能级。元素周期表的结构和元素在周期表中的位置还能告诉我们关于元素电子构型的其他信息吗?答案是“是的”。记住,IA 族和 IIA 族元素中能量最高的价电子始终位于 *s* 轨道。事实上,IA 族和 IIA 族元素中唯一的价电子都位于 *s* 轨道!例如,锂 (Li) 的电子构型为 1*s*22*s*1。注意,锂的单个价电子位于 *s* 轨道。同样,镁 (Mg) 的电子构型为 1*s*22*s*22*p*63*s*2。同样,注意镁的两个价电子都位于 *s* 轨道。由于 IA 族和 IIA 族元素的所有价电子都存在于 *s* 轨道,因此元素周期表的前两列(IA 族和 IIA 族)被称为“*s* 亚层块”。*s* 亚层块如下图所示。注意,*s* 亚层块包括从 Li 到 Fr 的所有金属,以及从 Be 到 Ra 的所有金属。氢不包括在 *s* 亚层块中,同样,这是因为它具有特殊的性质。

对于 IIIA 族到 VIIIA 族元素,我们能说什么?特别是,我们能对能量最高的价电子说什么?如果你仔细观察,你会发现,对于 IIIA 族到 VIIIA 族(或者如果你喜欢,13 族到 18 族)元素,能量最高的价电子始终位于 *p* 轨道。例如,硼 (B) 的电子构型为 1*s*22*s*22*p*1。虽然硼既有 2*s* 也有 2*p* 价电子,但 2*p* 价电子的能量更高。同样,氪 (Kr) 的电子构型为 1*s*22*s*22*p*63*s*23*p*64*s*23*d*104*p*6。同样,虽然氪既有 4*s* 也有 4*p* 价电子,但 4*p* 价电子的能量更高。由于 IIIA 族到 VIIIA 族元素的能量最高的价电子都存在于 *p* 轨道,因此元素周期表的最后六列(IIIA 族到 VIIIA 族)被称为“*p* 亚层块”。*p* 亚层块如下图所示。此外,如以下图所示,*p* 亚层块包括从 B 到 Tl 的所有元素,从 C 到 Pb 的所有元素,从 N 到 Bi 的所有元素,从 O 到 Po 的所有元素,从 F 到 At 的所有元素,最后,从 Ne 到 Rn 的所有元素。氦不包括在 *p* 亚层块中,这应该是有道理的,因为氦没有 *p* 电子!

正如元素周期表有 *s* 亚层块和 *p* 亚层块一样,它也有*d* 亚层块和*f* 亚层块。在 *d* 和 *f* 亚层块中定义价电子可能更困难,但一般来说,*d* 亚层块中大多数高能价电子都位于 *d* 轨道,而 *f* 亚层块中大多数高能价电子都位于 *f* 轨道。
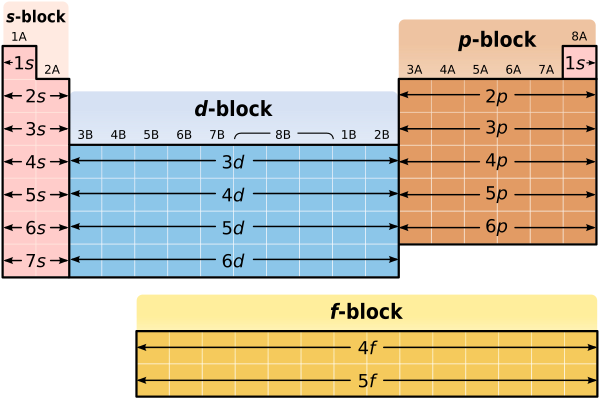
你之前学过元素周期表是总结科学家对我们世界中不同元素的所有了解的便捷方法。元素周期表可能对你来说看起来很奇怪,因为你无法理解它的形状和结构意味着什么。但是,现在我们已经讨论了电子轨道和电子能级,元素周期表就不应该再显得那么奇怪了。事实上,元素周期表的形状实际上反映了不同元素的原子中电子的组织方式。
- 对于 IA 族、IIA 族、IIIA 族、IVA 族、VA 族、VIA 族、VIIA 族和 VIIIA 族元素,元素所在的行列对应于该元素价电子的能级。例如,锂 (Li) 位于第二行,其价电子位于 *n* = 2 能级。
- 你可以使用元素在元素周期表中的行号来预测元素价电子的能级。
- 第一行的元素具有特殊的性质。
- 氢不是碱金属,通常以气体的形式存在。
- 氦是惰性气体,表现出与 VIIIA 族中其他惰性气体相似的化学性质。
- 元素周期表可以分为 *s*、*d*、*p* 和 *f* 亚层块。
- *s* 亚层块中的元素的所有价电子都位于 *s* 轨道。
- *p* 亚层块中的元素的能量最高的价电子都位于 *p* 轨道。
- 使用元素周期表确定以下每个元素的价电子的能级。
- (a) B
- (b) Ga
- (c) Rb
- (d) At
- (e) He
- 填空
- (a) B 位于元素周期表的 __ 亚层块
- (b) Sr 位于元素周期表的 __ 亚层块
- (c) Fe 位于元素周期表的 __ 亚层块
- (d) Cs 位于元素周期表的 __ 亚层块
- (e) O 位于元素周期表的 __ 亚层块
- 使用元素周期表确定以下每个元素中能量最高的电子的能级和亚层
- (a) N
- (b) Ca
- (c) Rb
- (d) P
- (e) In
- 判断以下每个说法是正确还是错误。
- (a) Li 的价电子位于 *n* = 1 能级。
- (b) Si 的价电子位于 *n* = 3 能级。
- (c) Ga 的价电子位于 *n* = 3 能级。
- (d) Xe 的价电子位于 *n* = 5 能级。
- (e) P 的价电子位于 *n* = 2 能级。
- 将元素与其所在的亚层块匹配起来
(a) C i. *s* 亚层块 (b) Cs ii. *p* 亚层块 (c) Ce iii. *d* 亚层块 (d) Cr iv. *f* 亚层块
- 元素周期表的第一行有
- (a) 1 个元素
- (b) 2 个元素
- (c) 3 个元素
- (d) 4 个元素
- (e) 5 个元素
- 使用元素周期表确定以下元素中哪个元素的能量最高的价电子。
- (a) Sr
- (b) As
- (c) H
- (d) At
- (e) Na
- 使用元素周期表确定以下元素中哪个元素的能量最低的价电子。
- (a) Ga
- (b) B
- (c) Cs
- (d) Bi
- (e) Cl
- *d* 亚层块的第一行对应哪个能级?
- *d* 亚层块
- 元素周期表中 IB 族到 VIIIB 族(也称为过渡金属)的元素。
- *f* 亚层块
- 元素周期表中镧系元素和锕系元素行的元素。
- 惰性
- 不反应的。
- 镧系元素和锕系元素
- 元素周期表中 *f* 亚层块的元素。镧系元素和锕系元素中能量最高的电子位于 *f* 轨道。
- 惰性气体
- VIIIA 族元素。这些元素位于元素周期表的第八列。它们是惰性的,这意味着它们很不活泼。
- *p* 亚层块
- 元素周期表中 IIIA 族到 VIIIA 族(不包括氦)的元素。*p* 亚层块的元素的能量最高的价电子都位于 *p* 轨道。
- *s* 亚层块
- 元素周期表中 IA 族和 IIA 族(不包括氢)的元素。*s* 亚层块的元素的所有价电子都位于 *s* 轨道。
- 过渡金属
- 元素周期表中 *d* 亚层块(第 1B 到第 8B 族)中的元素。过渡金属中能量最高的电子位于 *d* 轨道。
此材料改编自原始 CK-12 图书,可在此处找到 此处。此作品根据知识共享署名-相同方式共享 3.0 美国许可协议进行许可






















