IB 化学/原子理论
2.1 核原子
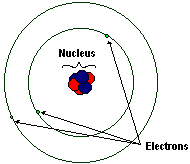
2.1.1 : 质子和中子构成原子核,电子在电子层中绕原子核运行。
2.1.2 : 质子 -- 质量 = 1 amu,电荷 = +1 .. 中子 -- 质量 = 1 amu,电荷 = 0 .. 电子 -- 质量 = 1/1840 amu(通常可以忽略),电荷 = -1
|
| 锂原子的简单模型。 未按比例缩放! |
原子由原子核和绕原子核运行的电子组成。
原子核由带正电荷的质子和中子组成,中子不带电,但质量与质子大致相同。
电子带负电荷,并以极快的速度绕原子核运行。到目前为止,它们似乎不包含更小的粒子:它们是基本粒子。它们极其微小,事实上微小到没有人能够检测到它们的尺寸。它们也非常轻,远远轻于质子或中子。因此,电子的重量不计入原子序数。
原子在自然状态下不带电,它所含的电子数量与质子数量相同。如果它获得或失去电子,原子就会带电,然后被称为离子。原子中质子的数量决定了它的化学性质(例如氢、金、氩等)。质子不会在化学反应中获得或失去,而只能在高能核反应中获得或失去。
2.1.3 : 质量数 (A) -- 质子数量 + 中子数量。原子序数 (Z) -- 质子数量。同位素 -- 原子序数相同但质量数不同的原子(即中子数量不同)
2.1.4 XAz... A = 质量数,Z = 原子序数,X = 原子符号。
2.1.5 : 同位素在物理性质(质量/密度)和放射性方面可能有所不同,但化学性质通常不会不同。
2.1.6 : 原子质量是每个同位素的原子质量(同位素质量)乘以该同位素的相对丰度得出的平均值。结果是非整数原子质量。
2.1.7 : 原子序数 = 质子数量(或电子数量 - 离子电荷),质量数 - 原子序数 = 中子数量。
2.2 电子排布
2.2.1 : 连续光谱连续地穿过红、橙、黄、绿、蓝、靛、紫。线状光谱只包含该光谱中的一些独立的谱线。
2.2.2 : 电子被激发(通常通过使电流流过它们)。这会导致电子“跃迁”到更高的电子层(X -> X*),这种状态只是暂时的,然而,电子会回到其基态。这种变化(当电子从高能级回到低能级时)会降低电子的能量,而这种能量会以光子的形式释放出来。如果这种光子落在可见光谱中,它就会产生可见光谱。当电子离原子核越来越远时,电子层在空间和能量方面越来越靠近,因此谱线在光谱的末端汇聚。
电子既表现为粒子,也表现为波。
观察结果之一是电子不能以任何他们想要的能量绕轨道运行。想想吉他弦上的驻波。只有整数量的半波长才能在弦上形成驻波,原子层也是如此。由于能量取决于波长,这意味着原子中电子的能量(束缚电子)是量子化的。这意味着能量仅限于某些不同的值,每个层对应一个值,不允许有中间值。
2.2.3 : 主要电子能级依次为:2、8、18 等... 2n + 2 用于 n0、n1 和 n2...
2.2.4 : 电子从左侧添加... 每个层填充完毕后,移动到下一个层... 2、8、18... 只需要到 Z = 20。
主题 12 是主题 2 的 HL 附加材料。
不仅仅是能量是量子化的,电子可以具有的其他性质也被分成不同的单元,没有中间值。角动量是量子化的,自旋是量子化的,你所选择的任何方向的角动量分量是量子化的。实际上,有一整套规则决定了这些性质的每个值可以取的值。
每个不同的层细分为一个或多个轨道,每个轨道都有不同的角动量。轨道中的每个层都有一个特征形状,并用字母命名。它们是:s、p、d 和f。
在一个电子原子(例如 H、He+、Li++ 等)中,特定层内每个轨道的能量都是相同的。但是,当存在多个电子时,它们会相互作用并使轨道分裂成略微不同的能量。在任何特定层内,轨道的能量取决于角动量,s 轨道具有最低能量,然后是 p,然后是 d,依此类推。
原子中最简单的轨道是 1s 轨道。1s 轨道只是一个球形的电子云。
每个电子层只有一个 s 轨道。s 轨道可以容纳两个电子,只要它们自旋量子数不同。
所有 2p 原子轨道的简化图像。
从第二电子层开始,有一组 p 轨道。被限制在 p 轨道中的电子的角动量量子数为 1,因此每个轨道都具有一个角节点。磁量子数有 3 个选择,这表明 3 个方向不同的 p 轨道。最后,每个轨道可以容纳两个电子(自旋相反),使 p 轨道总共可以容纳 6 个电子。
p 轨道都有两个电子云沿每个轴指向。每个轨道沿其轴线对称。p 轨道的符号表示它指向哪个轴,例如 px 指向 x 轴,py 指向 y 轴,pz 指向 z 轴。p 轨道是简并的,它们具有相同的能量。p 轨道经常参与成键。
| 2px | 2py | 2pz |
|---|---|---|
|
|
第一组 d 轨道是 3d 轨道。磁量子数有 5 个选择,这产生了 5 个不同的 d 轨道。每个轨道可以容纳两个电子(自旋相反),使 d 轨道总共可以容纳 10 个电子。
请注意,在 IB 考试中,你只需要了解 s 和 p 轨道的形状。
在大多数情况下,d 轨道是简并的,但在某些情况下,它们会分裂,eg 和 t2g 子集具有不同的能量。晶体场理论预测并解释了这一点。d 轨道有时参与成键,特别是在无机化学中。
参见 NEUSS,P6-7 TOK:原子模型在不同知识领域有何意义?科学家创造的模型和理论是对自然世界的准确描述,还是主要用于预测、解释和控制自然世界的有用解释?
这里是一个典型的原子,氦
TOK:这些粒子都不能(或将不会)被直接观察到。我们使用哪些认识方式来解释通过使用技术获得的间接证据?我们相信或知道它们的存在吗?
公认的值是
| 相对质量 | 电荷 | |
| 质子 | 1 | +1 |
| 中子 | 1 | 0 |
| 电子 | 1/1840 | -1 |
原子的质量是由其核子(质子和中子)决定的。
原子是电中性的,因为它具有相同数量的质子和电子。 电子和质子.
化学(基本上所有化学反应)仅仅是由于电子的行为。
原子的原子序数是质子的数量。
原子的质量数是核子的数量(质子的数量 + 中子的数量)。
原子序数定义了我们正在谈论的元素。具有 16 个质子的元素将是“硫”。
应使用以下符号 AZX,例如 126C
给出以下同位素的符号
| 碳-13 | 铀-235 | 锶-90 | 磷-32 |
| 136C | 23592U | 9038Sr | 3215P |
同位素具有相同的化学性质,但具有不同的物理性质。
“重水”(21H2O 或 D2O)具有以下性质
沸点:在标准压力下为 101.42 °C。
冰点:在标准压力下为 3.81 °C。
相对密度:在 STP 条件下为 1107 g dm-3。
氢-3(“氚”,T)是放射性的,半衰期为 12.32 年。
碳-14 是放射性的,半衰期为 5730 年。
CO2 的密度通常为 1.83 g dm-3,但如果用碳-14 制成,则其密度将为 1.92 g dm-3。
氯-35 气体的密度在标准条件下为 2.92 g dm-3,而氯-37 气体的密度为 3.08 g dm-3。
生物不断积累碳-14,但该同位素会以 5730 年的半衰期衰变。
死亡后,积累停止,但衰变仍在继续,因此碳-14 与碳-12 的比率可用于计算死亡发生的时间。
这可以用来对考古遗址中的有机材料进行年代测定。
钴-60 会发射伽马射线,可以将其照射到肿瘤上,试图杀死其癌细胞。全身照射可用于在尝试移植之前破坏骨髓。
甲状腺是人体唯一积累碘的器官,因此碘的同位素可用于研究甲状腺疾病。将碘-131 或碘-125 以非常低的剂量给予患者,辐射模式可以揭示肿瘤或其他异常生长。更高剂量的碘放射性同位素可以用作甲状腺癌的治疗方法。
完成下表
| 符号 | 质子 | 中子 | 电子 |
|---|---|---|---|
| 115B | 5 | 6 | 5 |
| 6329Cu+2 | 29 | 34 | 27 |
| 20782Pb+2 | 82 | 125 | 80 |
| 3717Cl- | 17 | 20 | 18 |
| 19779Au+3 | 79 | 118 | 76 |
质谱仪的示意图。
通过改变磁场强度,不同质量的离子可以被聚焦到探测器上。通过这种方式,可以确定从样品中产生的不同质量离子的相对丰度。这被称为质谱图。通常电子轰击被调整以产生只有单电荷的离子。任何双电荷离子将比单电荷离子偏转更多,并且实际上会以相同的方式表现为质量为一半的单电荷离子。这就是 x 轴被标记为 m/z 的原因,其中 m 是物质的相对质量,z 是其相对电荷。例如,硫-32(2+)将在 m/z=16 处被观测到。
许多元素的相对原子质量不是整数。这是因为它们是同位素的混合物。每种同位素都有一个摩尔质量,该摩尔质量(几乎)是整数,例如氯-35 的摩尔质量为 35.0 g mol-1,氯-37 的摩尔质量为 37.0 g mol-1。
氯是 24% 氯-37 和 76% 氯-35 的混合物。
因此,摩尔质量为:37 x 0.24 + 35 x 0.76 = 35.48
秘密信息:碳-12 是唯一摩尔质量为精确整数的同位素。其他同位素的摩尔质量几乎是,但并不完全是整数。IB 不需要你了解这一点 - 但它解释了为什么你计算出的值并不总是与你的数据手册中的值相匹配。
这是汞的质谱图。我们可以从该光谱中找到两种类型的信息
汞有六种同位素
汞-202 是最常见的同位素
汞的摩尔质量实际上是其同位素摩尔质量的平均值。从表中我们可以读出这些值
| 同位素 | 信号强度 |
|---|---|
| 198 | 33.8% |
| 199 | 56.4% |
| 200 | 77.5% |
| 201 | 44.3% |
| 202 | 100% |
| 204 | 23.0% |
请注意,“%”不代表“所有汞离子的百分比”。它代表“最强信号的百分比”。总“百分比”为 335%。
要找到平均值,我们将“%”视为摩尔
33.8 摩尔汞-198 的质量为 6692.4 克
| 同位素的摩尔质量 (g mol-1) |
物质的量 (mol) | 质量 (g) |
|---|---|---|
| 198 | 33.8 | 6692.4 |
| 199 | 56.4 | 11223.6 |
| 200 | 77.5 | 15500 |
| 201 | 44.3 | 8904.3 |
| 202 | 100 | 20200 |
| 204 | 23.0 | 4692 |
| 总计 | 335.0 mol | 67212.3 g |
所以我们得到了平均汞原子的摩尔质量:= 200.6 g mol-1
课堂练习 1. 铜有两种稳定的同位素
同位素 丰度 (%) 63Cu 69.1 65Cu 30.9 计算铜的摩尔质量。
2. 溴有两种同位素,79Br 和 81Br。查阅溴的摩尔质量。两种同位素的比例是多少?
3. 硼有两种同位素,10B 和 11B。比例是多少?
4. 铅有四种稳定的同位素
同位素 丰度 (%) 204Pb 1.5 206Pb 23.6 207Pb 22.6 208Pb 52.3 计算铅的摩尔质量。
1. 为测定金的密度,进行了如下实验。金样品的质量 = 30.923 克(有效数字为 5 位),金样品的体积 = 1.6 立方厘米(有效数字为 2 位)。以下哪一个金密度值(以 g cm-3 为单位)是最准确的,可以通过这些测量结果来证明?A. 19.327(有效数字为 5 位)B. 19.33(有效数字为 4 位)C. 19.3(有效数字为 3 位)D. 19(有效数字为 2 位)
2. 氡原子 22286Rn 的原子核包含A. 222 个质子和 86 个中子。B. 86 个质子和 136 个中子。C. 86 个质子和 222 个中子。D. 86 个质子、136 个中子和 86 个电子。
3. 根据我们目前对原子的认识,以下哪句话是正确的?
I. 给定原子中超过 90% 的质量存在于其原子核中。
II. 元素的不同原子可能具有不同的质量。
III. 元素的化学性质主要由其电子决定。
A. 仅 I B. 仅 I 和 II C. 仅 II 和 III D. I、II 和 III
4. 在哪一对中,物质包含相同数量的中子?A. 10846Pd 和 11048Cd B. 11850Sn 和 12050Sn C. 19678Pt 和 19878Pt+2 D. 22688Ra+2 和 22286Rn
5. 哪一对电子和质子可以代表 Sr+2 离子?质子 电子 A. 38 36 B. 38 38 C. 38 40 D. 40 38
6. 锡的所有同位素具有相同的 I. 质子数;II. 中子数;III. 质量数。A. 仅 I B. 仅 II C. 仅 III D. 仅 I 和 III
电磁波谱统一了各种各样的“波”、“射线”和“辐射”。
所有电磁辐射在真空中以 299776 ms-1 的速度传播。
光谱的一部分可以通过其波长、频率或能量来指定。
电磁波谱。红线表示室温热能。 (纳米科学和纳米技术开源手册)。能量以 eV 为单位:1 eV 等于 96.5 kJ mol-1。
频率与能量成正比,与波长成反比。
在能量转移时,电磁辐射表现为称为“光子”的能量“包”。
可见光的波长为 400(蓝色)至 700(红色)纳米,对应于 299(蓝色)至 171(红色)kJ mol-1 的能量。这对大多数键中的电子来说太小,无法与其相互作用,但对使键产生共振来说又太大。
红外光的波长为 0.7 至 1000 微米,并且携带的能量(小于 171 kJ mol-1)可以使键振动。这样,红外有效地传递热能。
紫外光的波长为 1-400 纳米,这使得波具有足够的能量(300+ kJ mol-1)来破坏大多数化学键。
它告诉我们特定元素的电子可以占据的能级数。
连续发射光谱在电磁辐射的宽波长范围内显示发射
线发射光谱只在某些波长处显示发射,而在中间波长处没有发射。
下图显示了氢的线发射光谱和 10000 K 黑体的连续发射光谱。
当氢气被激发时,它会发射出一组特征的谱线。激发气体的方法通常是在低压下通过气体样品通电,但如果氢气被强烈加热,也会产生相同的效果。
谱线具有以下特征
存在几组谱线,在较高频率(较低波长)处越来越密集,直到最后该组谱线结束。
由莱曼发现的最高频率系列位于紫外线区域。较低频率系列位于可见光和红外线区域。
| 系列 | 收敛极限 |
|---|---|
| 莱曼 | 91 nm (UV) |
| 巴尔末 | 365 nm (可见光) |
| 帕申 | 821 nm (IR) |
| 布拉开 | 1.46 μm (IR) |
| 普丰德 | 2.28 μm (IR) |
这些谱线是由氢原子中的电子发射的。电子被输入到氢气样品中的能量(通常是电流)“激发”。
“激发”意味着电子离开其通常的低能轨道(其“基态”)并进入更高能量的轨道。电子的轨道通常被称为“电子层”。
激发的电子最终会“弛豫”到低能轨道。它们以光子的形式发射多余的能量。
从发射光谱模式中,我们可以推断出两点
a) 因为我们观察到线状光谱,我们知道激发电子只有有限数量的更高能量轨道。
b) 每个连续轨道/电子层的能量收敛到一个最大值,因为每组谱线在较高能量处收敛。
莱曼系是由电子直接弛豫到基态引起的。
电离能
第一电离能是指从 1 摩尔气态原子中移除每个原子上的一个电子所需的能量。
例如,Ca (g) → Ca+(g) + e-
莱曼系的收敛极限与氢原子的电离能相关:莱曼系中发射的最大能量光子是电子在仍然是氢原子的一部分时所能具有的最高能量。
较低能量系列是由电子弛豫引起的,但不是弛豫到基态。例如,巴尔末系是由于电子弛豫到具有第二低能量的轨道(到“第二电子层”)时发射的光子造成的。
作业
1. 与氢原子中电子跃迁 n = 3 → n = 2 相对应的谱线是红色的。在跃迁 n = 2 → n = 1 时释放了什么类型的辐射?
A. 紫外线
B. 红光
C. 红外线
D. 无线电波
2. 哪个能级之间的电子跃迁释放的能量最多?
A. 第一能级到第三能级
B. 第四能级到第九能级
C. 第六能级到第三能级
D. 第二能级到第一能级
3. (a) 下图(未按比例)代表氢原子中的一些电子能级。
(i) 在此图上画一个箭头表示氢原子电离的电子跃迁。标记此箭头为 A [2]
(ii) 在此图上画一个箭头表示可见光发射光谱中的最低能量跃迁。标记此箭头为 B [2]
给出以下物质的基态电子排布:硫原子:钾原子:氯离子:镁离子
高阶
研究钙等元素的电离能可以让我们计算出每个电子层中可以容纳的电子数量。
| 电离 | 电离能(kJ mol-1) | log10(IE) |
|---|---|---|
| 第一电离能 | 6.00 x 102 | 2.78 |
| 第二电离能 | 1.15 x 103 | 3.06 |
| 第三电离能 | 4.91 x 103 | 3.69 |
| 第四电离能 | 6.47 x 103 | 3.81 |
| 第五电离能 | 8.14 x 103 | 3.91 |
| 第六电离能 | 1.05 x 104 | 4.02 |
| 第七电离能 | 1.23 x 104 | 4.09 |
| 第八电离能 | 1.42 x 104 | 4.15 |
| 第九电离能 | 1.82 x 104 | 4.26 |
| 第十电离能 | 2.04 x 104 | 4.31 |
| 第十一电离能 | 5.70 x 104 | 4.76 |
| 第十二电离能 | 6.33 x 104 | 4.80 |
| 第十三电离能 | 7.01 x 104 | 4.85 |
| 第十四电离能 | 7.88 x 104 | 4.90 |
| 第十五电离能 | 8.64 x 104 | 4.94 |
| 第十六电离能 | 9.40 x 104 | 4.97 |
| 第十七电离能 | 1.05 x 105 | 5.02 |
| 第十八电离能 | 1.12 x 105 | 5.05 |
| 第十九电离能 | 4.95 x 105 | 5.69 |
| 第二十电离能 | 5.28 x 105 | 5.72 |
课堂练习
绘制 log10(IE) 对电离数的图形。
为什么电离能总是增加?
是什么导致了第二电离能和第三电离能、第十电离能和第十一电离能以及第十八电离能和第十九电离能之间的突然跳跃?
钙的电子构型是什么?
绘制出你对钠的等效图形的预测。
作业
哪种元素会产生这样的图形?
解释图形的形状。
使用你的数据手册绘制 Li 到 Ne 元素的第一电离能图形。为什么从 Li 到 Ne 电离能通常增加?
原子核的电荷从 Li 到 Ne 增加。如果我们减去内层电子的电荷,我们可以计算出作用于外层电子层的电荷:有效核电荷。因为周期中的每个元素都具有相同数量的内层电子,所以有效核电荷从 1 (Li) 到 8 (Ne) 增加。增加的电荷将外层电子保持在适当位置的力增强,从而增加了去除其中一个电子所需的能量。(它还减小了原子的尺寸:Li 比 Ne 大)。
为什么硼和氧的电离能打破了一般趋势?
s2 排布是稳定的(就像“惰性气体构型”是稳定的)。
硼具有 [He] 2s2 2px1 排布。失去 px1 电子使硼恢复到这种稳定状态,因此失去这个电子出乎意料地容易。
类似地,s2 px1 py1 pz1 排布是稳定的。
氧具有 [He] 2s2 2px2 2py1 2pz1 排布。失去一个 px 电子使氧恢复到这种稳定状态,因此失去这个电子出乎意料地容易。
每个能级(“壳层”)由轨道(“亚壳层”)组成。
每个轨道可以容纳两个电子。
轨道类型的数量等于壳层数,例如:壳层 3 有三种类型的轨道,s、p 和 d。
壳层 1 1s
壳层 2 2s 2p
壳层 3 3s 3p 3d
壳层 4 4s 4p 4d 4f
壳层 5 理论上具有五种类型的轨道,但目前没有已知的元素使用其 g 轨道。
每个壳层中的轨道具有递增的能量。s 的能量最低,然后是 p、d、f 等。每个壳层只有一个 s 轨道。有三个 p 轨道,五个 d 轨道等。
s 轨道是简单的球体。
三个 p 轨道沿 x、y 和 z 轴排列。
壳层 1 和 2 的轨道显示为(顶部)可能的电子位置云和(底部)包含大多数电子特征的表面。
洪特规则:要找到元素的电子构型,我们一个一个地构建电子,将每个电子放入能量最低的可用轨道。记住哪个是能量最低的可用轨道的一个简单方法是使用以下图表
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f …
6s 6p 6d …
7s 7p …
洪特规则:如果有不止一个轨道可供选择,例如 2p 轨道,则这些轨道将每个填入一个电子,然后再填入电子对。
氮的电子构型为
1s 2s 2px 2py 2pz
↑↓ ↑↓ ↑ ↑ ↑
而不是
1s 2s 2px 2py 2pz
↑↓ ↑↓ ↑↓ ↑
编写完整电子构型的最简单方法是记下最后一个惰性气体,然后像这样添加任何额外的电子
钒:1s2 2s2 2p6 3s2 3p6 4s2 3d3
钒:[Ar] 4s2 3d3
无论您是以填充顺序(如上例所示)还是以壳层顺序编写轨道,都没有关系
钒:[Ar] 3d3 4s2
元素 24 和 29 是特例。3d5 和 3d10 构型非常稳定,因此会从 4s 轨道中取出一个电子以创建 3d5 和 3d10 构型。
例如:铬不是:[Ar] 4s2 3d4 铬是:[Ar] 4s1 3d5 完成下表:1s H
He 2s 2p Li [He] 2s^1
Be [He] 2s^2
B [He] 2s^2 2p^1
C [He] 2s^2 2p^2
N [He]
O [He]
F [He]
Ne [He] 3s 3p Na [Ne]
Mg [Ne]
Al [Ne]
Si [Ne]
P [Ne]
S [Ne]
Cl [Ne]
Ar [Ne] 3d 4s 4p K [Ar]
Ca [Ar]
Sc [Ar]
Ti [Ar]
V [Ar]
Cr [Ar]
Mn [Ar]
Fe [Ar]
Co [Ar]
Ni [Ar]
Cu [Ar]
Zn [Ar]
Ga [Ar]
Ge [Ar]
As [Ar]
Se [Ar]
Br [Ar]
Kr [Ar] 4d 5s 5p Rb [Kr]
Sr [Kr]
Y [Kr]
Zr [Kr]
Nb [Kr]
Mo [Kr]
Tc [Kr]
Ru [Kr]
Rh [Kr]
Pd [Kr]
Ag [Kr]
Cd [Kr]
In [Kr]
Sn [Kr]
Sb [Kr]
Te [Kr]
I [Kr]
Xe [Kr]
元素周期表的四个区块以最高能量占据轨道命名





