无机化学/化学键/路易斯点结构
路易斯结构,也称为路易斯点图,是显示分子中原子之间键合以及分子中可能存在的孤对电子的图。 [1][2] 可以为任何共价键合的分子以及配位化合物绘制路易斯结构。 路易斯结构以吉尔伯特·N·路易斯命名,他在 1916 年的论文《原子与分子》中引入了它 [3]。 它们类似于电子点图,因为孤对中的价电子用点表示,但它们也包含线来表示化学键中的共享对(单键、双键、三键等)。
路易斯的结构使用其化学符号显示分子结构中的每个原子。 在彼此键合的原子之间绘制线条(很少情况下,使用点对代替线条)。 形成孤对的剩余电子用点对表示,并放置在原子旁边。

对于包含多个元素且公式中只有一个原子的化合物,中心原子是电负性最低的单个原子,而不是氢原子。 例如,在亚硫酰氯(SOCl2)中,硫原子是中心原子。
初始的路易斯结构应该以每个非中心原子通过单键连接到中心原子来绘制,尽管并非所有原子都需要连接以显示键。
在某些情况下,中心原子很难确定,通常是当每个元素出现不止一次时。 在这些情况下,结构的连接性——也就是说,确定哪些原子连接到哪些其他原子——必须通过反复试验或先验知识来确定。
当中心原子已知或确定时,可以以完全相同的方式绘制路易斯结构。
路易斯结构中表示的电子总数等于每个单个原子上的价电子数之和。 非价电子在路易斯结构中没有表示。
八隅体规则指出,价电子层中具有八个电子的分子将是稳定的,无论这些电子是成键的还是非成键的。 该规则适用于有机化合物。 18 电子规则适用于周期 4 中的原子,它们必须达到 18 个电子才能填满其轨道并获得惰性气体构型。 同样,周期 6 中的原子必须达到 32 个电子才能填满其轨道。
一旦确定了可用电子的总数,就必须将电子放置到结构中。 它们应该首先被放置为孤对:每对可用电子放置一对点。 孤对应该首先放置在外原子(除了氢以外)上,直到每个外原子在成键对和孤对中具有八个电子; 额外的孤对然后可以放置在中心原子中。 有疑问时,孤对应该首先放置在电负性更强的原子中。
一旦所有孤对都放置完毕,原子(尤其是中心原子)可能没有八个电子的八隅体。 在这种情况下,原子必须形成双键; 一对孤对电子被移动以形成两个原子之间的第二个键。 由于成键对在两个原子之间共享,因此最初具有孤对的原子仍然具有八隅体; 另一个原子现在在其价电子层中多了两个电子。
除了有机化合物外,只有少数化合物在其价电子层中具有八个电子的八隅体。 不完整的八隅体对于第 2 族和第 13 族元素的化合物(例如铍、硼和铝)很常见。 在路易斯表示中原子价电子层具有超过八个电子的化合物被称为超价化合物,对于第 15 族至第 18 族元素(例如磷、硫、碘和氙)很常见。
多原子离子的路易斯结构可以通过相同的方法绘制。 在计算电子时,负离子应该在其路易斯结构中放置额外的电子; 正离子应该比中性分子具有更少的电子。
当离子路易斯结构被写出时,整个结构被放置在方括号中,电荷被写为方括号外部右上角的上标。
已经提出了一种更简单的方法来构建路易斯结构,消除了对电子计数的需要:原子被绘制出来显示价电子,然后通过将参与成键过程的原子的价电子配对来形成键,阴离子和阳离子通过向适当的原子添加或移除电子来形成。 [4]
就路易斯结构而言,形式电荷用于描述、比较和评估可能的拓扑结构和共振结构 [5] 通过确定每个原子内的表观电子电荷,基于其电子点结构假设排他共价性或非极性键合。 它在确定涉及反应机理的可能电子重新配置方面有用途,并且通常导致与原子的部分电荷相同的符号,但也有例外。 通常,原子的形式电荷可以使用以下公式计算,假设对使用的标记使用了非标准定义
其中
- 是形式电荷。
- 表示元素自由原子中的价电子数。
- 表示原子中未共享的电子数。
- 表示原子与另一个原子形成的键的总数。
原子的形式电荷计算为中性原子具有的价电子数与它在路易斯结构中所具有的电子数之差。共价键中的电子在参与键合的原子之间平均分配。离子上的形式电荷总和应该等于离子的电荷,而中性分子上的形式电荷总和应该等于零。
对于某些分子和离子,很难确定哪些孤对电子应该移动以形成双键或三键。当相同类型的多个原子围绕中心原子时,这种情况有时会发生,对于多原子离子尤其常见。
当出现这种情况时,该分子的路易斯结构被称为共振结构,该分子以共振杂化体的形式存在。不同的可能性叠加在一起,并且认为该分子具有等效于这些状态平均值的路易斯结构。
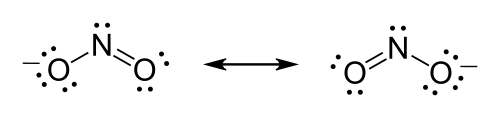
例如,硝酸根离子 (NO3-) 必须在氮和其中一个氧之间形成双键以满足氮的八隅体规则。但是,由于该分子是对称的,因此哪个氧形成双键并不重要。在这种情况下,存在三种可能的共振结构。在绘制路易斯结构时表达共振可以使用以下两种方法:绘制每个可能的共振形式并在它们之间放置双箭头,或者使用虚线表示部分键。
在比较同一分子的共振结构时,通常那些形式电荷最少的结构对总共振杂化体的贡献更大。当需要形式电荷时,那些在电负性更大的元素上带负电荷,在电负性更小的元素上带正电荷的共振结构更受青睐。
在路易斯共振结构中,该结构被写成似乎该分子可以在多种形式之间切换。但是,该分子本身以这些形式的混合体存在。
以硝酸根离子为例,每种共振形式都有两个单键和一个双键。但是,当检查硝酸根离子时,每个键似乎都有 1.333 的键序——也就是说,每个键都具有好像由一个三分之一的总键组成的性质。每个键的长度和键能介于单键和双键之间。
不应该将共振结构解释为该分子在形式之间切换,而是该分子作为多种形式的平均值起作用。
亚硝酸根离子的化学式为 NO2−。
第一步:氮是电负性最强的原子,因此根据多种标准它是中心原子。
第二步:计算价电子。氮有 5 个价电子;每个氧有 6 个,总共 (6 × 2) + 5 = 17 个。该离子带 -1 电荷,表示有一个额外的电子,因此电子总数为 18 个。
第三步:放置离子对。每个氧必须与氮键合,这将使用 4 个电子——每个键中 2 个。剩下的 14 个电子应该最初被放置为 7 个孤对。每个氧最多可以接受 3 个孤对,使每个氧包含 8 个电子,包括键合对。第七个孤对必须放置在氮原子上。
第四步:满足八隅体规则。两个氧原子目前都分配了 8 个电子。氮原子只分配了 6 个电子。氧原子上的一个孤对必须形成双键,但两个原子都同样有效。因此,我们必须有一个共振结构。
第五步:处理松散的结尾。必须绘制两个路易斯结构:一个与每个氧原子双键与氮原子键合。每个结构中的第二个氧原子将与氮原子单键键合。在每个结构周围放置方括号,并将电荷 (-) 添加到方括号外面的右上角。在两种共振形式之间绘制双箭头。



化学结构可以用更紧凑的形式写出,尤其是在显示有机分子时。在缩写结构式中,许多甚至所有共价键都可能被省略,下标表示连接到特定原子的相同基团的数量。另一种简写结构图是骨架式(也称为键线式或碳骨架图)。在骨架式中,碳原子不用 C 符号表示,而是用线的顶点表示。与碳键合的氢原子没有显示出来——它们可以通过计算特定碳原子的键合数量来推断——假设每个碳都有四个键,因此任何未显示的键都隐含地与氢原子键合。
其他图表可能比路易斯结构更复杂,使用各种形式(例如空间填充图)以 3D 方式显示键。
- ↑ Zumdahl, S. (2005) 化学原理 Houghton-Mifflin ISBN 0-618-37206-7
- ↑ Miessler, G. L.、Tar, D. A. (2003) “无机化学” 第 2 版 Pearson Prentice-Hall ISBN 0-130-35471-6
- ↑ Lewis, G. N. 原子和分子。J. Am. Chem. Soc. 1916, 38, 762-785. doi:10.1021/ja02261a002
- ↑ 为非科学专业人士简化路易斯结构绘制 Miburo, Barnabe B. J. Chem. Educ. 1992 75 317. 链接
- ↑ Miessler, G. L.、Tar, D. A. (2003),第 53 页——对形式电荷使用说明的解释。





