无机化学导论/酸碱化学


酸和碱在无机化学中很重要,原因有很多。
- 许多工业上有用的催化反应涉及无机酸和 超强酸,例如沸石、无水氢氟酸和硫酸化氧化锆。这些酸在无水介质中足够强,可以质子化烯烃和醇,生成碳正离子。 碳正离子 是烃类转化过程中的关键中间体。
- 无机化合物有时在强酸性或碱性介质中合成。例如,三元金属氧化物可以在熔融 NaOH 或 KOH(强碱)中合成和结晶。有机氟化反应通常在强酸性介质中进行,例如无水 HF。了解酸和碱在水中的熟悉化学原理有助于我们了解这些非水介质的工作原理。
- 金属离子的酸性或碱性环境会影响其氧化态的稳定性。我们将在第 4 章中进一步了解这一点。
- 过渡金属配合物(配位化合物和有机金属化合物)本质上是路易斯酸碱配合物。通过考虑金属和配体的酸碱性质,我们可以了解很多关于它们的稳定性和反应性的信息。我们将在第 5 章中学习这方面的知识。
第 3 章的学习目标
- 了解布朗斯特和路易斯酸碱的定义。
- 识别共轭酸和碱,以及布朗斯特和路易斯酸碱体系中强酸/强碱和弱酸/弱碱的规则。
- 使用鲍林规则预测含氧酸的 pKa。
- 了解酸性、碱性和两性化合物的周期性趋势。
- 预测、描述和解释非水体系中的酸碱化学,包括酸性和碱性溶剂、非质子溶剂和熔盐。
- 将酸碱化学原理应用于具有目标功能的分子和路易斯酸的设计。
- 了解酸碱化学与氧化态稳定性之间的联系。
- 使用硬软酸碱 (HSAB) 理论预测有利的和稳定的化合物。
- 了解 ECW 模型的应用。

酸和碱的三种理论。 有三种主要的物质分类被称为酸或碱。阿伦尼乌斯定义指出,酸在溶液中产生 H+,碱产生 OH-。该理论由 斯万特·阿伦尼乌斯 于 1883 年提出。后来,人们提出了两种更复杂、更通用的理论。它们是布朗斯特-劳里酸碱和路易斯酸碱的定义。这些理论之间的关系在左图中说明。
在酸碱化学中,氢离子通常被称为质子 (H+),并写为 H+,但实际上它以多种水合形式存在,包括 H3O+、H5O2+、H7O3+。当我们写 H+(aq) 或 H3O+(aq) 时,我们指的是这些质子化水形式的动态平衡混合物。
阿伦尼乌斯理论是最简单、最不普遍的酸和碱描述,包括 HClO4 等酸以及 NaOH 或 Mg(OH)2 等碱。该理论成功地描述了酸和碱如何相互反应生成水和盐。然而,它并没有解释为什么一些不含氢氧根离子的物质,例如 F- 和 NO2-,可以在水中形成碱性溶液。布朗斯特-劳里酸碱的定义解决了这个问题。在这个理论中,酸是一种可以释放质子的物质(就像在阿伦尼乌斯理论中一样),而碱是一种可以接受质子的物质。碱性盐(例如 Na+F-)通过从水本身(生成 HF)中夺取质子而在水中生成 OH- 离子
- F-(aq) + H2O(l) ⇌ HF(aq) + OH-
当布朗斯特酸解离时,它会增加溶液中氢离子浓度 [H+];相反,布朗斯特碱通过从溶剂(水)中夺取质子解离,生成 [OH-]。
- 酸解离: HA(aq) ⇌ A-(aq) + H+(aq)
- Ka=[A-][H+]/[HA]
- 碱解离: B(aq) + H2O(l) ⇌ HB+(aq) + OH-(aq)
- Kb = [HB+][OH-]/[B]
共轭酸和碱。 这些平衡的一个重要结果是,每种酸 (HA) 都有一个共轭碱 (A-),反之亦然。在上式中的碱解离平衡中,碱 B 的共轭酸是 HB+。
对于给定的酸或碱,这些平衡由水解离平衡联系在一起
- H2O(l) ⇌ H+(aq) + OH−(aq)
- Kw = [H+][OH−]
该平衡常数 Kw 在 25°C 时为 1.00 × 10−14。可以很容易地证明酸和碱解离常数 Ka 和 Kb 的乘积为 Kw。
强酸和弱酸,强碱和弱碱。 完全解离的酸和碱被称为强酸和强碱
- HClO4(aq) → H+(aq) + ClO4−(aq)
- HBr(aq) → H+(aq) + Br−(aq)
- CH3O−(aq) + H2O(l) → CH3OH(aq) + OH−(aq)
- NH2−(aq) + H2O(l) → NH3(aq) + OH−(aq)
这里的右箭头 (→) 意味着反应进行到底。也就是说,1.0 M 的 HClO4 水溶液实际上包含 1.0 M H+(aq) 和 1.0 M ClO4−(aq),以及很少量的未解离的 HClO4。
相反,弱酸(如乙酸 (CH3COOH))和弱碱(如氨 (NH3))在水中仅解离少量——通常为百分之几,取决于它们的浓度以及 Ka 和 Kb 的值——并且主要以未解离的分子形式存在。

示例:家用氨是 NH3 在水中的溶液,重量百分比约为 5-10%。让我们计算一下溶液的电离百分比和 pH 值。
对于重量百分比为 8% 的氨溶液,假设其密度与液态水相同,则氨的分析浓度为 (80 g/L) / (17 g/mol) = 4.7 M。
我们还需要知道另一个东西来解决这个问题,那就是碱解离常数 Kb。
- NH3 + H2O ⇌ NH4+ + OH− Kb = 1.8 × 10−5
我们可以通过引用电荷平衡 ([H+] + [NH4+] = [OH−]) 和质量平衡 (4.7 M = [NH3] + [NH4+]) 并使用 Kw = [H+][OH−] 来严格地解决这个问题。但由于使用这种方法进行的代数运算会变得复杂——导致难以求解的三次方程——因此我们将引用两个简化假设
- [NH4+] ≈ [OH−] >> [H+] (这对碱性溶液来说是一个合理的假设)
- 并且
- [NH3] >> [NH4+] (如果电离百分比很小,这也是合理的)
现在我们可以写
- [NH4+][OH−] ≈ [OH−]2 = (4.7 M)(Kb) = 8.4 × 10−5
- [OH−] = 9.2 × 10−3 M (≈ [NH4+]),[H+] = Kw/[OH−]= 1.1 × 10−12 M,pH = 11.97
电离百分比为
- 100% x 9.2 x 10−3 M / 4.7 M = 0.19%
这个例子说明,将一瓶氨水标注为“氢氧化铵”在技术上是不正确的,因为只有大约 0.2% 的弱碱以这种形式存在。
共轭酸和碱。一个常见的误解是强酸具有弱共轭碱,弱酸具有强共轭碱。记住 KaKb = Kw,很容易看出这是不正确的。我们对强酸或碱的定义是 K >> 1,即该物质完全解离。我们对弱酸或碱的定义是 1 > K > Kw。因此,如果 Ka >> 1(强),则 Kb 不能大于 Kw(弱)。
事实上,强酸如 HCl 解离产生旁观离子如 Cl− 作为共轭碱,而弱酸产生弱共轭碱。下面以乙酸及其共轭碱醋酸根离子为例说明。乙酸是弱酸(Ka = 1.8 x 10−5),醋酸根离子是弱碱(Kb = Kw/Ka = 5.6 x 10−10)。
![]()
共轭酸/碱的强度与其母体酸或碱的强度或弱度成反比。任何酸或碱在技术上也是共轭酸或共轭碱;这些术语只是用来识别溶液中的物质(例如,乙酸是醋酸根离子的共轭酸,醋酸根离子是一种碱,而醋酸根离子是乙酸的共轭碱,乙酸是一种酸)。
中性含氧酸(H2SO4、H3PO4、HNO3、HClO2 等)可以根据莱纳斯·鲍林首先提出的简单规则分为强酸或弱酸。如果氧原子数比氢原子数多两个或更多,则该酸为强酸;否则为弱酸。例如,HClO4 和 HClO3 的差值分别为 3 和 2,都是强酸。HNO2 和 HClO2 都是弱酸,因为两种情况下差值都为 1。对于弱酸,相对强度取决于此差值(例如,HClO2 是比 HOCl 更强的弱酸)以及中心原子的电负性(HOCl 比 HOI 强)。
可以捐赠多个质子的酸称为多质子酸。例如,硫酸 H2SO4 是一种强酸,其共轭碱恰好本身也是弱酸。这意味着水溶液中的每摩尔 H2SO4 都捐赠了超过 1 摩尔的质子。碳酸 (H2CO3) 和磷酸 (H3PO4) 是弱多质子酸。通常,多质子酸的连续 pKa 之间相隔约 5 个 pH 单位,因为随着离子变得更负电荷,去除质子变得越来越困难。例如,磷酸的三个 pKa 为 2.15、7.20 和 12.35。

两性化合物。有些物质可以同时作为酸和碱。例如,水。H2O 分子既可以捐赠氢离子,也可以接受氢离子。这种性质使水成为一种两性溶剂。在酸在溶液中解离的情况下,水充当碱。相反,当碱解离时,水充当酸。我们可以在 H2O 中制成的最强酸是 H+ (aq),我们可以在 H2O 中制成的最强碱是 OH− (aq)。
两性化合物的其他例子是位于周期表中金属和非金属元素之间的边界上的元素的氧化物和氢氧化物。例如,氢氧化铝 (Al(OH)3) 在中性 pH 下不溶,但在酸性环境中可以接受质子形成 [Al(H2O)6]3+,或者在碱性环境中接受一个 OH− 离子形成 Al(OH)4− 离子。因此,氧化铝溶于酸和碱,但不溶于中性水。两性氧化物的其他例子是 BeO、ZnO、Ga2O3、Sb2O3 和 PbO。增加金属的氧化态通过从氧原子中吸取电子密度来增加其氧化物的酸性。因此,Sb2O5 是酸性的,但 Sb2O3 是两性的。
溶剂水平效应。溶剂水平效应是指当强酸置于如 (但不限于) H2O 等溶剂中时发生的一种效应。由于强酸将其质子捐赠给溶剂,因此可能存在的最强酸是溶剂的共轭酸。在水溶液中,这是 H3O+。这意味着 HCl 和 HBr 等酸的强度在水中无法区分,因为它们都 100% 解离为 H3O+。在我们上面讨论的共轭碱的背景下,我们可以说 Cl− 和 Br− 都是水的旁观离子:它们都不是强碱,无法从 H3O+ 中接受质子。为了区分 HClO4 和 HCl 等强酸的酸性,或区分 CH3O− 和 NH2− 等强碱的碱性,我们通常必须在非水溶剂中进行操作,如下所述。
非水溶液。布朗斯台德理论涵盖了任何可以捐赠和接受 H+ 离子的溶剂类型,而不仅仅是水溶液。酸或碱的强度取决于溶剂。非水酸碱化学遵循与水中的酸和碱类似的规则。例如,在液氨中,溶剂在以下反应中发生自解离:
- 2NH3(l) ⇌ NH4+ + NH2−
该平衡类似于水的自解离,但其平衡常数更小 (K ≈ 10−30)。类比于水,我们可以得出 NH4+ 是液氨中最强的酸,NH2− 是液氨中最强的碱。由于氨是一种碱性溶剂,它增强了溶解其中的物质的酸性,并抑制了它们的碱性。例如,铵离子 (NH4+) 在水中是一种弱酸 (Ka = 6 x 10−10),但在氨中是一种强酸。同样,乙酸在水中是弱酸,但在氨中是强酸。溶剂水平效应实际上使 HCl、CH3COOH 和 NH4Cl 在氨中都是强酸,它们的酸强度相同。
在水中发生水平效应的强酸在 HF 或无水乙酸等酸性溶剂中具有不同的酸强度。例如,HX 在乙酸 (CH3COOH) 中的酸解离涉及质子化溶剂形成其共轭酸 (CH3COOH2+) 和 X− 阴离子。由于 CH3COOH2+ 比 H3O+ 是一种更强的酸,因此阴离子 X−(在水中是旁观离子)可以在 CH3COOH 中成为弱碱
- HX + CH3COOH ⇌ CH3COOH2+ + X−
因此,酸性溶剂会放大那些不能在水中接受质子的物质的布朗斯台德碱性。相反,碱性溶剂会放大那些不能将质子捐赠给 OH− 的物质的酸性。
非水溶剂的酸性和碱性难以精确量化,但一个很好的相对测量值是汉密特酸度函数,Ho。Ho 根据亨德森-哈塞尔巴赫方程定义,类似于 pH
Ho = pKa + log([碱]/[共轭酸])
对于非水溶剂,或对于溶解在本身不发生解离的溶剂中的酸性或碱性化合物,Ho 是所讨论的溶剂或化合物的 pH 的粗略测量值。无水 HF 和 H2SO4 的 Ho 值分别约为 -10 和 -12。
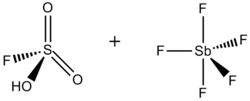
超强酸和超强碱。术语超强酸最初是由詹姆斯·布莱恩特·科南特 在 1927 年创造的,用于描述比传统无机酸更强的酸。[1] 乔治·奥拉 通过将五氟化锑 (SbF5) 和氟磺酸 (FSO3H) 混合,制备了所谓的魔酸,之所以这样命名是因为它能够攻击碳氢化合物。这个名字是在将一根蜡烛放入魔酸样品中后取的。蜡烛溶解了,表明该酸能够质子化碳氢化合物,而在水性酸性条件下,碳氢化合物无法被质子化。
在 140 °C 下,FSO3H–SbF5 将甲烷转化为叔丁基碳正离子,该反应以甲烷的质子化为起点:[2]
- CH4 + H+ → CH+5
- CH+5 → CH+3 + H2
- CH+3 + 3 CH4 → (CH3)3C+ + 3H2
氟锑酸,HSbF6,可以产生 H0 低至 –28 的溶液。[3] 氟锑酸是通过将 HF 和 SbF5 混合制成的。在这个体系中,HF 释放其质子 (H+),同时 F− 与五氟化锑结合,五氟化锑(如下所述)是一种路易斯酸。由此产生的阴离子 (SbF6-) 既是弱亲核试剂,又是极弱的碱。
超强酸 在烷烃异构化等反应中很有用。在工业上,无水酸交换沸石(超强酸催化剂)在将原油加工成汽油的碳氢化合物异构化过程中大规模使用。 超强碱,如二乙基锂胺 (LiNEt2)、烷基锂化合物 (RLi) 和格氏试剂 (RMgX) 在广泛的有机反应中很有用。LiNEt2 去质子化 C-H 键以生成反应性碳负离子。RLi 和 RMgX 是强大的亲核试剂。
在非水介质中使用超强碱可以让我们对不同类型分子的酸性进行排序(并测量它们的 pKa 值)。这种排序对于理解有机分子的反应尤为重要。需要注意的是,烃类酸性的顺序是炔烃 >> 烯烃、芳烃 >> 烷烃。这种顺序与形成碳负离子的碳原子的杂化方式有关。碳负离子的负电荷孤对电子在 s 特性高的轨道(例如 sp 与 sp2 或 sp3)中得到稳定。这是因为 s 轨道在原子核处具有有限的概率密度,并且比 p 轨道“感受”到更强的正核电荷(从而稳定碳上的额外负电荷)。共振效应也能稳定碳负离子。因此,环戊二烯的酸性甚至比炔烃还强,因为当 C5H6 去质子化时,负电荷会在整个(芳香族)C5H5- 环上离域。
| 名称 | 化学式 | 结构式 | pKa |
|---|---|---|---|
| 甲烷 | CH4 | 
|
56 |
| 丙烯 | C3H6 | 44 | |
| 苯 | C6H6 | 43 | |
| 乙炔 | C2H2 | 
|
25 |
| 环戊二烯 | C5H6 | 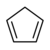
|
18 |
| 表 1. 碳酸在 pKa 在 DMSO [4] 中的酸性. | |||
熔融盐中的酸碱平衡。 当固体盐熔化时,它会形成阳离子和阴离子的溶液。例如,KOH 在高于 400 °C 的温度下熔化并解离成 K+ 和 OH- 离子,它们可以作为化学反应的溶剂。由于 OH- 溶剂的自身解离,根据酸碱平衡,水中总是存在水
- 2 OH- ⇌ H2O + O2-
因此,在这种非常碱性的溶剂中,水(溶剂的共轭酸)是存在的最强酸。溶剂的共轭碱 O2- 是最强碱。这种自身解离平衡允许通过添加或蒸发水轻松调节熔体的酸性。“湿”熔体更酸性,可以溶解含有碱性 O2- 阴离子的金属氧化物。相反,“干”熔体更碱性,会导致氧化物沉淀。因此,熔融氢氧化物熔体可用于合成氧化物晶体,例如钙钛矿超导体 (K1-XBaXBiO3)。[5]。NaOH 和 KOH 的低共熔混合物熔点相对较低(≈ 200 °C),可以用作结晶各种碱性氧化物的溶剂。
路易斯酸和碱
路易斯酸碱分类比布朗斯特-劳里定义更广泛,涵盖了更多物质。布朗斯特-劳里和阿仑尼乌斯分类基于质子的转移,而路易斯酸性和碱性则基于电子对的共享。路易斯酸可以接受电子对,而路易斯碱可以提供电子对。这个定义涵盖了布朗斯特-劳里定义,因为 H+ 是一个电子对接受体(当与碱相互作用时),而碱在其与 H+ 的相互作用中是一个电子对供体。下图说明了氨的质子化过程。

三氟化硼 BF3 在与可以提供电子对的碱性离子或分子结合时充当路易斯酸。下图显示了这样的反应。
- BF3 + F- ⇌ BF4-
这里,酸是 BF3,碱是 F-。这种酸碱反应允许硼(在 BF3 中电子不足)完成其八隅体。类似地,AlCl3 是一种路易斯酸,可以与 Cl-(一种路易斯碱)反应生成路易斯“盐”AlCl4-。注意,在水中,Cl- 是一个旁观离子(比溶剂弱碱性),在布朗斯特酸碱反应中。
路易斯酸碱反应的其他示例。在每个示例中,尝试根据碱是提供电子对的分子或离子的概念来确定酸、碱和盐。在你不确定的情况下,绘制分子的 VSEPR 结构可能会有所帮助
- I2 + I- ⇌ I3-
- AuCl3 + Cl- ⇌ [AuCl4]-
- Fe3+ + 6 H2O ⇌ [Fe(H2O)6]3+
- TiF4 + 2 F- ⇌ [TiF6]2-
- SF4 + SbF5 ⇌ “SSbF9”
在其他路易斯酸碱反应中,酸和碱都是分子,产物被称为加合物。
- (CH3)3 B + N(CH3)3 →(CH3)3 B-N (CH3)3
- I2 + S(CH3)2 → I2-S(CH3)2
- C5N5N + Cu(HFacac)2 → C5N5N-Cu(HFacac)2
路易斯酸性是配位化学的基础,我们将在第 5 章中更详细地讨论这个主题。这是因为配位化学涉及作为路易斯酸的金属离子,它们与作为路易斯碱的配体结合。
确定金属离子路易斯酸的强度。金属离子路易斯酸强度的三个决定因素
1. 金属上正电荷越高,酸性越强。例如,Al3+ 和 Fe3+ 是良好的路易斯酸,它们的盐在水中形成酸性溶液,但 K+ 和 Na+ 则不是。
2. 金属离子的原子半径越小,酸性越强。沿着周期表向下,金属离子的路易斯酸性降低(例如,Al3+ > Ga3+ > In3+),因为离子半径增大。
3. 对于过渡金属离子,电负性更高的金属往往形成更强的路易斯酸。电负性在 5d 系列的 W 和 Au 处达到最大值,因此周期表中该部分附近的金属离子是良好的路易斯酸。
具有五配位几何结构的分子(例如,PCl5、AsF5、SbF5)通常是强路易斯酸,因为当从碱接受另一对电子时,它们会形成八面体分子或阴离子。两种常见的五配位几何结构(三角双锥或四方锥)在堆积方面都不是有效的。路易斯酸碱反应形成一个额外的键,其能量损失相对较小,仅需拉伸现有键即可。

由于 F- 是一个良好的路易斯碱,也是一个小的阴离子,它可以与主族元素和过渡金属形成稳定的八面体阴离子。因此,TiO2 和 SiO2 溶解在 HF 中(但与水溶液 HCl 和其他强酸不反应)
- TiO2 + 4 HF + 2 F- ⇌ TiF62- + 2 H2O
- SiO2 + 4 HF + 2 F- ⇌ SiF62- + 2 H2O

路易斯碱稳定高氧化态。一个使用路易斯酸碱化学驱动反应的有趣例子是氟气(F2)的化学合成,该合成方法由 Karl O. Christe 于 1986 年提出。[6] Christe 当时正在组织一个研讨会,纪念 Henri Moissan 分离元素氟 100 周年,Moissan 是在 1886 年通过电解无水 HF 溶液来完成的。100 年后,仍然没有 F2 的直接(非电化学)合成方法。Christe 的反应方案包括两个步骤。第一步是已知的由 KMnO4 合成 K2MnF6
- 4 MnO4-(aq) + 10 H2O(l) + 24 F-(aq) → 4 MnF62-(aq) + 3O2(g) + 20 OH-(aq)
- 2 K+(aq) + MnF62-(aq) → K2MnF6(s)
第二步是让 K2MnF6 与强路易斯酸 SbF5 反应,生成亚稳态 MnF4,它会自发分解成 MnF3 和氟气
- K2MnF6(s) + 2 SbF5(l) → 2 KSbF6(s)+ “MnF4”(s)
- “MnF4”(s) → MnF3(s) + 1/2 F2(g)
这个反应教会了我们关于酸碱与氧化还原化学之间联系的一些有趣而重要的内容。酸倾向于稳定低氧化态,而碱倾向于稳定高氧化态(我们将在第 4 章中讨论 Pourbaix 图时再次看到这一点)。在 K2MnF6 中,Mn 在 +4 氧化态下稳定,因为它被六个碱性 F- 阴离子包围。然而,Mn 的最高稳定中性氟化物是 MnF3,而 MnF4(从 K2MnF6 中短暂形成)会自发分解生成氟。
氧化物是比氟化物更好的碱。有趣的是,Mn 可以失去所有价电子形成高锰酸根离子 MnO4- 中的 Mn7+。这里,7+ 氧化态通过与四个 O2- 离子的配位以及 MnO4- 阴离子的整体 -1 电荷来静电稳定。由于它的 2- 电荷,O2- 是比 F- 更强的碱,也是稳定高氧化态的更好离子。这是过渡金属中的一般趋势:最高氧化态通常出现在氧化物中,而不是氟化物中,尽管 F 是比 O 更具电负性的元素。例如,Cr6+ 在 CrO42- 和 Cr2O72- 阴离子中稳定,但在任何中性氟化物或氟化物阴离子中都不稳定。+8 氧化态出现在 RuO4 和 OsO4 中,但在任何 Ru 或 Os 的氟化物中都不稳定。
3.2 硬酸和软酸以及硬碱和软碱
[edit | edit source]路易斯酸和碱可以根据其是硬的还是软的进行分类。
- 硬酸/硬碱
- “硬”酸和碱具有高电荷(酸为正,碱为负)与离子半径之比,以及更高的氧化态。硬酸不容易极化,具有高电荷密度。因此,具有高正电荷和较小离子尺寸的金属离子往往是硬酸。3d 系列中的早期过渡金属离子往往是硬路易斯酸。硬碱通常是小的阴离子和中性分子。一些硬酸和碱的例子包括:H+、O2-、OH-、F-、Fe3+ 和 Al3+。
- 软酸/软碱
- “软”酸或碱具有低电荷与半径之比,具有低氧化态。它们通常是更大的离子,是可极化的。例如,I- 和 S2- 是软碱,而低电荷密度过渡金属,如 Ag+,被认为是软酸。软酸通常包括周期表第二行和第三行中带 +1 或 +2 电荷的过渡金属,以及具有填充或几乎完全填充的d轨道的晚期过渡金属(尤其是 4d 和 5d 系列中的金属)。
酸和碱并非严格地是硬的或软的,许多离子化合物被归类为中间体。例如,三甲基硼烷、Fe2+ 和 Pb2+ 阳离子是中间体酸,而吡啶和苯胺是中间体碱的例子。元素的硬/软性质也会随着其氧化态的变化而改变。最极端的例子是氢,其中 H+ 是硬酸,而 H- 是软碱。Ni3+(如层状化合物 NiOOH 中的 Ni3+)是硬酸,但 Ni0(如 Ni(CO)4 中的 Ni0)是软酸。下图显示了周期表中酸(左)和碱(右)的硬/软趋势。对于碱而言,主要的硬/软不连续性出现在第二行(N、O、F)和下面的行之间。


相似相吸
硬酸与硬碱的相互作用比与软碱的相互作用更强,而软酸与软碱的相互作用比与硬碱的相互作用更强。因此,最稳定的配合物是那些具有硬硬和软软相互作用的配合物。下表说明了这种趋势,该表显示了硬酸和软酸的形成常数的趋势。硬酸以 F- > Cl- > Br- > I- 的顺序结合卤化物,而软酸则遵循相反的趋势。
Log K1 |
氟化物 |
氯化物 |
溴化物 |
碘化物 |
酸分类
|
|---|---|---|---|---|---|
Fe3+ |
6.0 |
1.4 |
0.5 |
- |
硬
|
Pb2+ |
1.3 |
0.9 |
1.1 |
1.3 |
中间
|
Ag+ |
0.4 |
3.3 |
4.7 |
6.6 |
软
|
Hg2+ |
1.0 |
6.7 |
8.9 |
12.9 |
软
|

元素周期表中最软的金属离子是 Au+(aq)。它与软碱(如膦和 CN-)形成稳定的配合物,但与硬碱(如 O2- 或 F-)不形成。Au+ 对软碱 CN- 的亲和力很高,形成的 [Au(CN)2]- 配合物非常稳定,以至于金(通常很难氧化)可以被空气中的氧气氧化
- 4 Au(s) + 8 CN-(aq) + O2(g) + 2 H2O ⇌ 4 [Au(CN)2]-(aq) + 4 OH-
该反应用于金矿开采,以从大量的沙子和其它氧化物中分离出少量的金片。Ag 在氰化物溶液中同样被空气氧化而溶解。然后,使用化学还原剂或电镀从溶液中分离出贵金属。然而,在采矿中大规模使用氰化物离子会造成潜在的严重环境危害。2000 年,罗马尼亚拜亚马雷发生一起泄漏事件,导致了自切尔诺贝利以来欧洲最严重的环境灾难。氰化物剧毒,逐渐被空气氧化成毒性较低的氰酸根(OCN-)离子。在实验室规模上,氰化物电镀溶液通常通过使用漂白剂将 CN- 氧化成 OCN- 来处理,金属以不溶性氯化物盐的形式回收。
Au3+ 离子由于其较高的正电荷,比 Au+ 是更硬的酸,可以与硬碱(如 H2O 和胺)形成配合物。符合“相似相吸”原理,化合物 AuI(软软)是稳定的,但 AuI3(硬软)是未知的。相反,AuF 从未被分离出来,但 AuF3(硬硬)是稳定的。
3.3 静电-共价 (ECW) 酸碱反应模型
[edit | edit source]将路易斯酸和碱分类为硬和软是一种有用的定性方法来解释其行为。ECW 模型是一个更定量的模型,它描述和预测路易斯酸-路易斯碱相互作用的强度。酸碱相互作用的强度用加合物形成的焓变 △H 来衡量。每种酸都以 EA 和 CA 为特征。每种碱也以其自己的 EB 和 CB 为特征。E 和 C 参数分别指酸和碱将形成的键的强度中的静电和共价贡献。这些参数是通过使用加合物的焓值经验获得的,这些加合物仅在酸和碱之间形成 σ 键,以及酸和碱之间没有空间位阻的加合物。
-△H = EAEB + CACB + W
该方程再现并预测了许多酸和碱之间反应的焓变 △H。△H 是衡量酸和碱之间键强度的指标,无论是在气相中还是在弱溶剂化介质中。W 项代表酸或碱二聚体断裂的恒定能量。例如,[Rh(CO)2Cl]2 被碱 B 裂解的焓变涉及两个步骤。第一步是二聚体的断裂,这是 W
½ [Rh(CO)2Cl]2 → Rh(CO)2Cl W = 43.5 kJ/mol
第二步是 B 与 RhCl(CO)2 单体结合。在另一种情况下,W 是裂解氢键酸 (CF3)3COH 的内部氢键所需的焓变。
吡啶 C5H5N 和双(六氟乙酰丙酮)铜 (II) Cu(HFacac)2 反应的加合物形成焓变的计算表明了这些参数是如何使用的。在这种情况下,W = 0,因为酸和碱都不是二聚体。可以在 ECW 模型的维基百科页面中找到选定的参数。
-△H = EAEB + CACB = (1.82)(1.78) + ( 2.86)(3.54) = 13.4 kcal/mol = -56.1 kJ/mol
△H = -56.1 kJ/mol, △Hmeasured = -56.1 kJ/mol.
然而,计算的 Me3B 与 Me3N 反应的 ᐃH 比观察到的更负。这种差异归因于 B 和 N 原子上甲基之间的空间位阻。计算值和观察值之间的差异可以被视为空间效应的量,这是其他方法无法获得的值。空间效应也已经在 (CH3)3SnCl 和 Cu(HFacac)2 中被发现。当 π 键合对测量的焓值有贡献时,根据 E 和 C 参数计算的焓值将小于测量的焓值,而差异提供了 π 键合贡献程度的量度。
该模型的图形表示清楚地表明,不存在路易斯酸或路易斯碱强度的单一排序顺序,这一点经常被忽视,并强调酸碱相互作用的大小需要两个参数(E & C)来解释相互作用。使用三种路易斯碱:乙腈、氨和二甲基硫醚的克莱默-博普图[7]说明不存在路易斯碱强度的唯一排序。克莱默-博普图是一种直观的工具,用于比较路易斯碱强度和可能的路易斯酸伙伴的范围,类似的图可以用来检查选定的路易斯酸与可能的路易斯碱的范围。这些图表明,需要两个属性来完全定义酸和碱的强度,任何试图用一个属性或参数来定义强度的尝试在实用性上都是有限的。对于德拉戈的定量 ECW 模型,这两个属性是静电和共价,而对于皮尔逊的定性 HSAB 理论,这两个属性是硬度和强度。
3.4 受挫的路易斯对
[edit | edit source]受挫的路易斯对 (FLP) 是一种化合物或混合物,它包含一个路易斯酸和一个路易斯碱,由于空间位阻,它们不能结合形成经典的加合物。 [8] 已经设计出了许多种 FLP,并且它们对其他分子的反应性得到了广泛的开发。 [9] [10]
最初的 FLP 的氢加合物,一种膦鎓-硼酸盐,可以通过将亚苯基桥联的膦硼烷和氢气结合制备。该盐是无色的,在空气和水分的存在下是稳定的。当加热到 100 °C 以上时,它会释放出分子 H2。考虑到 H-H 键的强度为 432 kJ/mol,这种反应性是相当显著的。
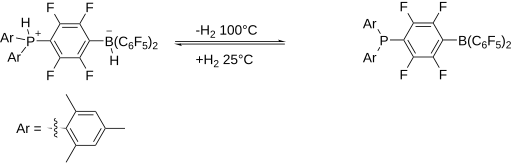
一些 FLP 可以裂解 H2 的发现 [11] 引发了对 FLP 研究的快速发展。由于它们的“未淬灭”反应性,这类体系对可以发生异裂的底物具有反应性。例如,许多 FLP 会裂解氢分子。这种反应性表明 FLP 可以用于氢化反应。现在已经开发出使用 FLP 的一系列均相和非均相催化反应。
空间位阻的路易斯酸和碱的混合物也可以作为 FLP。一种成功的策略是将空间位阻的三芳基膦与三芳基硼烷混合。然后,像 CO2 和乙烯这样的小分子可以在膦路易斯碱和硼烷路易斯酸之间形成桥,例如:
- P(t-Bu)3 + B(C6F5)3 + CO2 → (t-Bu)3P+C(O)OB−(C6F5)3
- PCy3 + B(C6F5)3 + C2H4 → Cy3P+CH2CH2B−(C6F5)3
由于 FLP 同时表现出亲核试剂和亲电试剂的特性,它们可以实现环状醚(如 THF、2,5-二氢呋喃、香豆素和二恶烷)的开环。 [12]
3.5 讨论问题
[edit | edit source]- 讨论金属离子路易斯酸性的周期性变化趋势。
- 用具体的例子解释我们所说的硬酸和软酸以及硬碱和软碱。
- 解释为什么硬和软不应该等同于静电和共价。
- 根据 HSAB 理论,Cu 和 Zn 被归类为中等酸,而 Cd 被归类为软酸。碱 (CH2)4O 被认为是硬碱,而 (CH2)4S 是软碱。使用 Cd[N(Si(CH3)3)2] 和 ZnTPP 的 E 和 C 值计算这两种酸与 (CH2)4O 和 (CH2)4S 相互作用的焓值,并证明 HSAB 模型正确地预测了哪种碱与哪种酸的相互作用更强。使用 Cu(HFacac)2 作为酸进行相同的比较,并证明 HSAB 无法预测哪种碱的相互作用更强。这些结果如何与 Cramer-Bopp 图相关联,该图表明不能使用单一性质或参数来对路易斯酸或碱强度进行排名?
1. 将以下每种物质分类为酸或碱,以及强或弱,或在所列溶剂中作为旁观者。对于每种情况,写出解离反应。
(a) 水中的 H3PO4
(b) 冰醋酸中的 HBr
(c) 液氨中的 CH3CH2COOH
(d) 熔融 KOH 中的 H2O
(e) 液氨中的 I-
2. 写出酸 HA 及其共轭碱 A- 在水中的解离反应。使用 Ka 和 Kb 的平衡表达式证明 KaKb = Kw。
3. 计算水中 1 M 醋酸 (Ka = 1.8 x 10-5) 的电离百分比。
4. 对于以下每对化合物,指出哪一个是更强的酸,并解释你的选择
(a) [Co(H2O)6]3+ 或 [Co(H2O)6]2+
(b) H3BO3 或 H3AsO3
(c) [In(H2O)6]3+ 或 [Ga(H2O)6]3+
(d) HClO3 或 HClO4
(e) H3PO4 或 HMnO4
5. Al3+ 和 Co3+ 阳离子具有相似的离子半径,但含有这两种离子的水性硝酸盐溶液的酸度不同。解释哪种离子更酸性以及原因。
6. 氟的电负性比氧强,但过渡金属的最高氧化态通常存在于氧化物中。例如,锰金属与氟反应生成 MnF3,但 Mn 的更高氧化态在其二元氟化物中不存在。然而,Mn(IV) 在氧化物(如 MnO2 和 CaMnO3)以及氟化物盐(如 K2MnF6)中是稳定的。解释为什么这些化合物可以比二元氟化物稳定更高的锰氧化态。
7. (a) 当 As3+、Sb3+ 和 Sn4+ 的氢硫化物 (SH-) 盐的溶液与水性硫化氢铵 (NH4+SH-) 溶液反应时,硫化物盐 As2S3、Sb2S3 和 SnS2 会沉淀出来。然而,当加入过量的 Na2S 水溶液时,这些硫化物会重新溶解形成可溶的阴离子配合物。相反,Cu2+、Pb2+、Hg2+、Bi3+ 和 Cd2+ 的溶液会以固体硫化物的形式沉淀出来,但在含有过量硫化物的溶液中不会重新溶解。我们可以认为第一组离子对于涉及 SH- 而不是 OH- 的软酸碱反应是两性的。第二组更碱性(酸性更弱),因为它不会与过量的软碱反应。使用这些信息在周期表中找到硫化物的两性对角线。将此与定义了两性氧化物的对角线进行比较,这些氧化物溶解在酸性或碱性溶液中。你的分析是否与 S2- 比 O2- 更软碱的描述一致?
(b) Au+ 也会被 SH- 离子沉淀,硫化物 Au2S 会重新溶解并在过量的 SH- 中形成可溶的配合物。这是否符合你在 (a) 部分中发现的趋势?从金的电负性来看,这是否合理?解释。
8. 计算加合物 (CH3)3B-N(CH3)3 的焓值,并将其与测得的 -73.6 kJ/mol 值进行比较。参数可以在 ECW 模型 中找到。
9. 计算路易斯酸 (CH3)3SnCl 与以下每种路易斯碱形成加合物的焓值: (C2H5)2O、(CH2)4O 和 CH3CN。它们各自的测量焓值为 -9.2、-21.3 和 -20.1 kJ/mol。解释计算焓值和测量焓值之间的任何差异。参数可以在 ECW 模型 中找到。
10. 参考 ECW 模型 中的 Cramer-Bopp 图,并指示以下路易斯碱强度的递增顺序
(a) 酸,其 Ra = -0.5
(b) 酸,其 Ra = 0.33
(c) 酸,其 Ra = -0.9
11. 路易斯酸 [Rh(CO)2Cl]2 的 W 值为 -43.47 kJ/mol。在 ECW 模型 中找到的 E、C 和 W 参数给出了与碱 B 形成一摩尔加合物的焓值,即 B + 1/2 [Rh(CO)2Cl]2 → B-RhCl(CO)2
(a) W 代表什么?
(b) 一摩尔 [Rh(CO)2Cl]2 的解离热是多少?
(c) 2B + [Rh(CO)2Cl]2 → 2 B-RhCl(CO)2 的焓值是多少?
(d) 当 B = C5H5N 和 B = (CH3)2CO 时,每摩尔 B-RhCl(CO)2 的焓值是多少?
12. 当铝腐蚀时,会在其表面形成固体 Al2O3,但当银变黑时,会在其表面形成固体 Ag2S。解释为什么会这样。
13. 鉴于以下反应,解释反应在平衡时是否有利于反应物或产物。简要解释你的推理。
[Fe(CO)6]Cl3 (aq) + 6 NH3(g) ⇌ [Fe(NH3)6]Cl3(aq) + 6 CO(g)
[Pd(CN)4]2-(aq) + [Mn(CO3)4]2-(aq) ⇌ [Mn(CN)4]2+(aq) + [Pd(CO3)4]6-(aq)
14. 合理性地解释每对反应的形成常数差异。
(a) железо
Fe2+(aq) + 4 OH−(aq) → [Fe(OH)4]2−(aq)。 Kf = 1.00 × 1010
Fe3+(aq) + 4 OH−(aq) → [Fe(OH)4]−(aq)。 Kf = 2.51 × 1034
(b) 铜
Cu+(aq) + 4 CN−(aq) → [Cu(CN)4]3−(aq)。 Kf = 2.00 × 1030
Cu2+(aq) + 4 CN−(aq) → [Cu(CN)4]2−(aq)。 Kf = 1.00 × 1025
15. 描述以下对的溶解度差异。你如何预测这些溶解度模式?
(a) AgF(s) 可溶于水,而 AgI(s) 不溶于水。
(b) LiF(s) 不溶于水,而 LiI(s) 可溶。
- ↑ Hall NF, Conant JB (1927). "A Study of Superacid Solutions". Journal of the American Chemical Society. 49 (12): 3062–70. doi:10.1021/ja01411a010.
- ↑ George A. Olah, Schlosberg RH (1968). "Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H–SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH5+ and Related Hydrocarbon Ions. The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions". Journal of the American Chemical Society. 90 (10): 2726–7. doi:10.1021/ja01012a066.
- ↑ Herlem, Michel (1977). "Are reactions in superacid media due to protons or to powerful oxidising species such as SO3 or SbF5?". Pure & Applied Chemistry. 49: 107–113. doi:10.1351/pac197749010107.
- ↑ Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 - 463; DOI:10.1021/ar00156a004
- ↑ R. J. Cava 等人 (1988). “不含铜的 30K 附近超导性:Ba0.6K0.4BiO3 钙钛矿”. 自然. 332: 814–6. doi:10.1038/332814a0.
{{cite journal}}: 在“|author=” 中显式使用等人 (帮助) - ↑ Christe, Karl O. (1986). “元素氟的化学合成”. 无机化学 25 (21): 3721. doi:10.1021/ic00241a001.
- ↑ Cramer RE, Bopp TT (1977). “伟大的 E 和 C 图。路易斯酸和碱加合物形成焓的图形显示”. 化学教育杂志. 54 (10): 612–613. doi:10.1021/ed054p612.
- ↑ Stephan, D. W. (2008). “受挫路易斯对:新反应性和催化概念”. 有机生物分子化学. 6: 1535–1539. doi:10.1039/b802575b.
- ↑ Stephan, D. W.; Erker, G. (2010). “受挫路易斯对:无金属氢活化等”. 应用化学国际版. 49 (1): 46–76. doi:10.1002/anie.200903708. ISSN 1433-7851.
- ↑ Stephan, D. W.; Erker, G. (2017). “受挫路易斯对化学”. 英国皇家学会哲学汇刊A:数学、物理和工程科学. 英国皇家学会. 375 (2101): 20170239. Bibcode:2017RSPTA.37570239S. doi:10.1098/rsta.2017.0239. ISSN 1364-503X. PMC 5540845. PMID 28739971.
- ↑ Welch, G. C.; San Juan, R. R.; Masuda, J. D.; Stephan, D. W. (2006). “可逆的、无金属的氢活化”. 科学. 314 (5802): 1124–1126. Bibcode:2006Sci...314.1124W. doi:10.1126/science.1134230. ISSN 0036-8075. PMID 17110572.
- ↑ Birkmann, B. 等人 (2010). “受挫路易斯对和 THF、二恶烷和噻烷的开环”. 有机金属化学. 29: 5310–5319. doi:10.1021/om1003896.
{{cite journal}}: 在“|first1=” 中显式使用等人 (帮助)
