无机化学导论/离子化合物和共价化合物固体 - 结构

正如我们在第 6 章中关于金属和合金结构的讨论中提到的,材料的结构与其物理性质之间存在着密切的联系。当我们从基于球体堆积的简单金属结构“过渡”到更复杂的结构时,我们发现这一点仍然是正确的。在本章中,我们将尝试对无机固体(金属氧化物、卤化物、硫化物和相关化合物)的结构进行系统化,并根据电负性差异、硬软酸碱规则和其他周期性规律,制定一些关于哪些结构是可预期的规则。我们将看到,这些结构中的许多结构与我们在第 6 章中学习的球体堆积相关。
第 8 章的学习目标
- 用密堆积框架和八面体和四面体空隙的系统填充来描述许多晶体结构。
- 通过绘制截面图来表示晶体结构。
- 使用化学原理来解释为什么某些晶体结构对于某些化合物是稳定的,而对于其他化合物则不稳定,以及为什么某些结构和键合基序对于某些化合物比其他化合物更受欢迎。
- 根据离子性和周期性规律预测哪些晶体结构对于给定成分最有利。
- 根据晶体结构解释结构相关的性质,如铁电性和磁性有序。
- 了解层状和开放框架固体中的嵌入反应。
- 使用过渡金属化学中的论点(例如晶体场稳定化能)来预测正常尖晶石或反尖晶石的优先生成。
无机固体通常具有简单的晶体结构,其中一些结构被大量的离子化合物或共价化合物采用。最常见的结构的例子包括 NaCl、CsCl、NiAs、闪锌矿、纤锌矿、萤石、钙钛矿、金红石和尖晶石。我们将从下面所示的密堆积和非密堆积晶格系统地发展这些结构。一些层状结构,如 CdCl2 和 CdI2,可以看作是简单离子晶格的衍生物,其中一些原子“缺失”。
-
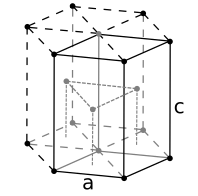
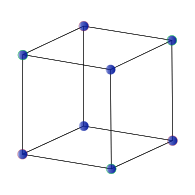
面心立方 (fcc) 或立方密堆积 (ccp)
-
六方密堆积 (hcp)
-
体心立方
-
简单立方

许多常见的无机晶体具有与立方密堆积(面心立方)或六方密堆积球体堆积相关的结构。这些堆积晶格包含两种类型的位点或“空隙”,间隙原子填充这些位点,这些位点的配位几何形状要么是四面体,要么是八面体。填充四面体空隙的间隙原子与四个堆积原子配位,而填充八面体空隙的原子与六个堆积原子配位。在六方密堆积和立方密堆积晶格中,每个堆积原子都有一个八面体空隙和两个四面体空隙。
问题:阴离子还是阳离子更适合作为堆积原子?
我们可以预期,阴离子(通常比阳离子大)更适合堆积原子的位置。虽然这通常是正确的,但也存在许多结构的例子,其中阳离子是堆积原子,还有一些结构的例子,其中这种区别是任意的。NaCl 结构就是后者的一个很好的例子。


在右侧所示的 NaCl 结构中,绿色球体是 Cl- 离子,灰色球体是 Na+ 离子。面心立方晶格中的八面体空隙可以在分数坐标 (1/2 1/2 1/2)、(1/2 0 0)、(0 1/2 0) 和 (0 0 1/2) 处找到。每个晶胞有四个这样的空隙,它们被氯离子填充。堆积原子 (Na+) 的坐标为 (0 0 0)、(0 1/2 1/2)、(1/2 1/2 0) 和 (1/2 0 1/2)。请注意,每个 Na+ 位置都与 Cl- 位置通过 (1/2 0 0) 的平移相关。另一种说法是,该结构由两个相互穿插的面心立方晶格组成,它们通过沿三个笛卡尔轴中的任何一个平移半个晶胞而相互关联。我们可以等效地将 Cl 离子放置在面心立方晶格点上,将 Na 离子放置在八面体空隙中,只需将晶胞的原点平移 (1/2 0 0) 即可。因此,在这种情况下,堆积原子和间隙原子之间的区别是任意的。
NaCl 的有趣之处在于它是一个三维棋盘,因此结构中不存在 NaCl “分子”。当该结构最初被解决(1913 年,使用 X 射线衍射)时,W. L. Bragg 的解释遭到了化学家的反对,化学家认为精确的整数化学计量比是分子中原子价的结果。德国化学家 P. Pfeiffer 在 1915 年指出,“普通的价概念似乎不适用”,十四年后,有影响力的化学家 H. E. Armstrong 仍然认为 Bragg 提出的氯化钠结构“对于常识来说过于令人反感,不符合化学规范”!然而,Bragg 和他的父亲 W. H. Bragg 坚持不懈,并使用当时新兴的 X 射线衍射技术确定了许多其他化合物的结构,包括金刚石、闪锌矿、氟化钙和其他碱金属卤化物。这些实验让化学家们第一次真正了解了固体的原子结构,并为 X 射线衍射实验奠定了基础,这些实验后来阐明了 DNA、蛋白质和许多其他化合物的结构。由于在 X 射线衍射方面的贡献,布拉格父子在 1915 年获得了诺贝尔物理学奖。
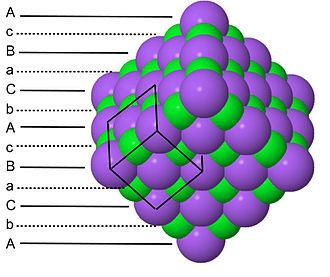
由于 NaCl 结构中每种类型的原子都形成一个面心立方晶格,因此每个 NaCl 晶胞有四个 Na 和四个 Cl 原子。正是由于这种比例,NaCl 的化学计量比为 1:1。NaCl 晶格中阴影绿色的双锥体结构和灰色的双锥体结构表明 Na+ 离子与六个 Cl- 离子配位,反之亦然。NaCl 结构可以作为密堆积层面的堆积来绘制,AcBaCbAcBa... 沿着晶胞的体对角线。这里,大写字母代表堆积原子,小写字母代表间隙原子。这种分层堆积在下图中说明
NaCl 结构
- ------------ A
- - - -c- - - -
- ------------ B
- - - -a- - - -
- ------------ C
- - - -b- - - -
- ------------ A
- - - -c- - - -
- ------------ B
- - - -a- - - -
- ------------ C
- - - -b- - - -
- ------------ A
请注意,堆积原子和间隙原子都按 A-B-C-A-B-C... 的顺序堆积,这与它们各自形成立方密堆积晶格这一事实相符。
NaCl 结构在离子化合物中相当常见
- 碱金属卤化物(除了 CsCl、CsBr 和 CsI)
- 过渡金属单氧化物(TiO、VO、...、NiO)
- 碱土金属氧化物和硫化物(MgO、CaO、BaS... 除了 BeO 和 MgTe)
- 碳化物和氮化物(TiC、TiN、ZrC、NbC)-这些是极其稳定的耐火间隙合金(金属性)
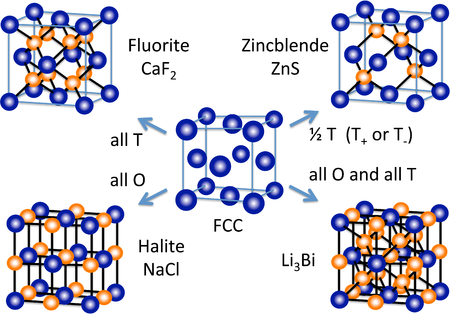
许多其他无机晶体结构(至少在概念上)是通过填充密堆积晶格中的八面体和/或四面体空隙形成的。右侧的图显示了一些最常见的结构(萤石、岩盐、闪锌矿)以及一种从面心立方晶格衍生而来的相当罕见的结构(Li3Bi)。从六方密堆积晶格,我们可以构建 NiAs 和纤锌矿结构,它们分别是 NaCl 和闪锌矿的六方类似物。

表示无机晶体结构的另一种非常方便的方法(尤其是像 Li3Bi 这样的复杂结构)是沿着晶胞轴之一绘制晶胞的截面。左侧显示了面心立方晶格和 NaCl 结构的这种表示方法。由于这些结构中的所有原子都具有 0 或 1/2 的 z 坐标,因此只需要绘制这些截面来描述晶胞的内容。绘制一些面心立方化合物结构(右上角)的截面是一个有益的练习。

有许多化合物具有与 NaCl 结构相似的结构,但具有比 NaCl 本身更低的对称性(通常是由阴离子的几何形状决定的)。这些化合物包括
- FeS2(黄铁矿,“愚人金”):S22-(二硫化物)和 Fe2+
- CaC2(盐状碳化物):Ca2+ 和线性 C22- 阴离子
- CaCO3(方解石、石灰石、大理石):Ca2+ 和三角形 CO32-。

右侧展示了方解石(CaCO3)的晶体结构。三角形的 CO32- 离子填充了扭曲的 NaCl 晶格中 Ca2+ 离子(黑色球体)之间的八面体空隙。与 NaCl 一样,每个离子都与六个其他种类的离子配位。从该图中我们可以看出,为什么 CaCO3 结构的对称性低于 NaCl。当球形的 Cl- 离子被三角形的 CO32- 离子取代时,NaCl 晶胞的四重旋转对称性就会消失。由于这种对称性降低,透明的方解石晶体是双折射的,如左侧所示。
NiAs 结构。NaCl 结构可以描述为一个面心立方晶格,其中所有八面体空隙都被填充。如果我们从一个六方密堆积晶格而不是面心立方晶格开始会怎么样呢?

这是NiAs 以及许多其他过渡金属硫化物、磷化物和砷化物采用的结构。右侧的图中,阳离子显示为灰色,阴离子显示为浅蓝色。阳离子处于八面体配位,因此每个阳离子都与六个阴离子配位。阴离子也与六个阳离子配位,但它们占据三角棱柱位置。在层堆积方面,NiAs 结构是 AcBcAcBc...,其中 A 和 B 位置(hcp 晶格)被 As 原子占据,而 c 位置(沿着层堆积轴重叠)被 Ni 占据。与 NaCl 结构不同,在 NaCl 结构中,阴离子和阳离子位置是可以互换的,NiAs 具有独特的阴离子和阳离子位置。NiAs 的层堆积序列如下所示
- ------------ A
- - - -c- - - -
- ------------ B
- - - -c- - - -
- ------------ A
- - - -c- - - -
- ------------ B
- - - -c- - - -
由于阳离子重叠,NiAs 结构不能被离子化合物采用,因为阳离子-阳离子斥力会使离子化合物内部不稳定。这种结构主要被共价和极性共价 MX 化合物采用,通常具有“软”X 阴离子(S、Se、P、As,....)和低价过渡金属阳离子。例如,一些具有 NiAs 结构的化合物有:MS、MSe、MTe(M=Ti、V、Fe、Co、Ni)。这些化合物通常是非化学计量或具有有序空位的复杂化学计量化合物(Cr7S8、Fe7S8)。
8.3 四面体结构
[edit | edit source]
在 ccp 和 hcp 晶格中,每个堆积原子有两个四面体空隙。M2X 或 MX2 的化学计量比会产生填充所有四面体位置的结构,而 MX 结构只填充一半的位置。MX2 结构的一个例子是萤石,CaF2,其结构如图左侧所示。萤石中的堆积原子是 Ca2+,结构由三个相互穿插的 fcc 晶格组成。需要注意的是,作为堆积原子的 Ca2+ 离子(灰色球体)违反了我们的“规则”,即阴离子大于阳离子,因此必须是堆积原子。萤石结构在离子 MX2(MgF2、ZrO2 等)和 M2X 化合物(Li2O)中很常见。相反,由于同电荷离子之间不利的紧密接触,萤石结构的 hcp 相对结构非常罕见。
在几何方面,Ca2+ 处于立方配位,与八个 F- 邻居相邻,氟离子被四个 Ca2+ 离子四面体配位。8:4 的配位几何与 1:2 的 Ca:F 化学计量比一致;在所有晶体结构中,配位数之比是化学计量比的倒数。三个相互穿插的 fcc 晶格的 Ca 在 0,0,0 , 1/2,1/2,0 , 等....F 在 1/4,1/4,1/4 , 3/4,3/4,1/4 , 等...和 F 在 3/4,3/4,3/4 , 1/4,1/4/3/4 , 等...
仔细观察萤石中的四面体位置,我们发现它们分为两个不同的组:T+ 和 T-。如果四面体朝上沿堆积轴指向一个顶点,则该位置为 T+。同样,顶点朝下指向的四面体是 T-。T+ 和 T- 位置的交替排列允许在结构中有效地堆积离子。这种结构的层堆积序列(包括 T+ 和 T- 位置的氟离子)是

- ------------ A
- - - -b- - - T+
- - - -a- - - T-
- ------------ B
- - - -c- - - T+
- - - -b- - - T-
- ------------ C
- - - -a- - - T+
- - - -c- - - T-
- ------------ A
- - - -b- - - T+
- - - -a- - - T-
具有 1:1 化学计量比(MX 化合物)的四面体键合化合物仅填充一半的四面体位置(T+ 或 T- 位置)。在这种情况下,M 和 X 原子都处于四面体配位。闪锌矿和纤锌矿结构分别是基于 fcc 和 hcp 晶格的 1:1 四面体结构。这两种结构都受到遵循八隅体规则的 p 区化合物青睐,这些化合物通常是半导体或绝缘体。闪锌矿结构,如下图所示,可以认为是两个相互穿插的 fcc 晶格,一个是阴离子,一个是阳离子,彼此偏移 1/4 个晶胞体对角线的距离。具有闪锌矿结构的化合物例子包括 CuCl、CuI、ZnSe、HgS、BeS、CdTe、AlP、GaP、SnSb、CSi 和金刚石。此外,化合物 CuInSe2 在一个有序的、加倍的晶胞中是闪锌矿(黄铜矿结构)。具有这种结构的固溶体化合物 CuIn1-xGaxSe2 是最广泛研究的高效薄膜光伏电池材料。以 ZnS 为闪锌矿的代表,Zn 和 S 原子的配位都是四面体。层序列 AbBcCaAbBcC...,导致形成与环己烷的“椅式”构型几何形状相同的六元 ZnS 环。椅式构型允许环中相对原子之间的距离相对较长,因此它比船式构型在空间上更有利。闪锌矿中紧密堆积层的序列,只填充 T+ 位置,而 T- 位置留空,如下所示

- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
- - - -c- - - T+
- - - - - - - T-
- ------------ C
- - - -a- - - T+
- - - - - - - T-
纤锌矿结构是闪锌矿的近亲,基于填充 hcp 晶格中一半的四面体空隙。与闪锌矿一样,纤锌矿包含在椅式构型中融合的六元环平面。然而,与闪锌矿不同的是,连接这些平面的环包含六元“船式”环。船式结构将阴离子排列成直接位于结构中的阳离子之上,这在空间上不利,但在静电方面更有利。因此,纤锌矿结构往往比闪锌矿结构更利于极性或离子化合物(例如 ZnO、NH4+F-)。与闪锌矿一样,两种离子都处于四面体(4:4)配位,并且 MX 化合物中通常有八个价电子。具有这种结构的化合物例子包括:BeO、ZnO、MnS、CdSe、MgTe、AlN 和 NH4F。纤锌矿的分层结构是 AbBaAbB,填充 T+ 位置的层序列如下图所示

- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
- - - -a- - - T+
- - - - - - - T-
- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
纤锌矿结构中层堆积的一个有趣结果是晶体是极性的。当沿着 c 轴(堆积轴)劈开时,ZnO、ZnS 和 GaN 的晶体会呈现一个带负电荷的面和一个带相反正电荷的面。施加的电场会与晶体偶极矩相互作用,导致晶格沿着该方向压缩或拉伸。因此,纤锌矿结构化合物的晶体通常是压电的。
有些化合物是二形的,可以是闪锌矿结构或纤锌矿结构。具有中间极性的化合物例子包括 CdS 和 ZnS。SiO2 存在于多晶型物(方石英和鳞石英)中,这些多晶型物类似于闪锌矿和纤锌矿,其中 O 原子位于每个 Si 原子之间的中间位置。闪锌矿和纤锌矿结构对四面体键合网络具有有效的堆积排列,并且在具有四面体键合的化合物中很常见。例如,水具有四面体氢键网络,并且是纤锌矿类型的。未扭曲的纤锌矿和闪锌矿结构通常存在于具有八个价电子的 AX 化合物中,这些化合物遵循八隅体规则。具有九个或十个电子的 AX 化合物,如 GaSe 和 SbAs,在纤锌矿结构的扭曲变体中结晶。在 GaSe 中,额外的电子形成孤对电子,这会在结构中形成层,如以下图所示。在 GaSe 的右侧,As、Sb 和 SbAs 的结构显示了随着价电子增加而结构逐渐分解成层的现象。
-
纤锌矿晶体结构
-
GaSe 晶体结构
-
Sb、SbAs 和灰色 As 的晶体结构
-
六方冰的晶体结构
六方冰是在 1 个大气压下冷冻时获得的冰的最稳定多晶型物。这种多晶型物(冰-I)具有 hcp 纤锌矿型结构。观察右侧的结构,我们发现 O-H---O 键的排列不规则。在结构中,氢键强制每个水分子的四面体配位,导致相对开放的结构,其密度低于液态水。因此,冰漂浮在水面上。
8.4 层状结构和插层反应
[edit | edit source]层状结构的特点是在二维方向上原子之间具有强(通常是共价)键合,而在第三维方向上具有较弱的键合。广泛的化合物,包括金属卤化物、氧化物、硫化物、硒化物、硼化物、氮化物、碳化物和一些纯元素(B、C、P、As)的同素异形体以层状形式存在。从结构上讲,这些结构中最简单的结构(例如二元金属卤化物和硫化物)可以描述为在 fcc 和 hcp 晶格中填充了一部分八面体和/或四面体位置。例如,CdCl2 结构是通过填充 fcc 晶格中交替层的所有八面体位置形成的,而 CdI2 结构是该结构在 hcp 晶格中的相对结构。


在CdCl2 结构中,阴离子层的堆积序列是 ABCABC...
在CdI2 结构中,阴离子堆积序列是 ABAB...,所有阳离子沿着堆积轴重叠。
这些是6-3 结构的例子,因为阳离子被六个阴离子的八面体配位,而阴离子被三个阳离子配位形成三角锥体(如 NH3)。另一种描述这些结构的方法是说 MX6 八面体在 MX2 层中共享六个边。
由于这些结构将堆积原子(阴离子)置于直接范德华接触,因此它们对于相对共价的化合物最稳定。否则,接触阴离子之间的静电排斥会在能量上使结构不稳定。更具离子性的 MX2 化合物倾向于采用萤石 (CaF2) 或金红石 (TiO2) 结构,这些结构不是层状的。
尽管这两种结构类型在最近邻和次近邻离子水平上相同,但 CdI2 结构比 CdCl2 结构常见得多。
CdCl2 结构
- MCl2 (M = Mg, Mn, Fe, Co, Ni, Zn, Cd)
- NiBr2, NiI2, ZnBr2, ZnI2
CdI2 结构
- MCl2 (M = Ti, V)
- MBr2 (M = Mg, Fe, Co, Cd)
- MI2 (M = Mg, Ca, Ti, V, Mn, Fe, Co, Cd, Ge, Pb, Th)
- M(OH)2 (M = Mg, Ca, Mn, Fe, Co, Ni, Cd)
- MS2 (M = Ti, Zr, Sn, Ta, Pt)
- MSe2 (M = Ti, Zr, Sn, V, Pt)
- MTe2 (M = Ti, Co, Ni, Rh, Pd, Pt)
从物理上讲,层状化合物是软且滑的,因为层平面很容易相互滑动。例如,石墨、MoS2 和滑石(一种硅酸盐)是层状化合物,被广泛用作润滑剂和润滑剂添加剂。
层状化合物的一个重要反应是插层。在插层反应中,客体分子和离子进入分离层的层间,通常会使沿堆积轴的晶格膨胀。如果该反应不扰乱层内的键合,则通常是可逆的。通常,插层的驱动力是氧化还原反应,即主体和客体之间的电子转移。例如,锂金属与 TiS2、MoS2 和石墨反应生成 LiTiS2、LixMoS2 (x < 1) 和 LiC6。在这些化合物中,锂被电离成 Li+,层带负电。氧化剂如 Br2、FeCl3 和 AsF5 也与石墨反应。在所得的插层化合物中,层带正电,插层物质为阴离子。

插层反应对于二次电池中的电化学储能尤其重要,例如 锂离子电池、镍氢电池 和 镍镉电池。插层反应的可逆性使电极能够充电和放电数千次,而不会失去其机械完整性。在锂离子电池中,负极材料通常是石墨,它被锂插层形成 LiC6。几种不同的氧化物和磷酸盐,包含氧化还原活性过渡金属离子(Mn、Fe、Co、Ni),被用作正极材料。

基于 CoO2 的锂离子电池首次在 1980 年[1] 由当时在牛津大学工作的 约翰·B·古迪纳夫 研究小组描述。在基于 CoO2 的电池中,CoO2 具有 CdI2 结构,正极半反应为
负极半反应为
当正极处于 CoO2 形式,负极处于 LiC6 形式时,电池充满电。放电涉及 Li+ 离子通过电解质的运动,在两个电极上形成 LixCoO2 和石墨。

锂离子电池是一种“摇椅”电池,之所以这样命名是因为充放电涉及将 Li+ 离子从一侧移动到另一侧。虽然早期的锂离子电池包含层状金属硫化物,如 TiS2,但金属氧化物提供了更高的工作电压和更稳定的电池。CoO2 是在锂离子电池中使用的正极材料的一个例子。它具有高能量密度,但基于 CoO2 的电池热稳定性差。更安全的材料包括磷酸铁锂 (LiFePO4) 和 LiMO2 (M = Co、Mn 和 Ni 的混合物)。负极材料 LiC6 在电化学系列中具有接近锂金属的电位。锂金属电极提供的能量密度比 LiC6 高得多,但锂金属电池由于安全性和循环寿命问题尚未投入商业使用。[4] 可充电锂离子电池广泛应用于笔记本电脑、便携式电子设备、手机、无线工具以及电动和混合动力汽车。约翰·古迪纳夫(德克萨斯大学)与 M·斯坦利·惠廷汉(宾汉姆顿大学)和 吉野彰(旭化成)因其在锂离子电池基础研究方面做出的贡献共同获得了 2019 年诺贝尔化学奖。
镍镉电池和镍氢电池中也发生类似的插层反应,只是在这种情况下,反应涉及质子进出具有 CdI2 结构的 Ni(OH)2 晶格
有许多层状化合物不能通过氧化还原反应进行插层,通常是因为形成了其他稳定的产物。例如,层状 CdI2 与 Li 反应生成 LiI(NaCl 结构)和 Cd 金属。
8.5 TiS2、MoS2 和黄铁矿结构中的键合
[edit | edit source]许多层状二硫化物,如 TiS2 和 ZrS2,具有 CdI2 结构。在这些化合物中,正如我们在上面提到的,金属离子被 S 八面体配位。有趣的是,MoS2 和 WS2 的结构,虽然也是层状的,但不同。在这些情况下,金属被硫原子的三角棱柱包围。NbS2、TaS2、MoSe2、MoTe2 和 WSe2 也具有三角棱柱状辉钼矿结构,该结构在下方显示,旁边是一个 MoS2 的片状晶体。

金属离子被硫族元素离子的三角棱柱配位,相对于八面体配位来说是空间上不利的。硫族元素离子之间存在紧密接触,这些离子在堆积顺序AbA/BaB/AbA/BaB...(其中“/”表示层之间的范德华间隙)中重叠。是什么稳定了这种结构?
辉钼矿结构最常见于具有d1 或 d2 电子数的 MX2 化合物。下图比较了八面体和三角棱柱配位环境中 d 轨道能级的分裂。

MoS2 中的三角棱柱结构通过填充最低能量带 dz2 来稳定。dz2 轨道垂直穿过三角棱柱的三角形顶面和底面,与硫化物配体相互作用最少,因此能量最低。dxz 和 dyz 轨道指向配体,具有最高的能量。在这个结构中,dz2 轨道的能量比 TiS2 八面体结构中的 t2g 轨道能量低。
PtS2 与 TiS2 一样,采用八面体 CdI2 结构。在这种情况下,由于 Pt4+ 具有六个 d 电子,t2g 轨道被填充。由于 S2- 是强场配体,因此存在较大的晶体场稳定能(稳定 Pt 的高氧化态)。与 MoS2 一样,PtS2 是半导体,因为在填充的 t2g 带和空的 eg 带之间存在能隙。
由于 TiS2 具有未填充的 t2g 带,因此很容易通过与 Li 嵌入来还原。因此,LiTiS2 是最早由 Stanley Whittingham 研究的嵌入化合物之一,他在 1970 年代初提出了非水锂离子电池的概念。[5] 由于 MoS2 具有填充的 dz2 带,因此更难还原,但它可以通过与强还原剂正丁基锂反应嵌入,形成 LixMoS2(x < 1)。这些化合物范德华平面的原子相对不活泼,这赋予 MoS2 良好的氧化稳定性,并使其能够用作高温润滑剂。然而,晶体边缘的原子更活泼,实际上具有催化活性。高表面积 MoS2 具有高密度的暴露边缘平面,用作加氢脱硫催化剂,并且作为将水还原为氢气的电催化剂越来越受到关注。

层状金属二硫化物,包括 MoS2、WS2 和 SnS2,可以形成闭合的纳米结构,形状为多层洋葱和多层管。这些材料是由 Reshef Tenne 小组在 1992 年发现的,紧随碳纳米管的发现。从那时起,许多其他材料已经合成了纳米管,包括钒和锰氧化物。
虽然早期的(TiS2)和后期的(PtS2)过渡金属二硫化物具有层状结构,但过渡系中间的一些 MS2 化合物,如 MnS2、FeS2 和 RuS2,具有三维键合结构。例如,FeS2 具有 **黄铁矿结构**,它与 NaCl 结构相关。原因是 FeS2 不是 Fe4+(S2-)2,而是实际上是 Fe2+(S22-),其中 S22- 是二硫化物阴离子(它与过氧化物阴离子 O22- 一样包含一个单键)。S2- 作为强还原剂,不能与强氧化剂 Fe4+ 存在于同一化合物中。因为 FeS2 实际上是 Fe2+(S22-),所以它是一个 1:1 化合物,并采用 1:1 结构。
8.6 尖晶石、钙钛矿和金红石结构
[edit | edit source]还有三种结构,它们源自密堆积晶格,由于其化合物的材料特性而特别重要。它们是 **尖晶石** 结构,铁氧体和其他磁性氧化物基于该结构;**钙钛矿** 结构,铁电和超导氧化物采用该结构;**金红石** 结构,这是氧化物和氟化物采用的常见二元 6:3 结构。
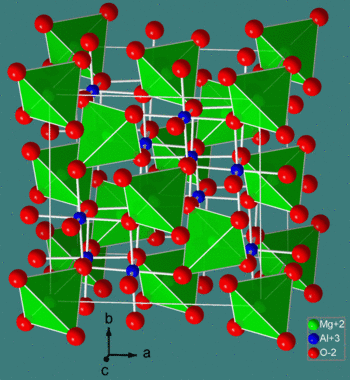
**尖晶石结构** 的化学式为 MM'2X4,其中 M 和 M' 分别是四面体配位和八面体配位的阳离子,X 是阴离子(通常是 O 或 F)。该结构以矿物 MgAl2O4 命名,氧化物尖晶石的通式为 AB2O4。
在 **正尖晶石** 结构中,存在一个密堆积的阴离子阵列。A 位阳离子填充 1/8 的四面体空隙,B 位阳离子填充 1/2 的八面体空隙。正尖晶石晶胞的多面体视图显示在左侧,简化的视图(为了清晰起见,去除了晶胞后半部分的内容)显示在上面。每个晶胞包含八个化学式单位,其组成是 A8B16O32。
**逆尖晶石** 具有密切相关的结构(具有相同的较大晶胞),其中 A 位离子与一半 B 位离子交换位置。因此,逆尖晶石的化学式为 B(AB)O4,其中括号内的 AB 离子占据八面体位置,其他 B 离子位于四面体位置。还有混合尖晶石,它们介于 **正** 和 **逆** 尖晶石结构之间。
一些尖晶石和逆尖晶石 AB 组合是
- A2+B3+,例如 MgAl2O4(正尖晶石)
- A4+B2+,例如 Pb3O4 = PbII(PbIIPbIV)O4(逆尖晶石)
- A6+B+,例如 Na2WO4(正尖晶石)
许多磁性氧化物,如 Fe3O4 和 CoFe2O4,是尖晶石。
**正与逆尖晶石结构。** 对于过渡金属氧化物尖晶石,正与逆尖晶石结构的选择主要由离子在四面体和八面体位置上的 **晶体场稳定能** (CFSE) 决定。对于包含 3d 元素(如 Cr、Mn、Fe、Co 和 Ni)的尖晶石,电子构型通常是 **高自旋**,因为 O2- 是 **弱场配体**。
例如,我们可以考虑磁铁矿 Fe3O4。该化合物每个化学式单位包含一个 Fe2+ 和两个 Fe3+ 离子,因此我们可以将其表示为正尖晶石 Fe2+(Fe3+)2O4,或逆尖晶石 Fe3+(Fe2+Fe3+)O4。哪一个能量最低?

首先,我们考虑 **Fe2+** 离子的晶体场能,它为 d6。比较四面体和高自旋八面体图,我们发现 O2- 离子在 **八面体** 场中的 CFSE 为 [(4)(2/5) - (2)(3/5)]Δo - P = **0.4 Δo - P**。在 **四面体** 场中,CFSE 为 [(3)(3/5) - (3)(2/5)]Δt - P = **0.6 Δt - P**。由于 Δo 大约是 Δt 的 2.25 倍,因此八面体排列具有更大的 CFSE,是 Fe2+ 的优选排列。

相反,很容易证明 **Fe3+**(即 d5)在八面体或四面体几何结构中都具有零 CFSE。这意味着 Fe2+ 倾向于占据八面体位置,而 Fe3+ 没有偏好。因此,我们将 Fe2+ 放在八面体位置,**Fe3O4 是一个** **逆尖晶石**,Fe3+(Fe2+Fe3+)O4。
**铁氧体** 是通式为 **MIIFe2O4** 的化合物。我们可以看到磁铁矿是铁氧体的一个例子(其中 M = Fe)。其他二价金属(M = Mg、Mn、Co、Ni、Zn)也形成铁氧体。铁氧体可以是正尖晶石、逆尖晶石或混合尖晶石,具体取决于 MII 离子的 CFSE。根据其 CFSE,Fe2+、Co2+ 和 Ni2+ 都对八面体位置有强烈的偏好,因此这些化合物都是逆尖晶石。ZnFe2O4 是一个正尖晶石,因为较小的 Zn2+ 离子 (d10) 比 Fe3+ (d5) 更容易适合四面体位置,并且两个离子都具有零 CFSE。MgFe2O4 和 MnFe2O4 中所有离子都具有零 CFSE,并且没有位置偏好,是混合尖晶石。**铬铁矿** 尖晶石 **MIICr2O4** 始终是 **正尖晶石**,因为 d3 Cr3+ 离子对八面体位置有强烈的偏好。
正和逆尖晶石结构的例子
- **MgAl2O4** 是一个 **正尖晶石**,因为 Mg2+ 和 Al3+ 都是非过渡金属离子,因此 CFSE = 0。电荷更高的 Al3+ 离子更倾向于占据八面体位置,在那里它被六个带负电荷的氧原子包围。
- **Mn3O4** 是一个 **正尖晶石**,因为 Mn2+ 离子是一个高自旋 d5 体系,CFSE 为零。两个 Mn3+ 离子是高自旋 d4,在八面体位置 (3/5 ΔO) 上具有比在四面体位置 (2/5 Δt ~ 1/5 ΔO) 上更高的 CFSE。
- **Fe3O4** 是一个 **逆尖晶石**,因为 Fe3+ 离子是一个高自旋 d5 体系,CFSE 为零。Fe2+ 是一个高自旋 d6 体系,在八面体位置上具有比在四面体位置上更高的 CFSE。
- **NiFe2O4** 再次是一个 **逆尖晶石**,因为 Ni2+(一个 d8 离子)倾向于占据八面体位置,而 Fe3+(一个 d5 离子)的 CFSE 为零。
- **FeCr2O4** 是一个 **正尖晶石**,因为 Fe2+ 是一个高自旋 d6 离子,CFSE = [4(2/5)-2(3/5)] ΔO = 2/5ΔO 在八面体位置上,而 Cr3+ 是一个 d3 离子,CFSE = 3(2/5) ΔO = 6/5 ΔO。因此,Cr3+ 占据两个八面体位置在能量上更有利。
- Co3O4 是一种正尖晶石。即使在弱场氧配体存在的情况下,Co3+ 也是一个低自旋 d6 离子,在八面体位置上具有非常高的晶体场稳定化能,这是由于 Co3+ 离子的高电荷和较小尺寸。因此,Co3+ 离子占据八面体位置,而 Co2+ 离子占据四面体位置。

铁氧体尖晶石的磁性。铁氧体尖晶石因其磁性有序而具有技术意义,根据结构(正或反)和金属离子的性质,磁性有序可以是亚铁磁性或反铁磁性。Fe3O4、CoFe2O4 和 NiFe2O4 都是反尖晶石,是亚铁磁体。后两种化合物分别用于磁记录介质和偏转磁体。
为了理解铁氧体的磁性,我们需要考虑金属离子在氧化物中的不成对自旋如何耦合。如果一个氧化物离子被两个金属离子共享,它可以通过超交换来介导自旋的耦合,如右图所示。耦合可以是反铁磁性的,如所示,也可以是铁磁性的,取决于参与的轨道填充和对称性。Goodenough-Kanamori 规则预测由过渡金属离子电子自旋超交换耦合产生的局部磁性排序(铁磁性 vs. 反铁磁性)。对于铁氧体,最强的耦合发生在相邻四面体和八面体位置的离子之间,这两个位置之间的自旋排序通常是反铁磁性的。

由于尖晶石或反尖晶石晶体中的所有四面体和八面体位置都以相同的方式耦合在一起,因此,四面体位置上的离子将全部具有一个方向(例如,自旋向下),而所有八面体位置上的离子将具有相反的方向(例如,自旋向上)。如果两个位置上的自旋数相同,则固体将是反铁磁性的。但是,如果自旋数不相等(如 Fe3O4、CoFe2O4 和 NiFe2O4 的情况),则固体将是亚铁磁性的。左侧的 Fe3O4 图示了这一点。Fe3+ 位置上的自旋相互抵消,因为其中一半向上,一半向下。但是,Fe2+ 离子上的四个不成对电子在晶体中都以相同的方式排列,因此该化合物是亚铁磁性的。

钙钛矿是三元氧化物,通式为ABO3。更一般地,钙钛矿公式为 ABX3,其中阴离子 X 可以是O、N 或卤素。A 离子通常是大型离子,如 Sr2+、Ba2+、Rb+ 或镧系 3+ 离子,而 B 离子是较小的过渡金属离子,如 Ti4+、Nb5+、Ru4+ 等。该结构以其命名为矿物的公式为 CaTiO3。
钙钛矿结构具有简单立方对称性,但与 fcc 晶格有关,因为 A 位置阳离子和 6 个 O 原子构成 fcc 晶格。B 位置阳离子填充 1/4 的八面体孔,并被 6 个氧化物阴离子包围。

钙钛矿中 A 离子的配位和 BO6 八面体的排列最好通过观察 ReO3 结构来理解,该结构与钙钛矿结构相同,只是 A 位置阳离子被移除。在右侧显示的结构的多面体表示中,可以看出八面体共享所有顶点,但没有共享任何八面体边。这使得 ReO3 和钙钛矿结构具有灵活性,就像三维的酒架一样,八面体可以协同旋转和倾斜。八个这样的八面体包围一个大的立方八面体空腔,它是钙钛矿结构中 A 离子的位置。这些位置中的阳离子被 12 个氧化物离子配位,正如钙钛矿和 fcc 晶格之间的关系所预期的那样。
由于 ReO3 结构中的 A 位置是空的,因此具有该结构的化合物可以通过小离子(如Li+ 或 H+)进行可逆嵌入,这些离子随后占据立方八面体空腔中的位置。例如,在强阳光下变暗的智能窗户包含电致变色材料 WO3,它具有 ReO3 结构。在阳光下,光伏电池驱动 WO3 的还原嵌入,反应如下:
WO3 是一种淡黄色的化合物,含有 d0 W(VI)。相反,HxWO3(混合价态 W(V)-W(VI) = d1-d0)呈深蓝色。这种颜色是混合价态过渡金属配合物的典型特征,因为它们的 d 电子可以通过红光激发到离域导带能级。由于电化学嵌入-脱嵌过程是由太阳能电池驱动的,因此窗户的色调可以根据阳光照射程度自动调整。

铁电钙钛矿。角共享 BO6 八面体网络的灵活性在具有钙钛矿结构的铁电氧化物中也非常重要。在一些 B 位置阳离子较小的钙钛矿中,如 Ti4+ 和 Nb5+,阳离子太小,无法对称地嵌入 BO6 八面体中。八面体会发生畸变,使阳离子偏离中心。这些畸变可以是四方(如右图所示),菱形或正交,具体取决于阳离子是朝 BO6 八面体的顶点、面或边移动。将阳离子从八面体的中心移开会产生电偶极子。在铁电材料中,这些偶极子通过八面体的协同旋转和倾斜在相邻的晶胞中排列。因此,晶体获得净电极化。
铁电性与铁磁性类似,只是极化是电性的而不是磁性的。在这两种情况下,都存在一个临界温度 (Tc),高于该温度晶体的自发极化会消失。低于 Tc,铁电体的电极化可以通过矫顽场切换,极化与场强之间的磁滞回线类似于铁磁体的磁滞回线。高于 Tc,晶体是顺电的,并且具有很高的介电常数。
铁电和顺电氧化物(以及压电和热电材料)在开关、致动器、传感器和电容器介电材料中具有广泛的应用。铁电电容器在存储器设备(FRAM)和手机的调谐电路中非常重要。多铁材料是指同时具有铁电性和铁磁性的材料,它们比较罕见,目前正被人们深入研究,因为它们在电可寻址磁存储方面具有潜在的应用价值。

卤化物钙钛矿(ABX3,X = Cl、Br、I)可以通过将一价 A 离子盐(A+ = Cs+、NH4+、RNH3+)和二价金属盐(如 PbCl2 或 PbI2)结合起来制备。这些化合物最近引起了人们的兴趣,作为薄膜太阳能电池中用于从阳光中产生电力的光吸收体。卤化铅和锡钙钛矿可以从溶液前驱体中或通过在相对较低的温度下热蒸发来制备薄膜。在一些卤化铅钙钛矿中,电子和空穴的迁移率非常高,与更昂贵的 III-V 族半导体(如 GaAs)相当,后者必须在高温下以非常纯净的单晶形式生长才能用于太阳能电池。由于其高载流子迁移率,一些卤化铅钙钛矿也是电致发光的,并且作为廉价的发光二极管 (LED) 材料引起了人们的兴趣。

卤化锡和铅钙钛矿最早是在 20 世纪 90 年代被研究作为薄膜电子学材料,[6] 后来被用作染料敏化太阳能电池中的光吸收体。在报道了染料敏化钙钛矿电池的结果后不久,人们发现卤化物钙钛矿也可以用于薄膜固态太阳能电池。这些太阳能电池的结构在右侧以示意图的形式显示。钙钛矿太阳能电池报道的最高太阳能转换效率已从 2009 年的 3.8%[7] 跃升至 2012 年的 10.2%[8],再到 2020 年的 25.5%(单结结构),[9] 以及在硅基串联电池中达到 29.15%,[9] 超过了单结硅太阳能电池所能达到的最高效率。因此,钙钛矿太阳能电池是发展速度最快的太阳能技术。由于具有实现更高效率和极低生产成本的潜力,钙钛矿太阳能电池已成为商业上的吸引力。迄今为止,性能最高的电池在钙钛矿 B 位置阳离子位置包含二价铅,并在钙钛矿 A 位置阳离子位置包含甲胺和甲脒离子的混合物。
尽管钙钛矿太阳能电池的效率非常高,但它们不如由硅或 GaAs 等共价网络固体制成的太阳能电池稳定,并且对空气和水分敏感。目前的研究重点是了解这些太阳能电池的降解机制,并在工作条件下提高其稳定性。


金红石结构是重要的MX2 (X = O, F)结构。它是一种6:3结构,其中阳离子被阴离子八面体配位,因此其极性介于CaF2 (8:4)和SiO2 (4:2)结构之间。金红石矿物是TiO2的多晶型之一,其他多晶型(锐钛矿和板钛矿)也是6:3结构。
金红石结构可以描述为NiAs结构的扭曲形式,其中一半的阳离子被移除。回想一下,具有NiAs结构的化合物通常是金属的,因为金属离子沿堆叠轴重叠,因此彼此相对靠近。在金红石中,MO6 八面体沿四方c轴共边,因此一些金红石氧化物,如NbO2,RuO2和IrO2,由于d轨道重叠沿该轴也是金属的。这些化合物作为电解槽催化剂和催化剂载体很重要,因为它们将高催化活性与良好的电子导电性结合在一起。
金红石TiO2由于其高折射率,是白色涂料的基础颜料。它是一种宽带隙半导体,在作为水分解太阳能电池的电极以及光催化剂(主要作为锐钛矿多晶型)降解空气和水中的污染物方面也得到了广泛的研究。 自清洁玻璃利用薄层TiO2的光催化性质去除玻璃表面的油性物质,并改善玻璃的润湿性能。
8.7 讨论问题
[edit | edit source]- 使用利物浦3D可视化网站 (http://www.chemtube3d.com/solidstate/_table.htm) 确定氯化镉和锐钛矿中阴离子和阳离子的配位几何形状。描述这些结构中八面体的排列(就它们是否共边、共面等而言)。
- 计算Li3Bi和ReO3晶胞中的原子数,并确定每个离子的配位环境。
- 硅、锗和许多其他半导体采用金刚石(或闪锌矿)结构。假设所有原子的大小相同,计算晶胞中被原子占据的体积分数。金刚石的填充分数与简单立方结构和密堆积结构相比如何,这告诉我们关于配位数和密度的关系什么?
- 描述钛酸钡的铁电性的结构基础。
8.8 问题
[edit | edit source]1. 对于以下每种密堆积层序列,指出结构名称(结构类型)、阳离子的配位环境(用小写字母表示)和阴离子的配位环境(用大写字母表示)。给出具有相同结构的两种额外示例(除结构类型本身之外)。
(a) AbBaAbBaAbB......
(b) AaBbCcAaBbCc.....
(c) AcBaCbAcBaCb.....
(d) AcB | AcB | AcB |.... ("|" = 范德华尔斯间隙)
2. 下面是氧化锂晶胞的部分。

(a) 描述如何获得(以及如何获得)经验式。
(b) 每种离子的配位数和几何形状是什么?
(c) 哪个原子是密堆积的?
(d) 另一种离子填充了哪种类型的空隙,以及填充了多少比例?
3. 金属氮化物的六方晶胞在部分中显示如下。

(a) 化合物的经验式是什么?
(b) 有多少个M原子与每个N原子配位?
(c) 您预计会在元素周期表的哪个族中找到M?
4. 绘制Li3Bi立方晶胞的部分。
5. 如果从CsCl结构中移除一半的铯,使得每个Cl原子随后四面体配位,会生成哪种结构类型?
6. 某种三元氧化物的晶体结构如下所示。

(a) 经验式是什么,晶胞中包含多少个式量单位?
(b) 哪些原子(如果有)是密堆积的?
(c) 结构中每个不同阳离子有多少个氧化离子配位?
(d) (c) 部分中的配位数是否不同?如果是,为什么?
7. 二硫化物(MS2)的结构显示出明显的异常趋势,从过渡系列的左侧到右侧。在左侧(TiS2,ZrS2,MoS2等),人们发现层状结构,而在中间(ReS2,FeS2,RuS2)则存在三维黄铁矿和白铁矿类型结构。在右侧(PtS2,SnS2),再次出现层状结构。简要解释这些趋势。
8. 解释为什么层状化合物通常是共价的,很少是离子性的。
9. 绘制闪锌矿结构的部分。
10. 闪锌矿结构很少与极性或离子性很强的化合物一起发现。然而,一些极性和离子性化合物(BeO,NH4F等)具有纤锌矿结构。
(a) 描述闪锌矿结构和纤锌矿结构之间的相似之处和不同之处(就配位数、阳离子和阴离子的堆积顺序等而言)(b) 为什么纤锌矿比闪锌矿更具离子性?
11. R. Cava及其同事最近发表的一篇文章(Nature Materials 2010, 9, 546-9)描述了一种Y-Pt-Bi合金的独特电子性质,其结构在部分中显示如下

(a) 化合物的化学计量比是多少?
(b) 每个Bi原子有多少个Y原子和多少个Pt原子配位?
12. 萤石结构,CaF2,它是由填充FCC阵列中的所有四面体空隙产生的,是一种常见的MX2结构类型。
(a) 在CaF2的假设近亲中,F的配位环境是什么,其中Ca形成hcp阵列,F占据所有四面体位?
(b) 建议一个原因,说明为什么(a)中描述的结构非常罕见。

13. 赤铜矿(Cu2O)结构与闪锌矿(或金刚石)相关,因为氧占据Zn和S的位置,铜位于两者之间。这在右侧的示意图中显示出来。实际上,在赤铜矿中,有两个这样的互穿网络,它们之间没有键。在空的单元格中绘制第二个网络。如果将两个部分放在一起并取出铜,您将获得哪种立方堆积晶格?它是最密堆积晶格吗?(提示 #1: 从1/2,1/2,1/2处的O原子开始)(提示 #2: 首先用铅笔尝试)
14. 绘制金红石结构的晶胞部分,并验证化学计量比为MX2。Ti和O的配位数是多少?
15. 陨石坑中发现了一种高压形式的SiO2,叫做板钛矿。虽然正常的SiO2具有石英结构,其中每个Si都与四个O原子配位,但板钛矿具有金红石结构。您预计Si-O键在板钛矿中更长,还是在石英中更长?每个多晶型中的键序是多少?
16. Na和Cl以1:1的比例结合形成离子NaCl晶格。有趣的是,最近的理论预测(通过高压合成和晶体学得到证实)已经确定了在高压下形成稳定晶体的几种其他化学计量比。这些包括Na3Cl,Na2Cl,Na3Cl2,NaCl3,以及其他几种。[10] 下面部分显示了其中一种新的氯化钠的结构。

- a) 该化合物的化学计量比是多少?
- b) Na和Cl的配位数是多少,以及它们与NaCl和Na金属中的配位数相比如何?
- c) 根据您对(b)的回答,解释为什么高压应该稳定这种相。
17. 在问题16中描述的研究中发现的新化合物之一是NaCl3。该化合物有两种多晶型,其中一种包含线性Cl3-离子。精确的分子轨道计算表明,这些线性阴离子中中心Cl原子的电荷接近于零。绘制与这些观察结果一致的Cl3-离子的MO图和价键图。您预计Cl-Cl键会比Cl2中的键更长还是更短?
18. 一些MX盐可以以CsCl或NaCl结构存在。使用Pauling公式预测具有NaCl结构中键长为3.5 Å的化合物的CsCl结构中的M-X键长。施加高压会使该化合物的CsCl形式稳定,还是使NaCl形式稳定?(提示:计算每个式量单位的体积)
19. Mn3O4和Fe3O4都是混合价态氧化物。在这两种情况下,每个式量单位(M = Fe,Mn)中有一个M2+离子,两个M3+离子。
- (a) 其中一个是正尖晶石,另一个是反尖晶石。解释哪个是哪个,以及为什么。(提示:考虑CFSE)
- (b) 对于Mn3O4,您会期望哪种类型的磁性排序(反铁磁性、铁磁性或亚铁磁性),以及为什么?您可以假设结构中相邻的四面体和八面体离子是反铁磁性耦合的。
- (c) 为Mn3O4绘制χ与T以及1/χ与T曲线的大致形式。在您的图表上标记任何特殊温度值。
20. 预测以下每种物质应该形成正尖晶石还是反尖晶石:MgV2O4,VMg2O4,NiGa2O4,ZnCr2S4,NiFe2O4。您会预测NiFe2O4会产生哪种类型的磁性排序(铁磁性、亚铁磁性或反铁磁性)?
21. 对于以下每对物质,哪种结构更受极性较弱的化合物青睐?
A. NaCl CsCl
B. 闪锌矿 纤锌矿
C. CdI2 CdCl2
D. NaCl NiAs
E. 萤石 石英 (SiO2)
22. 对于以下无机晶体结构,描述堆积离子与间隙离子的排列,给出层堆积顺序(例如AaBbCcA...),并在部分中绘制晶胞。
A. 闪锌矿
B. 纤锌矿
- ↑ K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough (1980). "LixCoO2 (0<x<l): A New Cathode Material for Batteries of High Energy Density". Materials Research Bulletin. 15: 783–789. doi:10.1016/0025-5408(80)90012-4.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Yang Shao-Horn, Laurence Croguennec, Claude Delmas, E. Chris Nelson 和 Michael A. O'Keefe (2003 年 7 月). "Atomic resolution of lithium ions in LiCoO2". Nature Materials. 2 (7): 464–467. doi:10.1038/nmat922. PMID 12806387.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ M.S. Whittingham (1976). "Electrical Energy Storage and Intercalation Chemistry". Science. 192: 1126–1127. doi:10.1126/science.192.4244.1126.
- ↑ . Gao, Z. Yan, J. L. Gray, X. He, T. Chen, Q. Huang, Y. C. Li, H. Wang, S. H. Kim, T. E. Mallouk 和 D. Wang (2019). "Polymer–inorganic solid–electrolyte interphase for stable lithium metal batteries under lean electrolyte conditions". Nature Materials. 18: 384–389. doi:10.1038/s41563-019-0305-8.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ M. Stanley Whittingham "Lithium Batteries and Cathode Materials" Chem. Rev., 2004, vol. 104, pp. 4271–4302. DOI: 10.1021/cr020731c
- ↑ Kagan, Cherie R.; Mitzi, David B.; Dimitrakopoulos, C. D. (1999). "Organic-inorganic hybrid materials as semiconducting channels in thin-film field-effect transistors". Science. 286: 945–947. doi:10.1126/science.286.5441.945.
{{cite journal}}: Cite has empty unknown parameter:|1=(help) - ↑ Kojima, Akihiro; Teshima, Kenjiro; Shirai, Yasuo; Miyasaka, Tsutomu (2009 年 5 月 6 日). "Organometal Halide Perovskites as Visible-Light Sensitizers for Photovoltaic Cells". Journal of the American Chemical Society. 131 (17): 6050–6051. doi:10.1021/ja809598r. PMID 19366264.
- ↑ Chung, In; Lee, Byunghong; He, Jiaking; Chang, Robert P. H.; Kanatzidis, Mercouri G. (2012 年 5 月 24 日). "All-solid-state dye-sensitized solar cells with high efficiency". Nature. 485: 486–489. doi:10.1038/nature11067.
- ↑ a b "NREL efficiency chart" (PDF).
- ↑ W. Zhang 等人 (2013),"Unexpected Stable Stoichiometries of Sodium Chlorides." Science,第 342 卷,第 6165 号,第 1502-1505 页。 doi: 10.1126/science.1244989