生命科学方法与概念/克隆方法
分子克隆是一组实验方法,用于组装重组DNA分子并在宿主生物体中指导它们的复制。术语克隆指的是该方法涉及一个分子的复制,以产生具有相同DNA分子的细胞群体。分子克隆通常使用来自两种不同生物体的DNA序列:DNA克隆来源物种和作为重组DNA复制活体宿主的物种。
这里概述了使用限制酶和连接酶克隆的例子来描述整个过程,这是传统方法。在此之后,描述了特殊策略和替代方法。
在20世纪70年代之前,由于无法从复杂生物体中分离和研究单个基因,我们对遗传学和分子生物学的理解受到了严重阻碍。当发现限制酶和DNA连接酶是分子生物学中宝贵的工具时,这种情况发生了戏剧性的变化。第一个重组DNA分子是在1972年生成和研究的。限制酶和连接酶克隆很快成为分子生物学中的一项标准程序。整个过程通常包括以下七个步骤。
虽然大量的宿主生物和分子克隆载体正在使用,但绝大多数分子克隆实验始于大肠杆菌的实验室菌株和质粒克隆载体。大肠杆菌和质粒载体被广泛使用,因为它们技术成熟、用途广泛、易于获得,并且能以最少的设备快速培养重组生物。如果要克隆的DNA特别大(数十万到数百万个碱基对),那么通常选择细菌人工染色体或酵母人工染色体载体。
专门的应用可能需要专门的宿主-载体系统。例如,如果实验人员希望从重组生物体中收获特定蛋白质,那么选择包含在所需宿主生物体中转录和翻译的适当信号的表达载体。或者,如果需要在不同物种中复制DNA(例如,将DNA从细菌转移到植物),那么可以选择多种宿主范围载体(也称为穿梭载体)。然而,在实践中,专门的分子克隆实验通常从克隆到细菌质粒开始,然后亚克隆到专门的载体中。
克隆载体用限制性内切酶处理,以在插入外源DNA的位点切割DNA。选择限制酶以在切割位点产生与外源DNA末端兼容的构型。通常,这是通过用相同的限制酶切割载体DNA和外源DNA来完成的。重要的是,这种限制性消化效果良好,否则将会有许多含有原始载体而没有插入片段的菌落。载体的重新连接也会导致这个问题。当线性载体的末端兼容时,它们可以在连接步骤中连接起来,并导致假阳性菌落。为了防止这种情况发生,载体可以用磷酸酶处理。DNA连接酶需要磷酸基团来形成磷酸二酯键,因此它不能连接脱磷酸化的载体末端。在这种情况下,插入片段DNA必须带有5'磷酸基团,如果它是从PCR获得的,则可能不是这种情况。
对于基因组DNA的克隆,要克隆的DNA从感兴趣的生物体中提取。几乎任何组织来源都可以使用,只要DNA没有被过度降解。然后纯化DNA以去除污染的蛋白质、RNA和更小的分子。PCR方法通常用于在分子克隆之前扩增特定的DNA或RNA(RT-PCR)序列。
用于克隆实验的DNA也可以通过使用逆转录酶从RNA中获得(cDNA克隆),或以合成DNA的形式(人工基因合成)。cDNA克隆通常用于获得代表感兴趣细胞的mRNA群体的克隆,而合成DNA用于获得设计者定义的任何精确序列。
然后用限制性内切酶处理纯化的DNA,以产生具有可与载体末端连接的末端的片段。如有必要,可以在PCR步骤中将所需的限制位点添加到插入片段中。
在此步骤中,将载体和插入片段以适当的浓度混合在一起,并暴露于DNA连接酶,DNA连接酶将末端共价连接起来。然后,将含有随机连接末端的DNA混合物准备好引入宿主生物体。
DNA连接酶只识别和作用于线性DNA分子的末端,通常产生具有随机连接末端的复杂DNA分子混合物。将存在所需的产物(载体DNA共价连接到外源DNA),但其他序列(例如,外源DNA连接到自身,载体DNA连接到自身以及载体和外源DNA的高阶组合)也通常存在。这种复杂的混合物在克隆过程的后续步骤中被分选出来,在将DNA混合物引入细胞后。
在体外操纵DNA之后,产物通常通过称为转化的过程引入大肠杆菌。为了进行转化,细菌必须处于感受态。一些细菌表现出天然感受态,而在另一些细菌中,这种状态必须通过实验室程序诱导。通常,将细胞在含有二价阳离子(通常是氯化钙)的溶液中在冷条件下孵育,然后暴露于热休克。
如大肠杆菌等细菌的表面由于其细胞表面的磷脂和脂多糖而带负电,DNA也带负电。因此,二价阳离子的一个功能是通过协调磷酸基团和其他负电荷来屏蔽电荷,从而使DNA分子能够粘附在细胞表面。有人建议,在冷条件下将细胞暴露于二价阳离子也可能改变或削弱细胞的细胞表面结构,使其更容易透入DNA。热脉冲被认为会在细胞膜的两侧产生热量不平衡,迫使DNA通过细胞孔或受损的细胞壁进入细胞。
电穿孔是另一种转化方法。在这个方法中,细胞被短暂地暴露在10-20 kV/cm的电场中,这被认为会在细胞膜上 tạo ra các lỗ hổng,允许质粒 DNA 进入。在电击后,细胞的膜修复机制会迅速封闭这些孔洞。
将重组 DNA 导入选定的宿主生物体通常是一个低效率的过程,也就是说,只有一小部分细胞会真正摄取 DNA。这使得选择步骤成为必需,在这个步骤中,只有那些摄取了具有可选择标记的 DNA 的细胞才能存活。
当使用细菌细胞作为宿主生物体时,可选择标记通常是一个赋予抗生素抗性的基因,通常是 ampicillin。该步骤通过将含有转化子的溶液铺板到含有抗生素的琼脂平板上,并在 37°C 下过夜培养来进行。含有质粒的细胞将存活并形成菌落,而那些未能摄取质粒序列的细胞将死亡。
现代细菌克隆载体(例如 pUC19 及其后来的衍生物,包括 pGEM 载体)使用蓝白筛选系统来区分转基因细胞菌落和含有亲本载体(即没有插入重组序列的载体 DNA)的菌落。因此,很容易识别转基因细菌克隆,而忽略那些不包含重组 DNA 的克隆。
如果载体不包含这种系统,可以进行菌落 PCR 来确定哪些菌落携带含有插入片段的质粒。限制性酶切和随后的凝胶电泳是另一种选择。这只能在菌落被挑选、培养并分离出质粒后进行。
即使这些方法表明 DNA 已整合到载体中,也不能确定它是否是所需的序列。出于这个原因,需要进行 DNA 测序作为最终的验证步骤。
Golden Gate 克隆是一种方法,它允许研究人员使用 II 类限制性内切酶和 DNA 连接酶同时定向地将多个 DNA 片段组装成一个片段。这种组装是在体外进行的。最常用的 II 类酶包括 BsaI、BsmBI 和 BbsI。
与 EcoRI 和 BamHI 等标准 II 类限制性内切酶不同,这些酶在识别位点之外切割 DNA,因此可以 tạo ra các overhang 不对称。由于有 256 种可能的 overhang 序列,因此可以通过使用 overhang 序列组合来组装多个 DNA 片段。
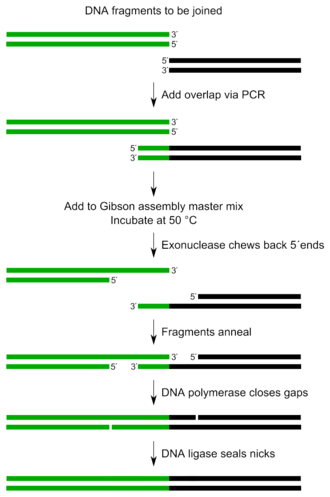
Gibson 组装是一种 DNA 组装方法,它允许在单个等温反应中将多个 DNA 片段连接起来。它由 Daniel Gibson 于 2009 年在 J. Craig Venter 研究所 (JCVI) 工作时发明。
整个 Gibson 组装反应只需要少量组件,操作步骤很少。
该方法可以基于序列同源性同时组合多个(>10)DNA 片段。它要求 DNA 片段包含与相邻 DNA 片段的约 20-40 个碱基对重叠。这些 DNA 片段与三种酶的混合物以及其他缓冲液组分混合。
三种必需的酶活性是:核酸外切酶、DNA 聚合酶和 DNA 连接酶。
- 核酸外切酶从 5' 端将 DNA 向回切除。相邻 DNA 片段上产生的单链区域可以退火。
- DNA 聚合酶掺入核苷酸以填补任何缺口。
- DNA 连接酶共价连接相邻片段的 DNA,从而消除 DNA 中的任何缺口。
整个混合物在 50°C 下孵育长达一小时。所得产物是连接成一个的不同的 DNA 片段。
与传统的限制性酶/连接重组 DNA 克隆相比,这种 DNA 组装方法具有许多优点。
- PCR 后无需对 DNA 片段进行限制性酶切。骨架载体可以被酶切,也可以通过 PCR 合成。
- 它比传统的克隆方案简单得多,因为需要更少的步骤和更少的试剂。该过程也需要更少的时间。
- 两个 DNA 片段之间没有留下限制性位点痕迹(又称“无痕”)。
- 可以在单个试管反应中同时组合多个 DNA 片段。
TA 克隆方法利用了Taq 聚合酶的末端转移酶活性。这种酶在 PCR 产物的 3' 端添加一个腺苷 (A)。如果 PCR 引物在 5' 端具有鸟嘌呤,最好是,因为这最大限度地提高了Taq DNA 聚合酶添加末端腺苷突出端的可能性。不应使用具有广泛 3´ 到 5´ 核酸外切酶活性的聚合酶,因为它们不会留下 3´ 腺嘌呤突出端。目标载体被线性化并用钝端限制性内切酶切割。然后使用末端转移酶用二脱氧胸腺嘧啶三磷酸 (ddTTP) 对该载体进行尾部添加。重要的是使用 ddTTP 以确保只添加一个 T 残基。这种尾部添加使载体在每个钝端具有一个单一的 3'-突出胸腺嘧啶残基。这使得可以直接将 PCR 产物克隆到线性化的载体中。
TOPO TA 克隆结合了 TA 克隆的优点和 DNA 拓扑异构酶 I 的连接活性。拓扑异构酶的生物学作用是切割和重新连接超螺旋 DNA 末端以促进复制。牛痘病毒拓扑异构酶 I 特异性识别 DNA 序列 5´-(C/T)CCTT-3'。在复制过程中,该酶特异性地在这个序列处消化 DNA,解开 DNA 并重新连接到胸腺嘧啶碱基的 3' 磷酸基团。
TOPO 载体经过设计,使其在两个线性末端都带有这个特定序列 5´-(C/T)CCTT-3'。线性载体 DNA 已经具有共价连接到其两条链的游离 3' 末端的拓扑异构酶。然后将其与 PCR 产物混合。当 PCR 产物链的游离 5' 末端攻击每个载体链的拓扑异构酶/3' 末端时,这些链通过已结合的拓扑异构酶共价连接。当溶液在室温下与所需的盐一起孵育时,此反应有效地进行。
TOPO 钝端克隆利用带有连接到末端的拓扑异构酶的线性化载体,但它不依赖于 A/T 突出端。这意味着可以使用具有校对活性的聚合酶进行 PCR。
Gateway 克隆系统由 Invitrogen 于 1990 年代后期发明并商业化,它使研究人员能够使用一组专有的重组序列,“Gateway att”位点,以及两种专有的酶混合物,“LR 克隆酶”和“BP 克隆酶”,高效地在质粒之间转移 DNA 片段。该方法基于噬菌体 λ 用于将其 DNA 整合到大肠杆菌染色体中的位点特异性重组系统。
Gateway克隆技术允许在不同的克隆载体之间转移DNA片段,同时保持阅读框。使用Gateway,可以克隆或亚克隆DNA片段以进行功能分析。该系统要求将DNA片段初始插入到带有两个侧翼重组序列(称为attL1和attL2)的质粒中,以开发“Gateway Entry克隆”。
包含绝大多数人类、小鼠和大鼠ORF的Gateway Entry克隆的大型档案已从人类cDNA文库克隆或化学合成,以使用NIH(美国国立卫生研究院)资金支持研究界。这些基因盒在标准Gateway克隆质粒中的可用性,帮助研究人员快速将这些盒转移到促进基因功能分析的质粒中。Gateway克隆的初始设置需要更多时间,并且比传统的限制性内切酶和连接酶克隆方法更昂贵,但它节省了时间,并为下游应用提供了更简单、更高效的克隆。
该技术已被生命科学研究界广泛采用,尤其是在需要将数千个DNA片段转移到一种类型的质粒(例如,一种包含CMV启动子用于在哺乳动物细胞中表达蛋白质的质粒)或将一个DNA片段转移到许多不同类型的质粒(例如,用于细菌、昆虫和哺乳动物蛋白质表达)的应用中。
Gateway克隆的第一步是制备Gateway Entry克隆。Entry克隆通常分两步完成。
1) 使用基因特异性PCR引物和PCR扩增,将Gateway attB1和attB2序列分别添加到基因片段的5'端和3'端。
2) 然后将PCR扩增产物与称为Gateway“Donor载体”的特殊质粒和专有的“BP Clonase”酶混合物混合。酶混合物催化attB序列包含的PCR产物重组插入Gateway Donor载体中的attP重组位点。一旦盒成为目标质粒的一部分,在Gateway命名法中它被称为“Entry克隆”,重组序列被称为Gateway“attL”类型。
然后可以简单而有效地将Gateway Entry克隆中的基因盒转移到任何Gateway Destination载体(Invitrogen对任何包含Gateway“attR”重组序列和元素(如启动子和表位标签,但不包括ORF)的Gateway质粒的命名法)中,使用专有的酶混合物“LR Clonase”。数千个Gateway Destination质粒已被制造出来,并且在世界各地的研究人员之间自由共享。Gateway Destination载体类似于包含多个克隆位点的经典表达载体。Gateway Destination载体可从Invitrogen、EMD(Novagen)和Covalys商业化获得。
由于Gateway克隆使用专利重组序列,以及仅从Invitrogen获得的专有酶混合物,该技术不允许研究人员切换供应商,并导致所有此类专利程序的锁定效应。
总结Gateway克隆中涉及的不同步骤。
- Gateway BP反应:带有侧翼attB位点的PCR产物(例如,从cDNA文库扩增)+包含attP位点的Donor载体+ BP克隆酶 => Gateway Entry克隆,包含attL位点,侧翼感兴趣的基因
- 此步骤可以用其他克隆方法代替
- Gateway LR反应:包含attL位点的Entry克隆+包含attR位点、启动子和标签的Destination载体+ LR克隆酶 => 表达克隆,包含attB位点,侧翼感兴趣的基因,准备基因表达。
连接独立克隆 (LIC)
[edit | edit source]连接通常是传统克隆方法中最有问题的一步。使用限制性内切酶时,此步骤是必要的,因为酶产生的短粘性末端不能永久地将载体和插入片段保持在一起。连接独立克隆通过创建更长的突出端消除了对连接的需要。当载体和插入片段的互补突出端退火时,氢键足够强以将它们保持在一起,并且可以将构建体直接转化。然后由宿主细胞酶修复缺口。
为了创建突出端,使用T4 DNA聚合酶。该酶具有5'到3'聚合酶活性以及3'到5'核酸外切酶活性。核酸外切酶可以从3'端去除核苷酸,但只要溶液中存在所有核苷酸,它们就会立即被聚合酶替换。然而,在LIC中,只添加了dGTP到混合物中,这意味着核酸外切酶会一直进行到遇到序列中的第一个G为止。这意味着必须以使产生的突出端足够长的方式设计重叠区域。
为了进行反应,载体通过限制性消化或PCR线性化,如果完全避免使用限制性内切酶。插入片段通过PCR扩增,并将与载体末端同源的序列添加到5'端。
序列和连接独立克隆 (SLIC)
[edit | edit source]在这种连接独立克隆的变体中,首先从反应中排除所有dNTP。在T4 DNA聚合酶的3'到5'核酸外切酶活性创建5'突出端的一段时间后,通过添加dCTP停止反应。一旦酶到达3'到5'链中的C,核酸外切酶活性就可以被聚合酶平衡。然而,由于只添加了一个核苷酸,所以突出端被保留,并且可以用来连接载体和插入片段。
In-Fusion克隆
[edit | edit source]In-Fusion® 克隆是Clontech开发的一种专有组装方法,类似于SLIC和Gibson组装。与这些方法相比,推荐的重叠长度只有15 bp,它使用痘苗病毒DNA聚合酶来创建突出端。
无缝连接克隆提取物 (SLiCE)
[edit | edit source]SLiCE类似于SLIC或Gibson组装等克隆方法,因为它需要相同类型的DNA起始分子,并产生相同的产物。主要区别在于它使用细菌细胞提取物,这种提取物很容易产生,并且可能非常经济实惠。
基于硫代磷酸酯的连接独立基因克隆 (PLICing)
[edit | edit source]PLICing是一种无酶、序列无关的克隆方法,它基于硫代磷酸酯键的化学裂解反应。
第一步,载体和插入片段都通过PCR扩增,使用在5'端具有互补硫代磷酸酯核苷酸的引物。这些核苷酸形成硫代磷酸二酯键,而不是磷酸二酯键。PCR后,这些键在碘/乙醇溶液中裂解,产生单链突出端。载体和插入片段的末端杂交,并且可以转化构建体。
