生命科学方法与概念/显微镜
显微镜 是使用显微镜观察肉眼无法看到的物体和物体区域的技术领域(即不在正常眼睛分辨率范围内的物体)。显微镜有三个著名的分支:光学显微镜、电子显微镜和扫描探针显微镜。

明场显微镜 是所有光学显微镜照明技术中最简单的。样本照明是透射的(即从下方照射,从上方观察)白光,样本中的对比度是由样本致密区域中某些透射光的吸收引起的。

暗场显微镜 描述了一种用于增强未染色样本对比度的照明技术。它通过从图像中排除未散射的光束来实现。这产生了经典的外观,即暗背景上带有明亮物体。
暗场显微镜的光路如下
- 光线进入显微镜用于照亮样本。
- 一个特殊尺寸的圆盘,遮光板 会阻挡部分来自光源的光线,留下一个外部环形照明区域。在低放大倍率下,可以用一个宽相环来代替。
- 聚光镜 将光线聚焦到样本上。
- 光线进入样本。大部分光线直接透射,而部分光线被样本散射。
- 散射光 进入物镜,而直接透射光 只是错过了物镜,由于直接照明阻挡 并没有被收集到。
- 只有散射光会继续产生图像,而直接透射光被省略。
暗场显微镜是一种非常简单但有效的技术,非常适合用于涉及活的未染色生物样本,例如来自组织培养物或单个水生单细胞生物的涂片。考虑到设置的简单性,从该技术获得的图像质量令人印象深刻。
暗场显微镜的主要限制是最终图像中看到的低光照度。这意味着样本必须被非常强地照亮,这会对样本造成损坏。暗场显微镜技术几乎完全没有伪影,这是由于过程的本质。但是,暗场图像的解释必须非常小心,因为明场显微镜图像的常见暗特征可能是不可见的,反之亦然。

相位衬度 是一种广泛使用的技术,将折射率的差异显示为对比度的差异。
使相位衬度显微镜中的相位变化可见的基本原理是,将照明背景光与样本散射光(构成前景细节)分离,并对其进行不同的操作。
通过聚光镜环形光经过聚光镜环形光并聚焦到样本上。一些照明光被样本散射。剩余的光线不受样本影响,形成背景光。在观察未染色的生物样本时,散射光很弱,通常相对于背景光发生 -90° 相移。这意味着前景和背景几乎具有相同的强度,导致图像对比度低(a)。
在相位衬度显微镜中,图像对比度通过两个步骤得到改善。背景光通过相移环 相移 -90°。这消除了背景光和散射光之间的相位差,导致前景和背景之间的强度差增加(b)。为了进一步提高对比度,背景光被灰色滤光片环 (c)变暗。部分散射光会因环而发生相移和变暗。但是,背景光受到的影响更大,从而产生相位衬度效果。

以上描述的是负相位衬度。在其(更常见的)正形式中,背景光改为相移 +90°。因此,背景光相对于散射光将相移 180°。这意味着散射光将在 (b) 中从背景光中减去,以形成图像,其中前景比背景更暗。

微分干涉对比 (DIC) 显微镜是一种光学显微镜照明技术,用于增强未染色透明样本的对比度。一个相对复杂的照明方案产生一个图像,其中物体出现在灰色背景上的黑色到白色。该图像类似于通过相位衬度显微镜获得的图像,但没有明亮的衍射光晕。
该系统在聚光镜中包含一个特殊棱镜(诺马斯基棱镜、沃拉斯顿棱镜),它将光线分成普通光束和非凡光束。两束光束之间的空间差异很小(小于物镜的最大分辨率)。通过样本后,光束由物镜中的类似棱镜重新组合。
在均匀样本中,两束光束之间没有差异,不会产生对比度。然而,在折射边界附近(例如细胞质中的细胞核),普通光束和非凡光束之间的差异会在图像中产生浮雕。微分干涉对比需要偏振光源才能起作用;必须在光路中安装两个偏振滤光片,一个在聚光镜下方(偏振器),另一个在物镜上方(分析器)。
- 非偏振光进入显微镜,并在 45° 处偏振。
- 偏振光进入第一个诺马斯基改进的沃拉斯顿棱镜,并被分成两束光线,两束光线相互偏振 90°,即采样光线和参考光线。
- 这两束光线被聚光镜聚焦,以便通过样本。这两束光线被聚焦,以便它们穿过样本中的两个相邻点,相距约 0.2 μm。
- 光线穿过样本的相邻区域,以剪切量分隔。该分离通常类似于显微镜的分辨率。它们将在区域折射率或厚度不同的区域经历不同的光程长度。由于波在光学密度更大的材料中经历的延迟,这会导致一束光线相对于另一束光线的相位变化。许多光线对穿过样本中相邻点的对(以及它们被样本吸收、折射和散射)意味着样本的图像现在将由 0° 和 90° 偏振光携带。如果单独查看,它们将是样本的明场图像,彼此略微偏移。光还携带人眼无法看到的信息,即光线的相位。不同的偏振在这一点上防止了这两个图像之间的干扰。
- 光线穿过物镜,并被第二个诺马斯基改进的沃拉斯顿棱镜聚焦。
- 第二个棱镜将这两束光线重新组合成一束在 135° 处偏振的光线。光线的组合会导致干涉,根据光程差使图像在该点变亮或变暗。

图像
[edit | edit source]图像在非常倾斜的光照下呈现三维物体的视觉效果,在相应的表面上形成强烈的明暗阴影。表观光照方向由沃拉斯顿棱镜的方位决定。
如上所述,图像是由两个相同的明场图像略微偏移叠加(通常约为0.2 μm)生成的,然后由于相位差导致的干涉将相位变化(因此光程)转化为可见的明暗变化。这种干涉可能是相长干涉或相消干涉,从而产生出三维特性的视觉效果。
产生干涉的典型相位差非常小,很少超过90°(波长的四分之一)。这是由于大多数样品及其介质的折射率相似造成的:例如,水中的细胞只有大约0.05的折射率差。这种小的相位差对于DIC的正常功能至关重要,因为如果两种物质交界处的相位差太大,那么相位差可能达到180°(半波长),导致完全相消干涉,形成异常的暗区;如果相位差达到360°(全波长),则会产生完全相长干涉,形成异常的亮区。
DIC在涉及活体和未染色生物样品(如组织培养涂片或单个水生单细胞生物)的应用中具有很强的优势。在这种情况下的分辨率和清晰度在标准光学显微镜技术中是无与伦比的。
DIC的主要局限性在于它需要一个与周围环境具有相当相似折射率的透明样品。DIC不适用于(在生物学中)厚样品(如组织切片)和高度色素沉着的细胞。DIC也不适用于大多数非生物学应用,因为它依赖于偏振,而许多物理样品会影响偏振。
荧光显微镜
[edit | edit source]
荧光显微镜是一种光学显微镜,它使用荧光和磷光而不是(或除了)反射和吸收。
标本用特定波长(或波长)的光照射,该光被荧光团吸收,导致荧光团发射更长波长的光。照射光通过使用光谱发射滤光片与微弱的发射荧光分离。荧光显微镜的典型组件包括光源(氙弧灯或汞蒸汽灯很常见;更先进的形式是高功率LED和激光器)、激发滤光片、二向色镜(或二向色分束器)和发射滤光片。滤光片和二向色镜的选择要与用于标记标本的荧光团的光谱激发和发射特性相匹配。通过这种方式,一次可以对单个荧光团的分布成像。多个荧光团的彩色图像必须通过组合多个单色图像来合成。

大多数使用的荧光显微镜是落射荧光显微镜,其中荧光团的激发和荧光检测通过相同的路径(即通过物镜)进行。这些显微镜广泛应用于生物学领域,也是更先进的显微镜设计(如共聚焦显微镜和全内反射荧光显微镜(TIRF))的基础。
反卷积
[edit | edit source]荧光显微镜是一种强大的技术,可以显示复杂环境中特异性标记的结构,并提供生物结构的三维信息。然而,这些信息会被以下事实所模糊:在照射下,所有荧光标记的结构都会发射光,无论它们是否处于焦点。因此,特定结构的图像总是会被来自非焦点结构的光的贡献所模糊。这种现象会导致对比度降低,尤其是在使用具有高分辨率的物镜(通常是高数值孔径的油浸物镜)时。
然而,模糊不是由随机过程(如光散射)引起的,而是可以由显微镜成像系统中图像形成的光学特性很好地定义。如果我们考虑一个小的荧光光源(本质上是一个亮斑),来自该斑点的光会随着斑点变得越来越失焦而从我们的视角扩展开来。在理想条件下,这会在第三(轴向)维度上产生该点光源的“沙漏”形状。这种形状被称为显微镜成像系统点扩散函数(PSF)。由于任何荧光图像都是由大量这样的小的荧光光源组成的,因此图像被认为是“被点扩散函数卷积”。
了解这种点扩散函数意味着可以使用计算机方法(通常被称为反卷积显微镜)在一定程度上逆转这个过程。有各种各样的算法可用于2D或3D反卷积。它们可以大致分为非恢复和恢复方法。虽然非恢复方法可以通过从焦点平面移除非焦点光来提高对比度,但只有恢复方法才能真正将光重新分配到其适当的起源位置。以这种方式处理荧光图像可能比直接获取没有非焦点光的图像(如来自共聚焦显微镜的图像)更具优势,因为否则被消除的光信号将成为有用的信息。对于3D反卷积,人们通常提供从不同焦点平面拍摄的一系列图像(称为Z堆栈),以及对PSF的了解,PSF可以通过实验或理论上从已知显微镜的所有贡献参数推导出。
共聚焦显微镜
[edit | edit source]共聚焦显微镜是一种光学成像技术,通过在透镜的共焦平面上添加空间针孔来消除非焦点光,从而提高显微照片的光学分辨率和对比度。它能够从获得的图像中重建三维结构。
在传统的(即广域)荧光显微镜中,整个标本被光源均匀地照射。光路中的所有标本部分都同时被激发,产生的荧光被显微镜的光电探测器或相机检测,包括很大一部分非焦点背景部分。相反,共聚焦显微镜使用点照明和位于探测器前方光学共焦平面上的针孔来消除非焦点信号——“共聚焦”这个名称源于这种配置。由于只有来自焦平面附近产生的荧光才能被探测到,因此图像的光学分辨率(尤其是在样品深度方向上)远高于广域显微镜。然而,由于来自样品荧光的大部分光在针孔处被阻挡,因此这种提高的分辨率是以信号强度降低为代价的,因此通常需要长时间曝光。

由于一次只照射样品中的一个点,因此2D或3D成像需要在标本中进行规则光栅扫描(即平行扫描线的矩形图案)。焦平面的可实现厚度主要由所用光的波长除以物镜的数值孔径来决定,但也受标本的光学特性影响。这种薄的光学切片功能使这些类型的显微镜特别适合3D成像和样品表面的轮廓分析。
旋转盘显微镜
[edit | edit source]旋转盘共聚焦显微镜使用一个圆盘上的一系列移动针孔来扫描光斑。由于一系列针孔平行地扫描一个区域,因此每个针孔可以在特定区域停留更长的时间,从而与激光扫描显微镜相比,减少了照亮样品所需的激发能量。激发能量的降低减少了样品的毒性和光漂白,这使其成为成像活细胞或生物体的首选系统。
荧光相关光谱(FCS)
[edit | edit source]
典型的FCS装置由一条激光线组成,激光线通过二向色镜反射到显微镜物镜中。激光束聚焦在样品中,样品中含有荧光分子,其稀释度非常高,以至于焦斑中只有几个分子(通常是1-100个分子在一个fL中)。当粒子穿过焦体积时,它们会发生荧光。这种光被相同的物镜收集,并且由于它相对于激发光红移,因此它穿过二向色镜到达探测器。产生的电子信号可以被直接存储为强度与时间的轨迹,以便稍后分析,或者被计算以直接生成自相关。FCS曲线本身只代表时间频谱。对物理现象的结论必须通过适当的模型从那里提取。感兴趣的参数是在将自相关曲线拟合到模型函数形式后发现的。当已知适当的模型时,FCS可用于获得定量信息,例如扩散系数、流体力学半径、平均浓度和化学反应动力学速率。
荧光寿命成像显微镜(FLIM)
[edit | edit source]荧光寿命成像显微镜(FLIM)是一种成像技术,用于根据荧光样品荧光的衰减速率差异来产生图像。
这具有最小化厚样本层中光子散射影响的优势。荧光寿命成像产生图像,其中每个像素的强度由荧光寿命决定,这允许观察具有不同荧光衰减速率的材料之间的对比度(即使这些材料在完全相同的波长处发出荧光),并且还产生显示其他衰减途径变化的图像,例如在 FRET 成像中。

全内反射荧光显微镜 (TIRFM) 是一种显微镜,可以通过它观察样本的薄区域,通常小于 200 纳米。
在细胞和分子生物学中,许多细胞表面分子事件,如细胞粘附、激素对细胞的结合、神经递质的分泌和膜动力学,已被用传统荧光显微镜研究。然而,与样本表面结合的荧光团和周围介质中的荧光团处于平衡状态。当这些分子被传统荧光显微镜激发和检测时,来自与表面结合的那些荧光团的荧光往往会被来自未结合分子数量大得多的背景荧光所淹没。
TIRFM 使用倏逝波来选择性地照亮和激发紧邻玻璃-水界面的样本受限区域中的荧光团。倏逝波仅在入射光在玻璃-水界面发生全内反射时产生。倏逝电磁场从界面呈指数衰减,因此仅穿透到样品介质中约 100 纳米。因此,TIRFM 能够选择性地观察表面区域,例如细胞的基底质膜(约 7.5 纳米厚),如上图所示。然而,需要注意的是,可视化的区域至少有几百纳米宽,因此在 TIRF 显微镜检查期间,除了质膜外,质膜下方的胞质区域也必然会被可视化。质膜的选择性可视化以高轴向分辨率呈现活细胞中质膜的特征和事件。
TIRF 也可用于观察单个分子的荧光,使其成为生物物理学和定量生物学的重要工具。
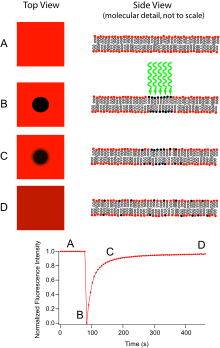
光漂白后荧光恢复 (FRAP) 指的是一种光学技术,能够量化含有荧光标记探针的分子薄膜的二维横向扩散,或检查单个细胞。该技术在细胞膜扩散和蛋白质结合的生物学研究中非常有用。此外,荧光磷脂双层 (或单层) 的表面沉积允许根据表面结构和自由能来表征亲水性 (或疏水性) 表面。
基本装置包括一台光学显微镜、一个光源和一些荧光探针。该技术首先在光漂白前保存样本的背景图像。接下来,光源聚焦到可视区域的一小块区域。该区域的荧光团接受高强度照明,导致它们的荧光寿命迅速过去。现在显微镜中的图像是一个均匀的荧光场,有一个明显的暗点。随着布朗运动的进行,仍具有荧光的探针将在整个样本中扩散,并取代漂白区域中的非荧光探针。这种扩散以有序的方式进行,可以从扩散方程中解析地确定。
光漂白后荧光损失 (FLIP) 与 FRAP 密切相关。这两种显微镜技术的主要区别在于,FRAP 涉及研究细胞在单次光漂白事件后恢复的能力,而 FLIP 涉及研究在多次光漂白事件后荧光损失如何在整个细胞中传播。这种目的上的差异也导致了对细胞哪些部分进行观察的差异。在 FRAP 中,实际光漂白的区域是感兴趣的区域。相反,在 FLIP 中,感兴趣的区域位于正在光漂白的区域的外部。另一个重要的区别是,在 FRAP 中,存在单个光漂白事件和一个恢复期来观察荧光团移动回漂白部位的情况。然而,在 FLIP 中,发生多次光漂白事件以防止未漂白的荧光团返回漂白区域。与 FLIP 一样,FRAP 用于研究膜性细胞器的连续性。FLIP 和 FRAP 通常一起使用以确定 GFP 标记蛋白质的迁移率。FLIP 也可用于测量细胞区域之间的分子转移,而与移动速度无关。这允许对细胞内蛋白质运输进行更全面的分析。这不同于 FRAP,FRAP 主要用于确定蛋白质仅在光漂白区域附近的移动性。
超分辨率显微镜 是一种光学显微镜。由于光的衍射,传统光学显微镜的分辨率受到限制,正如恩斯特·阿贝在 1873 年所述。可以实现的分辨率的一个良好近似值是点扩散函数的半峰全宽 (FWHM),并且具有高数值孔径和可见光的精确广域显微镜通常达到约 250 纳米的分辨率。
4Pi 显微镜是一种激光扫描荧光显微镜,具有改进的轴向分辨率。典型的 500-700 纳米值可以提高到 100-150 纳米,这对应于一个几乎球形的焦斑,其体积比标准共聚焦显微镜小 5-7 倍。
分辨率的提高是通过使用两个相对的物镜来实现的,这两个物镜都聚焦到相同的几何位置。此外,通过两个物镜的光程差被仔细调整为最小。通过这种方式,位于两个物镜共同焦区的分子可以从两侧被相干地照亮,并且反射光或发射光也可以被相干地收集,即发射光的相干叠加在探测器上是可能的。用于照亮和检测的立体角增加,并接近理想情况。在这种情况下,样本从所有侧面同时被照亮和检测。

结构照明显微镜 依赖于特定的显微镜协议和曝光后的广泛软件分析。SI 的主要概念是使用图案化的光照亮样本,并通过测量莫尔条纹(来自照明图案和样本的干涉)中的条纹来提高分辨率。否则无法观察到的样本信息可以从条纹中推断出来并通过计算恢复。
SI 通过从可观察区域之外的频率空间收集信息来增强空间分辨率。此过程在倒空间中完成:SI 图像的傅里叶变换 (FT) 包含来自倒空间不同区域的叠加附加信息;通过使用几个帧并将照明移位一些相位,可以计算分离和重建 FT 图像,该图像具有更多分辨率信息。反向 FT 将重建的图像返回到超分辨率图像。

受激发射损耗显微镜 (STED) 使用两个激光脉冲:激发脉冲用于将荧光分子激发到荧光状态,而 STED 脉冲则用于通过受激发射使荧光分子去激发。在实践中,首先应用激发激光脉冲,然后紧随其后的是 STED 脉冲(但也有使用连续波激光的无脉冲 STED 技术)。此外,STED 脉冲经过改造,具有一个零强度点,该点与激发焦点重合。由于受激发射速率对 STED 光束强度的非线性依赖性,焦点激发点周围的所有荧光分子都将处于关闭状态(荧光分子的基态)。通过扫描此焦点,可以获取图像。
正常荧光通过将电子从基态激发到不同基本能量级的激发电子态(S0 跃迁至 S1)来实现,该电子在弛豫回基态 (s1) 后,通过从 S1 下降到 S0 上的振动能级而发射光子。STED 在光子释放之前会中断此过程。被激发的电子被迫弛豫到比荧光跃迁所进入的更高的振动态,导致释放的光子发生红移。由于电子要进入更高的振动态,这两个态的能量差小于正常荧光差。能量的降低提高了波长,并导致光子进一步移向光谱的红色端。这种偏移区分了两种类型的光子,并允许忽略受激光子。
要迫使这种替代发射发生,入射光子必须撞击荧光分子。这种被入射光子撞击的必要性对 STED 有两个含义。首先,入射光子的数量直接影响这种发射的效率,其次,当光子数量足够多时,荧光可以完全被抑制。为了获得抑制荧光所需的足够数量的入射光子,用于产生光子的激光必须具有很高的强度。不幸的是,这种高强度激光会导致荧光分子光漂白的问题。
随机光学重建显微镜 (STORM)、光激活定位显微镜 (PALM) 和荧光光激活定位显微镜 (FPALM) 是一种超分辨率成像技术,利用光开关荧光分子的顺序激活和时间分辨定位来创建高分辨率图像。在成像过程中,任何给定时刻只有一个光学可分辨的荧光分子子集被激活到荧光状态,使得通过找到特定荧光分子单分子图像的质心位置,可以高精度地确定每个荧光分子的位置。随后使荧光分子失活,并激活和成像另一个子集。重复此过程允许定位众多荧光分子,并从图像数据构建超分辨率图像。这三种方法在短时间内独立发表,其原理相同。STORM 最初使用连接到核酸或蛋白质的 Cy5 和 Cy3 染料进行描述,而 PALM 和 FPALM 则使用光开关荧光蛋白进行描述。原则上,可以使用任何光开关荧光分子。
参考文献
- Ishikawa-Ankerhold, H.C., Ankerhold, R., Drummen, G.P.C., 2012. 高级荧光显微技术--FRAP、FLIP、FLAP、FRET 和 FLIM。 分子 17, 4047–132。 doi:10.3390/molecules17044047
- Leung, B.O., Chou, K.C., 2011. 生物学超分辨率荧光显微镜综述。 应用光谱学 65, 967–80。 doi:10.1366/11-06398
- Lichtman, J.W., Conchello, J.-A., 2005. 荧光显微镜。 自然方法 2, 910–9。 doi:10.1038/nmeth817
- Petty, H.R., 2007. 荧光显微镜:成熟和新兴方法、实验策略以及免疫学中的应用 709, 687–709。 doi:10.1002/jemt
