生命科学方法与概念/重组

同源重组是一种遗传重组,其中两个相似或相同的 DNA 分子之间的核苷酸序列发生交换。它最常被细胞用来准确修复发生在 DNA 两条链上的有害断裂,称为双链断裂。同源重组也产生减数分裂过程中 DNA 序列的新组合。此外,同源重组用于水平基因转移,以交换细菌和病毒的不同菌株和物种之间的遗传物质。
虽然同源重组在不同的生物体和细胞类型中差异很大,但大多数形式都涉及相同的基本步骤。在发生双链断裂后,断裂处 5' 端周围的 DNA 部分在称为切除的过程中被切除。在接下来的链入侵步骤中,断裂 DNA 分子的悬垂 3' 端然后“入侵”一个未断裂的相似或相同的 DNA 分子。链入侵后,后续事件可能会遵循两个主要途径中的任何一个;DSBR(双链断裂修复)途径或 SDSA(合成依赖性链退火)途径。在 DNA 修复过程中发生的同源重组往往导致非交叉产物,实际上恢复了受损的 DNA 分子,就像双链断裂之前一样。
同源重组也用于基因靶向,这是一种将遗传改变引入目标生物体的技术。
Red/ET 是一种基于同源重组的商业重组技术。它涉及一个 λ噬菌体衍生的蛋白质对,Redα/Redβ,和 50 bp 同源区域。同源区域可以自由选择,这意味着目标分子上的任何位置都可以改变。带有可诱导启动子的质粒用于表达重组蛋白。由于复制起点对温度敏感,因此该质粒可以在重组后方便地移除。
在位点特异性重组中,DNA 链交换发生在仅具有有限程度序列同源性的片段之间。位点特异性重组酶 (SSR) 通过识别和结合短 DNA 序列来执行 DNA 片段的重排,在该序列处它们切割 DNA 骨架,交换所涉及的两个 DNA 螺旋并将 DNA 链重新连接起来。虽然在某些位点特异性重组系统中,仅仅重组酶和重组位点就足以执行所有这些反应,但在其他系统中,还需要一些辅助蛋白和/或辅助位点。多种基因组修饰策略,其中包括重组酶介导的盒式交换 (RMCE),一种针对将转录单元引入预定基因组位点的先进方法,依赖于 SSR 的能力。
位点特异性重组系统非常特异、快速和高效,即使面对复杂的真核基因组也是如此。它们被用于多种细胞过程,包括细菌基因组复制、分化和致病性以及移动遗传元件的移动。出于同样的原因,它们为开发基因工程工具提供了潜在的基础。
重组位点通常在 30 到 200 个核苷酸之间,由两个具有部分反向重复对称性的基序组成,重组酶结合到这些基序上,并侧翼重组发生的中心交叉序列。重组发生在其中的位点对通常是相同的,但也有例外。
根据氨基酸序列同源性和机制相关性,大多数位点特异性重组酶被归类为两个家族之一:酪氨酸重组酶家族或丝氨酸重组酶家族。这些名称源于它们用于攻击 DNA 并在此过程中与 DNA 共价连接的保守亲核氨基酸残基。
Cre/lox 重组被称为位点特异性重组酶技术,被广泛用于在细胞 DNA 的特定位点执行删除、插入、易位和反转。它在真核和原核系统中都有实现。
该系统由一种单一酶 Cre 重组酶组成,它重组一对称为 lox 序列的短目标序列。该系统可以在不插入任何额外的支持蛋白或序列的情况下实现。Cre 酶和最初的Lox 位点称为 loxP 序列源自噬菌体 P1。
将 Lox 序列适当地放置可以激活、抑制基因或将基因交换为其他基因。Cre 酶的活性可以控制,以便它在特定细胞类型中表达或由外部刺激触发,例如化学信号或热休克。这些有针对性的 DNA 改变在细胞谱系追踪中以及当突变体在全球表达时是致命的时非常有用。
Cre/lox 系统在作用和使用方面与 FLP-FRT 重组系统非常相似。
Cre 重组酶(由最初命名为“Causes recombination”的基因座编码,在某些参考文献中发现“Cyclization recombinase”)是一种源自 P1 噬菌体的酪氨酸重组酶。该酶使用类似于拓扑异构酶 I 的机制来执行位点特异性重组事件。它由 4 个亚基和两个结构域组成。总蛋白包含 343 个氨基酸。Cre 在 P1 噬菌体的生活周期中发挥着重要作用,例如线性基因组的环化和 DNA 复制后形成的二聚体染色体的解析。
LoxP(交叉点 P1 的基因座)是噬菌体 P1 上的一个位点,由 34 个 bp 组成。该位点包括一个不对称的 8 bp 序列,除了中间两个碱基外,其他都是可变的,位于两组回文 13 bp 序列之间。下面给出了确切的序列;'N' 表示可能变化的碱基。

当具有loxP位点的细胞在其基因组中表达Cre时,在loxP位点之间会发生重组事件。Cre重组酶与lox位点的第一个和最后一个13个碱基对区域结合,形成二聚体。然后,该二聚体与另一个lox位点的二聚体结合形成四聚体。Lox位点是有方向性的,并且由四聚体连接的两个位点在方向上是平行的。Cre蛋白在两个loxP位点切割双链DNA。然后,通过DNA连接酶将链重新连接,这是一个快速而有效的过程。
Cre介导的loxP位点重组的产物取决于loxP位点的位置和相对方向。位于两个loxP位点之间的DNA序列被称为“floxed”。在这种情况下,Cre介导的重组产物取决于loxP位点的方向。位于同一方向的两个loxP位点之间的DNA将被切除,形成一个环状DNA环,而位于相反方向的两个loxP位点之间的DNA将被反转。两种包含loxP位点的独立DNA物种可以通过Cre介导的重组进行融合。例如,可以使用变异的lox位点71和66连接质粒。
FLP/FRT
[edit | edit source]Flp-FRT重组是一种位点定向的重组技术,越来越多地用于在体内受控条件下操纵生物体的DNA。它类似于Cre-lox重组,但涉及由酿酒酵母2µm质粒衍生的重组酶(Flp)在短的翻转酶识别靶标(FRT)位点之间进行序列重组。
34bp的最小FRT位点序列具有以下序列
5'GAAGTTCCTATTCtctagaaaGtATAGGAACTTC3'
翻转酶(Flp)与两个13bp的5'-GAAGTTCCTATTC-3'臂结合,该臂位于8bp间隔区两侧,即反向方向的位点特异性重组(交叉区域)。FRT介导的切割发生在顶链的非对称8bp核心区域(5'tctagaaa3')前方,以及底链的该序列后面。存在多个变异的FRT位点,但重组通常只能在两个相同的FRT之间发生,而不能在非相同(“异源性”)FRT之间发生。
许多可用的构建体包括一个额外的臂序列(5'-GAAGTTCCTATTCC-3'),该序列距离上游元件一个碱基对,并且方向相同
5'GAAGTTCCTATTCcGAAGTTCCTATTCtctagaaaGtATAGGAACTTC3'
该片段对于切除是可有可无的,但对于整合是必不可少的,包括重组酶介导的盒交换。
由于重组活性可以靶向选定的器官,或者可以使用低水平的重组活性一致地改变仅一小部分细胞的DNA,因此Flp-FRT可用于在多细胞生物中构建遗传镶嵌体。使用这项技术,可以在感兴趣的特定靶器官中研究基因的丢失或改变,即使在实验动物无法承受其他器官中失去该基因的情况下也是如此(空间控制)。还可以通过使用诱导型启动子在发育后期触发重组活性来研究改变基因的效果(时间控制) - 这可以防止改变影响器官的整体发育,并允许在相同环境中比较缺乏该基因的单个细胞和正常的相邻细胞。
应用
[edit | edit source]基因敲除
[edit | edit source]
基因敲除(缩写:KO)是一种遗传技术,其中生物体的一个基因被使其失活(“敲除”生物体)。它们也被称为敲除生物或简称为敲除,用于了解已测序但功能未知或不完全已知的基因。研究人员从敲除生物体和正常个体之间的差异中得出推论。
敲除是通过多种技术的组合来完成的,从试管中的质粒、细菌人工染色体或其他DNA构建体开始,然后进行细胞培养。单个细胞被基因转染了DNA构建体。通常目标是创造一种具有改变基因的转基因动物。如果是这样,胚胎干细胞会被基因改造并插入早期胚胎。然后,具有其种系细胞中遗传变化的产生的动物通常可以将基因敲除传递给后代。
构建体被设计用于与靶基因重组,这是通过将基因本身的序列整合到构建体中来实现的。然后在基因中该序列区域发生重组,导致插入外来序列以破坏基因。由于其序列被中断,大多数情况下,改变的基因将被翻译成无功能的蛋白质,如果它被翻译的话。
因为在大多数细胞和大多数构建体的情况下,所需类型的DNA重组是一个罕见事件,所以选择用于插入的外来序列通常包括一个报告基因。这使得能够轻松选择敲除成功的细胞或个体。有时DNA构建体插入染色体而不发生与靶基因的所需同源重组。为了消除这些细胞,DNA构建体通常包含第二个DNA区域,该区域允许识别和丢弃这些细胞。下面的图示说明了这样的系统。

在二倍体生物中,大多数基因包含两个等位基因,并且可能包含几个相关基因,它们在相同的作用中协同工作,因此需要进行额外的转化和选择轮次,直到每个靶基因都被敲除。可能需要选择性育种才能产生纯合敲除动物。
条件性敲除
[edit | edit source]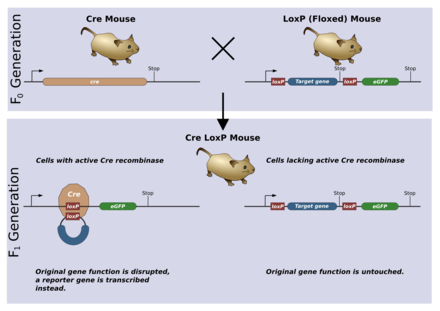
条件性敲除允许以组织或时间特异性方式删除基因。这通常是通过使用Cre/lox系统来实现的。loxP序列将通过与正常敲除相同的机制被引入种系。然后,该种系可以与包含Cre重组酶基因的另一个种系杂交。通常,该基因将受组织特异性启动子或仅在个体发育中特定时间活跃的启动子控制。当Cre表达时,它会重组loxP位点并删除floxed基因。
敲除主要用于通过比较敲除生物体与具有相似遗传背景的野生型来了解特定基因或DNA区域的作用。
敲除生物体也被用作药物开发中的筛选工具,通过使用特定的敲除来靶向特定的生物学过程或缺陷,或者通过使用涵盖整个基因组的敲除生物体库来了解药物的作用机制,例如在酿酒酵母中。
敲入类似于敲除,但它用另一个基因代替了基因,而不是删除它。
生产敲除小鼠的过程
[edit | edit source]生产敲除小鼠的过程有多种变异;以下是一个典型的例子。


- 要敲除的基因是从小鼠基因库中分离出来的。然后,构建一个新的DNA序列,该序列与原始基因及其直接相邻序列非常相似,只是它被改变得足以使基因失活。通常,新的序列还赋予了一个标记基因,该基因是正常小鼠没有的,并赋予对某种有毒物质的抗性或产生可观察到的变化(例如,颜色或荧光)。
- 从小鼠囊胚(非常年轻的胚胎)中分离出干细胞,并在体外培养。对于本例,我们将取自白鼠的干细胞。
- 通过电穿孔将步骤1中的新序列引入步骤2中的干细胞。通过同源重组的自然过程,一些电穿孔的干细胞会将其染色体中的原始基因替换为新的序列,其中包含敲除的基因。成功重组事件的几率相对较低,因此大多数改变的细胞在新序列中只有一个相关染色体 - 据说它们是杂合的。
- 使用步骤1中的标记基因将包含敲除基因的干细胞从未改变的细胞中分离出来。例如,可以使用未改变的细胞对有毒物质敏感,而改变的细胞对该有毒物质有抗性。
- 将步骤4中的敲除干细胞插入小鼠囊胚。对于本例,我们使用来自灰鼠的囊胚。囊胚现在包含两种类型的干细胞:原始干细胞(来自灰鼠)和敲除干细胞(来自白鼠)。然后将这些囊胚植入雌鼠的子宫中,在那里它们发育。因此,新生的小鼠将是嵌合体:它们身体的某些部分来自原始干细胞,其他部分来自敲除干细胞。它们的毛皮将显示出白色和灰色的斑块,白色斑块来自敲除干细胞,灰色斑块来自受体囊胚。
- 一些新生嵌合小鼠的性腺将来自敲除的干细胞,因此会产生包含敲除基因的卵子或精子。当这些嵌合小鼠与野生型小鼠杂交时,它们的后代中会有一些在其所有细胞中都包含敲除基因的一个拷贝。这些小鼠将完全是白色的,并且不是嵌合体,但它们仍然是杂合子。
- 当这些杂合子后代相互交配时,它们的后代中会有一些会从父母双方遗传到敲除基因;它们没有原始未改变基因的功能性拷贝(即,它们是该等位基因的纯合子)。
