生命科学方法与概念/蛋白质的结构与功能
蛋白质是大型生物分子或大分子,由一个或多个氨基酸残基的长链组成。蛋白质在活生物体中执行着各种各样的功能,包括催化代谢反应、复制 DNA、响应刺激以及将分子从一个位置运输到另一个位置。蛋白质之间的主要区别在于它们的氨基酸序列,该序列由其基因的核苷酸序列决定,并且通常会导致蛋白质折叠成特定的三维结构,该结构决定其活性。

大多数蛋白质由从一系列高达 20 种不同的 L-α-氨基酸构建的线性聚合物组成。所有蛋白质基因氨基酸都具有共同的结构特征,包括一个 α-碳,与其相连的是一个氨基、一个羧基和一个可变侧链。只有脯氨酸不同于这种基本结构,因为它在 N 端胺基中含有一个不寻常的环,这迫使 CO–NH 酰胺部分处于固定构象。标准氨基酸的侧链(在标准氨基酸列表中详细说明)具有多种多样的化学结构和性质;正是蛋白质中所有氨基酸侧链的综合效应最终决定了它的三维结构及其化学反应性。多肽链中的氨基酸通过肽键连接。一旦在蛋白质链中连接,单个氨基酸被称为残基,连接的一系列碳、氮和氧原子被称为主链或蛋白质骨架。
肽键具有两种共振形式,它们贡献了一些双键特征并抑制了围绕其轴的旋转,因此 α-碳大致处于共面状态。肽键中的另外两个二面角决定了蛋白质骨架所假设的局部形状。具有游离羧基的蛋白质末端被称为 C 末端或羧基末端,而具有游离氨基的末端被称为 N 末端或氨基末端。蛋白质、多肽和肽这些词语有点模棱两可,并且在含义上可能重叠。蛋白质通常用于指代处于稳定构象中的完整生物分子,而肽通常保留用于指代短氨基酸寡聚体,这些寡聚体通常缺乏稳定的三维结构。然而,两者之间的界限并不明确,通常位于 20-30 个残基附近。多肽可以指代任何单一的线性氨基酸链,通常不考虑其长度,但通常意味着没有定义的构象。

大多数蛋白质折叠成独特的 3 维结构。蛋白质自然折叠成的形状被称为其天然构象。尽管许多蛋白质可以通过其氨基酸的化学性质简单地进行无辅助折叠,但另一些蛋白质则需要分子伴侣的帮助才能折叠成其天然状态。生物化学家通常会提到蛋白质结构的四个不同方面
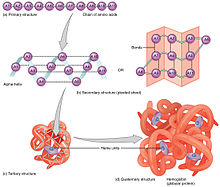
- 一级结构:氨基酸序列。蛋白质是聚酰胺。
- 二级结构:通过氢键稳定的规律重复的局部结构。最常见的例子是 α-螺旋、β-折叠和转角。由于二级结构是局部的,因此同一蛋白质分子中可以存在许多不同二级结构的区域。
- 三级结构*:单个蛋白质分子的整体形状;二级结构之间的空间关系。三级结构通常由非局部相互作用稳定,最常见的是形成疏水核心,但也通过盐桥、氢键、二硫键,甚至翻译后修饰。术语“三级结构”通常用作折叠的同义词。三级结构控制着蛋白质的基本功能。
- 四级结构:由多个蛋白质分子(多肽链)形成的结构,在本例中通常称为蛋白质亚基,它们作为单个蛋白质复合物发挥作用。
蛋白质并非完全是刚性分子。除了这些结构层次之外,蛋白质在执行其功能时可能在几个相关的结构之间转换。在这些功能重排的背景下,这些三级或四级结构通常被称为“构象”,它们之间的转变被称为构象变化。这种变化通常是由底物分子与酶的活性位点结合引起的,或者是由参与化学催化的蛋白质的物理区域引起的。在溶液中,蛋白质也通过热振动和与其他分子的碰撞而发生结构变化。
蛋白质可以非正式地分为三个主要类别,这些类别与典型的三级结构相关:球状蛋白、纤维状蛋白和膜蛋白。几乎所有球状蛋白都是可溶的,许多是酶。纤维状蛋白通常是结构性的,例如胶原蛋白,它是结缔组织的主要成分,或角蛋白,它是头发和指甲的蛋白质成分。膜蛋白通常充当受体或为极性或带电分子通过细胞膜提供通道。
