生命科学方法与概念/载体
在分子克隆中,载体是指一种 DNA 分子,用作载体,人工将外源遗传物质带入另一个细胞,在那里它可以被复制和/或表达。含有外源 DNA 的载体被称为重组 DNA。四种主要类型的载体是质粒、病毒载体、柯斯质粒和人工染色体。其中,最常用的载体是质粒。
载体本身通常是一个 DNA 序列,包含一个插入片段(转基因)和一个更大的序列,作为载体的“骨架”。将遗传信息转移到另一个细胞的载体的目的是通常是将插入片段分离、复制或表达在目标细胞中。
克隆载体用于扩增 DNA 片段。克隆载体的基本特征是复制起点、筛选标记(通常是抗生素抗性)和多克隆位点(MCS 或多连接位点)。多克隆位点是一个包含多个常用限制酶位点的短区域,允许在该位置轻松插入 DNA 片段。除此之外,一些克隆载体还带有其他特征,如报告基因,有助于筛选成功克隆。最突出的例子是 lacZα 基因,它可以用于 α-互补的蓝白筛选。
表达载体用于生产蛋白质。为此,它们必须携带一些额外的特征,最重要的是启动子、核糖体结合位点和终止子。

质粒是存在于几乎所有类型细菌中的染色体外 DNA 分子。最常见的是,它们是双链 DNA 的环状分子,虽然也存在线性质粒。它们的大小可以从几千到几十万个碱基对不等。在自然界中,质粒携带可能有利于生物体生存的基因(例如抗生素抗性),但是它们通常在正常条件下对细菌生长不是必需的。通常,质粒可以通过水平基因转移从一个细菌传递到另一个细菌(即使是不同物种)。人工质粒广泛用作分子克隆中的载体,用于在宿主生物体内驱动重组 DNA 序列的复制。
质粒是复制子,这意味着它们可以自主复制。但是,它们主要依靠宿主细胞的 DNA 复制机制来做到这一点。质粒中复制开始的区域称为复制起点(缩写为 ori 或 rep,有时也称为 oriV 表示营养型复制起点,以区别于转运复制所需的 oriT)。复制起点决定了复制机制,它有两种基本变体。用于复制的蛋白质通常编码在 ori 附近。除此之外,ori 也是决定质粒其他特性的关键因素,例如拷贝数、宿主范围和不相容性组。
最常见的复制机制被称为 θ 复制。它从 ori 区域两条链的分离开始,形成一个类似于希腊字母 θ(θ)的结构。复制从 RNA 引物开始,然后沿质粒单向或双向进行。当复制叉再次到达 ori 时(单向)或两个复制叉相遇时(双向),DNA 分子分离。
质粒 ColE1 和许多从该质粒中获得 ori 的克隆载体表现出这种机制。
滚环复制是另一种广泛存在的复制机制。在这种情况下,复制包括两个阶段:首先,DNA 复制形成双链和单链环状 DNA。之后,在单链 DNA 上添加互补链,形成两个双链质粒。
滚环复制由质粒编码的 Rep 蛋白启动。它与质粒的双链复制起点 (DSO) 结合,这可能使 DNA 形成十字形结构。然后,该蛋白切割其中一条链并在切口链的 5' 磷酸末端共价结合。释放的游离 3' 羟基末端作为 DNA 聚合酶 III 的 DNA 合成的引物。以未切割链为模板,复制沿质粒进行,将切割链置换为单链 DNA。一旦这个单链环完成,与 Rep 相连的 5' 末端和置换的 3' 末端在一个磷酸转移反应中连接起来。当 DNA 聚合酶返回 DSO 时,双链环也闭合。这可能涉及创建第二个切口和宿主 DNA 连接酶。
置换单链的复制从单链复制起点 (SSO) 开始,该起点仅在置换几乎完成时才合成。在 SSO 处,RNA 聚合酶为 DNA 聚合酶 III 制造引物,DNA 聚合酶 III 合成互补链。一旦完成,DNA 聚合酶 I 替换 RNA 引物,DNA 连接酶连接末端。

每个细胞中特定质粒的数量是一个特征,主要由复制起点决定。它可以从每个细胞一个到每个细胞几百个相同质粒不等。天然质粒往往具有较低的拷贝数,但可以通过突变和消除控制机制大幅增加。控制拷贝数对质粒来说非常重要。一方面,它们必须跟上宿主细胞的复制。另一方面,它们不应该成为宿主过大的负担。高拷贝数质粒只需要一种机制来应对后者,这意味着一旦达到一定的拷贝数,复制应该被抑制。这种质粒被称为松弛型质粒。相反,严格型质粒具有较低的拷贝数,因此需要更严格的控制机制。
带有 ColE1 复制起始点的质粒的拷贝数受两种 RNA 转录本,RNA II 和 RNA I 的调控。RNA II 对于复制起始是必需的,而 RNA I 则作为其抑制剂。
新生的 RNA II,其转录起始于复制起始点上游 555 bp,与复制起始点附近的模板 DNA 形成杂交体。RNase H 切割 RNA 链并暴露 3' 羟基。然后,加工后的 RNA II 可以作为 DNA 聚合酶 I 进行 DNA 合成的引物。
引物形成受到 RNA I 的抑制,RNA I 是一种较短的转录本,与 RNA II 的 5` 末端互补。当存在 RNA I 时,它与 RNA II 形成杂交体。这改变了 RNA II 的折叠,使得 DNA-RNA 杂交体不稳定,切割不会发生。因此,RNA I 的降解速率是控制质粒复制的主要因素。这种降解速率在 pcnB(质粒拷贝数 B)基因产物的帮助下加速,该产物在 RNA I 的 3' 末端添加聚腺苷酸,使其成为 PNPase 降解的目标。
rop 蛋白增强了 RNA I 与 RNA II 的结合。因此,删除相应基因会增加质粒拷贝数。

宿主范围
[edit | edit source]质粒可以复制的细菌类型称为其宿主范围。它通常由复制起始点决定。带有 ColE1 复制起始点的质粒宿主范围狭窄,它们只能在大肠杆菌和一些密切相关的物种中复制。与此相反,广宿主范围质粒可以在许多仅远缘相关的细菌中复制。这些质粒编码复制起始所需的所有蛋白质,因此在这方面独立于宿主细胞。此外,它们的启动子和核糖体结合位点在许多细菌中被识别。
确定质粒的宿主范围可能具有挑战性,尤其是在转化和筛选方面。因此,大多数质粒的实际宿主范围是未知的。
不相容性
[edit | edit source]当两个质粒不能稳定地共存于同一个细胞中时,它们是不相容的。这适用于具有相同复制起始点的质粒,因为它们争夺复制因子。如果一个复制速度更快(例如,因为它更小)或具有不同的生长优势,它将在多个世代中超过另一个。在细胞分裂过程中,两个质粒的不均匀分布也会导致其中一个被消除。
通过分析当两个特定质粒存在于同一个细胞中时,消除概率是否增加,可以将质粒分配到不相容性 (Inc) 类群中。虽然同一 Inc 类群的成员不能长期共存,但来自不同类群的质粒可以稳定共存,并且不会比在不存在另一个质粒的情况下更容易被消除。
分配和质粒维持
[edit | edit source]质粒对宿主细胞来说是一种代谢负担。因此,无质粒细胞通常具有生长优势,并且从长远来看,将取代含有质粒的细胞。为了避免这种情况,已经进化出不同的机制来提高质粒的分离稳定性,即质粒从一个世代细胞传到另一个世代细胞的可能性。不要与结构稳定性混淆,结构稳定性指的是核苷酸序列的保存。
随机分配
[edit | edit source]在最简单的情况下,质粒被随机传到子细胞。拷贝数越高,两个细胞都继承质粒的可能性越大。然而,当拷贝数较低时,无质粒细胞可能会发育并超过其他细胞,除非其他机制阻止这种情况发生。
主动分配
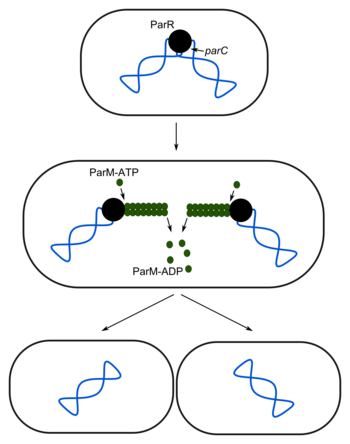
[edit | edit source]确保两个细胞在细胞分裂过程中都收到质粒拷贝的一个有效方法是分配系统。这种系统可以在每个细胞中只存在一个或很少几个拷贝的质粒上找到。它们的复制以类似于染色体的方式控制,这意味着质粒在每次染色体复制启动时都会复制。最容易理解的例子是大肠杆菌 R1 质粒的 Par 系统。
该系统由 ParR 和 ParM 蛋白以及质粒上的parC位点组成。复制后,ParR 与质粒的parC位点相互作用,形成一个分配复合体。ParM-ATP 结合该复合体并形成一个细丝,将质粒推向两极。ATP 被水解,ParM-ADP 解聚,使质粒位于相对的两极。
选择性优势
[edit | edit source]许多质粒至少携带一个基因,为宿主提供选择性优势。最常见的是抗生素抗性。另一种可能性是质粒包含一个重要的基因,该基因在宿主的染色体中发生突变或缺失。在相应的选择压力下,细胞会保留这些质粒,因为被消除的细胞生长缓慢或死亡。
成瘾系统
[edit | edit source]一些质粒包括一个系统,如果细胞在细胞分裂过程中没有继承质粒,就会杀死细胞。这些毒素-抗毒素系统由两个或多个紧密连接的基因组成,这两个基因既编码“毒药”,也编码相应的“解毒剂”。如果质粒在细胞分裂后不存在,不稳定的抗毒素会被降解,稳定的毒蛋白会杀死新细胞。这被称为分裂后杀伤 (PSK)。
一些毒素-抗毒素系统依赖于互补抗毒素 RNA 与毒素 mRNA 的碱基配对。然后通过 RNase III 降解或通过遮蔽 Shine-Dalgarno 序列或核糖体结合位点来抑制 mRNA 的翻译。通常,毒素和抗毒素编码在 DNA 的相反链上。
在其他系统中,不稳定的蛋白质抗毒素紧密结合并抑制稳定的毒素的活性。一个例子是大肠杆菌 F 质粒中发现的 CcdA/CcdB 系统。CcdB 靶向 DNA 旋转酶并抑制染色体 DNA 的分配。只要细胞包含 F 质粒,CcdB 就被 CcdA 结合并中和。失去质粒后,CcdA 衰变,CcdB 的活性杀死细胞。
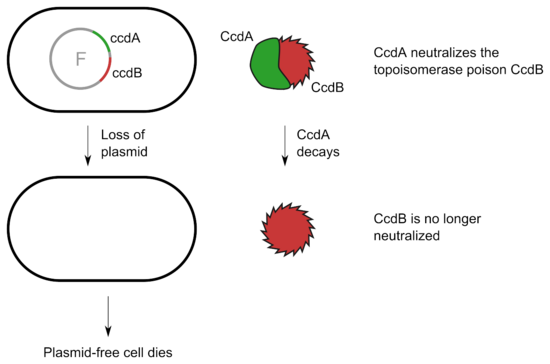
在生物技术中,毒素-抗毒素系统可用于维持细菌培养物中的质粒。此外,它们可用于分子克隆,以正向筛选已吸收包含插入片段的质粒的细胞。这种应用的一个例子来自ccdB基因,该基因已被整合到质粒载体中。然后将目的基因靶向重组到ccdB基因座中,使毒蛋白的转录失活。因此,含有质粒但不含插入片段的细胞因 CcdB 蛋白的毒性作用而死亡,只有那些整合了插入片段的细胞才能存活。
多聚体质粒的分辨
[edit | edit source]质粒可以形成二聚体或更高聚体,这会降低有效拷贝数,从而增加细胞在细胞分裂过程中没有收到质粒的风险。二聚体可能是两个单体的重组结果。随后的重组可以形成更高的聚体。为了避免聚体的积累,许多质粒具有位点特异性重组系统,可以解析聚体。这些系统由可能由宿主或质粒编码的蛋白质以及质粒上的特定位点组成。在二聚体或聚体中,重组位点出现多次。然后该系统促进这些位点之间的重组,将聚体旋转成单体质粒。
一个众所周知的例子是 ColE1 使用的cer-XerCD 系统。cer是质粒上的重组位点,而 XerC 和 XerD 是大肠杆菌位点特异性重组系统的一部分。只有当两个其他宿主蛋白 PepA 和 ArgR 结合在它附近时,cer位点才会被识别。如果是这种情况,XerCD 重组酶可以促进两个cer位点之间的重组。
质粒DNA可能以五种构象之一出现,这五种构象在电泳过程中以不同的速度在凝胶中运行(对于给定大小)。以下列出这些构象,按电泳迁移率(给定电压下速度)从最慢到最快排列
- 切开的开环DNA 有一条链断裂。
- 松弛环状DNA 完整无缺,两条链都未断裂,但已通过酶促方式松弛(超螺旋被去除)。
- 线性DNA 具有游离末端,要么是因为两条链都被切断,要么是因为DNA在体内是线性的。
- 超螺旋(或共价闭合环状)DNA 完整无缺,两条链都未断裂,并且具有一个完整的扭转,形成紧凑的结构。
- 超螺旋变性DNA 与超螺旋DNA类似,但具有未配对的区域,使其略微不太紧凑;这可能是由于质粒制备过程中碱性过强造成的。

质粒是遗传工程中最常见的载体。它们是遗传学和生物技术实验室的重要工具,在这些实验室中,它们通常用于复制或表达特定的基因。许多质粒可用于此类用途。
高拷贝数质粒适合作为克隆载体。另一方面,表达载体可以是低拷贝数质粒,因为重点是生产蛋白质而不是DNA。
pBR322 和 pUC19 是常见的克隆载体的例子。pBR322 是在 1977 年创建的,是第一个广泛使用的大肠杆菌克隆载体之一。它以建造它的墨西哥博士后研究人员的名字命名。p 代表“质粒”,BR 代表“Bolivar”和“Rodriguez”。pBR322 长 4361 个碱基对,包含 pMB1 的 ori,pMB1 是 ColE1 的近亲。它编码两种蛋白质,使大肠杆菌对氨苄青霉素和四环素产生抗性,并且具有超过 40 种限制性内切酶的独特限制性位点。
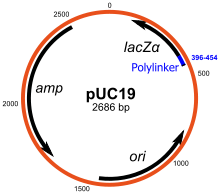
pUC19 是最广泛使用的质粒载体之一。它包含一个氨苄青霉素抗性基因(ampR)和lacZα片段,用于蓝白筛选。ori 位点来自 pMB1。pUC 体积小,但拷贝数高,这是由于缺乏rop基因和 pMB1 的 ori 中的一个点突变导致的。pUC18 是另一个流行的克隆载体,它与 pUC19 的区别仅在于 MCS 的方向。
噬菌体或噬菌粒是一种质粒,它包含来自 f1 噬菌体的 f1 复制起点。许多常用的质粒包含 f1 ori,因此是噬菌体。f1 ori 使单链复制和包装成噬菌体颗粒成为可能。然而,噬菌体也包含一个双链复制的复制起点,这意味着它们可以作为质粒复制。
与质粒类似,噬菌体可用于克隆 DNA 片段并将其导入细菌宿主。然而,用“辅助”噬菌体(例如 VCSM13 或 M13K07)感染含有噬菌体的细菌宿主,可提供必要的病毒成分,从而实现单链 DNA 复制和将噬菌体 DNA 包装成噬菌体颗粒。丝状噬菌体抑制细菌生长,但与 λ 噬菌体和 T7 噬菌体相比,通常不是裂解性的。辅助噬菌体通常经过工程改造,其包装效率低于噬菌体(通过有缺陷的噬菌体 ori),因此产生的噬菌体颗粒主要含有噬菌体 DNA。F1 丝状噬菌体感染需要存在菌毛,因此只有含有 F 质粒或其衍生物的细菌宿主才能用于生成噬菌体颗粒。
在循环测序技术开发之前,噬菌体用于生成用于测序的单链 DNA 模板。如今,噬菌体仍然对生成用于定点诱变的模板很有用。对丝状噬菌体生命周期和结构特征的详细表征导致了噬菌体展示技术的开发,在这种技术中,可以将一系列肽和蛋白质表达为噬菌体衣壳蛋白的融合体,并在病毒表面展示。展示的肽和多肽与噬菌体颗粒中相应的编码 DNA 相关联,因此该技术适用于研究蛋白质-蛋白质相互作用和其他配体/受体组合。
宇宙是一种混合质粒,包含一个 λ 噬菌体cos 序列(cos 位点 + 质粒 = 宇宙)。如果宇宙具有合适的复制起点,它们可以作为质粒复制:例如,哺乳动物细胞中的 SV40 ori,原核生物中的 ColE1 ori 用于双链 DNA 复制,或 f1 ori 用于单链 DNA 复制。与质粒不同,它们也可以包装在噬菌体衣壳中,这使得外源基因可以通过转导转移到细胞中或细胞之间。
当一定量的 DNA 被插入质粒后,质粒会变得不稳定,因为它们增大的尺寸更有利于重组。为了避免这种情况,使用噬菌体转导。这是由粘性末端(也称为cos位点)实现的。这样,它们类似于使用 λ 噬菌体作为载体,不同之处在于,除了cos序列之外,所有 λ 基因都被删除了。宇宙可以包含 37 到 52(通常为 45)kb 的 DNA,限制基于正常的噬菌体包装大小。宇宙可用于构建基因组文库。
细菌人工染色体 (BAC) 基于功能性育性质粒(或 F 质粒),用于细菌中的转化和克隆。F 质粒起着至关重要的作用,因为它们包含分区基因,这些基因促进了细菌细胞分裂后质粒的均匀分布。细菌人工染色体通常的插入大小为 150-350 kb。从细菌 P1 质粒中也产生了类似的克隆载体,称为 PAC。
BAC 在人类基因组计划等基因组计划中经常使用。在此过程中,生物体 DNA 的一小段作为 BAC 中的插入物进行扩增,然后测序。最后,测序的片段在计算机中重新排列,从而得到生物体的基因组序列。BAC 被更快速、更省力的测序方法(如全基因组鸟枪法测序)所取代,最近则是下一代测序。
酵母人工染色体 (YAC) 是从酿酒酵母的 DNA 中衍生出的基因工程染色体,然后将其连接到细菌质粒中。通过插入 100-1000 kb 的大片段 DNA,可以克隆插入的序列,并使用染色体行走进行物理作图。这是最初用于人类基因组计划的过程,但由于稳定性问题,YAC 被细菌人工染色体的使用所取代。从 Rankin 等人的初步研究开始,Strul 等人和 Hsaio 等人,通过发现必要的自主复制序列 (ARS) 稳定了固有的脆弱染色体;Murray 等人在 1983 年描述了一种利用这些数据的精炼 YAC。YAC 的主要组成部分是来自酿酒酵母的 ARS、着丝粒和端粒。此外,使用可选择的标记基因,例如抗生素抗性和可见标记,来选择转化的酵母细胞。如果没有这些序列,染色体在细胞外复制过程中将不稳定,并且将无法与没有载体的菌落区分开来。
酵母表达载体,例如 YAC、YIp(酵母整合质粒)和YEp(酵母游离质粒),比细菌人工染色体具有优势,因为它们可以用于表达需要翻译后修饰的真核蛋白。由于能够插入大的 DNA 片段,因此 YAC 可用于克隆和组装生物体的整个基因组。将 YAC 插入酵母细胞后,它们可以作为线性人工染色体进行繁殖,在此过程中克隆插入的 DNA 区域。
氨苄青霉素属于青霉素类β-内酰胺类抗生素,能够穿透革兰氏阳性菌和一些革兰氏阴性菌。它与青霉素G或苄青霉素的区别仅在于存在一个氨基。该氨基帮助药物穿透革兰氏阴性菌的外膜。
氨苄青霉素作为一种不可逆的转肽酶抑制剂,而转肽酶是细菌合成细胞壁所需的。它抑制细菌细胞壁合成的第三阶段和最后阶段,即二元分裂,最终导致细胞裂解。氨苄青霉素具有杀菌作用。
对氨苄青霉素的耐药性是由amp或bla基因赋予的,该基因编码一种β-内酰胺酶。β-内酰胺酶通过破坏抗生素的结构来提供对β-内酰胺类抗生素的耐药性。

在大肠杆菌中,β-内酰胺酶分泌到周质空间,并可释放到培养基中,在那里它会迅速降解氨苄青霉素。在平板上,当氨苄青霉素浓度过低时,会形成卫星菌落。
卡那霉素是一种氨基糖苷类杀菌抗生素,它与原核生物核糖体的30S亚基相互作用。它诱导大量错误翻译,并在蛋白质合成过程中间接抑制转运。
对卡那霉素的耐药性是由来自转座子Tn5的npt II基因(也称为kan或neo)赋予的,该基因编码新霉素磷酸转移酶。
链霉素是第一个被发现的氨基糖苷类抗生素,也是第一个治疗结核病的药物。链霉素抑制革兰氏阳性菌和革兰氏阴性菌的蛋白质合成。它结合到细菌核糖体30S亚基的小16S rRNA上,干扰甲酰甲硫氨酰-tRNA与30S亚基的结合。这导致密码子错误解读,最终抑制蛋白质合成,并最终导致微生物细胞死亡。
氯霉素是一种对多种革兰氏阳性菌和革兰氏阴性菌(包括大多数厌氧生物)有效的抑菌抗生素。它通过抑制细菌核糖体的肽酰转移酶活性来阻止蛋白质链延伸。
cat 基因赋予对氯霉素的耐药性。该基因编码一种名为氯霉素乙酰转移酶的酶,该酶通过将一个或两个乙酰基(来自乙酰基-S-辅酶A)共价连接到氯霉素分子上的羟基上,使氯霉素失活。乙酰化阻止了氯霉素与核糖体结合。
四环素是一种抑菌抗生素,它通过阻止带电氨酰基-tRNA与核糖体上的A位点结合来抑制蛋白质合成。四环素结合到微生物核糖体的30S亚基上。因此,它阻止了新的氨基酸引入新生肽链。该作用通常是抑制作用,并在撤回药物后可逆。尽管四环素结合到原核生物和真核生物的小核糖体亚基(分别为30S和40S),但哺乳动物细胞对四环素的影响不太敏感。这是因为细菌积极地将四环素泵入它们的细胞质,而哺乳动物细胞则不这样做。
分子生物学中使用了几种耐药基因,最常见的是tetA、tetB和tetC,它们编码一个外排系统,即一种与膜相关的蛋白,它主动地将四环素从细胞中排出。这些基因受阻遏蛋白(TetR)的调控。这一特性已被用于控制基因表达(Tet-On和Tet-Off)。

β-半乳糖苷酶是由lac操纵子的lacZ 基因编码的蛋白质,它以四聚体形式存在于其活性状态。然而,源自大肠杆菌M15菌株的突变β-半乳糖苷酶的N端残基11-41被删除,这种突变体,即ω-肽,不能形成四聚体,并且是无活性的。然而,这种突变体可以在存在蛋白质的N端片段,即α-肽的情况下,完全恢复到其活性的四聚体状态。突变β-半乳糖苷酶的α-肽挽救功能被称为α-互补。
在这种筛选方法中,宿主大肠杆菌菌株携带lacZ缺失突变体(lacZΔM15},其中包含ω-肽,而使用的质粒携带lacZα序列,该序列编码β-半乳糖苷酶的前59个残基(α-肽)。两者本身都不是功能性的。然而,当两种肽一起表达时,例如当含有lacZα序列的质粒转化到lacZΔM15细胞中时,它们会形成功能性的β-半乳糖苷酶。
蓝白筛选方法通过破坏这种α-互补过程来起作用。质粒在lacZα序列内有一个内部多克隆位点。将插入片段整合到MCS中会破坏基因,因此不会产生功能性的α-肽。因此,在含有带有插入片段的质粒的细胞中,不会形成功能性的β-半乳糖苷酶。
可以通过X-gal检测到活性β-半乳糖苷酶的存在,X-gal是一种无色的乳糖类似物,可以被β-半乳糖苷酶裂解形成明亮的蓝色不溶性色素。这导致含有功能性β-半乳糖苷酶的细胞呈现出特征性的蓝色。因此,蓝色菌落表明它们可能含有具有完整lacZα的载体(因此没有插入片段),而白色菌落(X-gal不被水解)表明lacZα中存在插入片段,破坏了活性β-半乳糖苷酶的形成。
立即早期巨细胞病毒启动子可用于在多种哺乳动物细胞系中进行高水平表达。
SV40(猿猴病毒40)启动子包含SV40增强子启动子区域和复制起点,用于在表达大T抗原的细胞系中进行高水平表达和复制。它包含两个72 bp SV40增强子重复序列。
EF-1α 启动子是一个强效的、组成型的、非病毒启动子。EF-1α 基因编码延伸因子-1α,它催化氨酰-tRNA 与核糖体的 GTP 依赖性结合。EF-1α 是真核细胞中最丰富的蛋白质之一,几乎在所有哺乳动物细胞中表达。
UbC(人泛素C)启动子在广泛的物种和组织类型中提供高水平的表达。在 HEK293 细胞中,它通常具有 CMV 和 EF-1α 启动子约 50% 的活性。
PGK(鼠磷酸甘油酸激酶-1)启动子是一个普遍存在的管家基因启动子,它促进长期持续表达。

Kozak 共识序列是真核 mRNA 上出现的一个序列,它在翻译起始过程中起着重要作用。它的共识序列为(gcc)gccRccAUGG. 小写字母表示该位置最常见的碱基,尽管碱基可能有所不同,但大写字母表示高度保守的碱基。括号中的序列意义不明确。AUG 核苷酸是起始密码子,编码蛋白质 N 端的甲硫氨酸氨基酸。
核糖体需要这个序列,或可能的变体来启动翻译。变体可能会影响从 mRNA 合成的蛋白质数量。
Kozak 序列不要与核糖体结合位点 (RBS) 混淆。
G418(遗传霉素)是一种氨基糖苷类抗生素,通过抑制原核和真核细胞中延伸步骤来阻止多肽合成。对 G418 的抗性是由 Tn5 中的 neo 基因赋予的,该基因编码氨基糖苷 3'-磷酸转移酶 APT 3' II。G418 通常用于实验室研究,以选择基因工程细胞(通常使用 KanMX 可选择标记)。一般来说,对于细菌和藻类,使用 5 mg/L 或更低的浓度,对于哺乳动物细胞,选择使用约 400 mg/L 的浓度,维持使用 200 mg/L 的浓度。然而,哺乳动物细胞中抗性克隆选择的最佳浓度取决于所使用的细胞系以及携带抗性基因的质粒,因此应进行抗生素滴定以找到每个实验系统的最佳条件。
杀稻瘟菌素 S 阻止真核和原核细胞的生长。它通过抑制翻译的终止步骤(以及在较小程度上抑制核糖体形成的肽键)发挥作用。最常见的抗性基因是 bsr 和 bsd,它们都编码脱氨酶。
潮霉素 B 是一种由细菌 链霉菌 hygroscopicus 产生的抗生素。它是一种氨基糖苷类,通过抑制蛋白质合成杀死细菌、真菌和高等真核细胞。它稳定 tRNA-核糖体受体位点,从而抑制转运。抗性基因(hyg 或 hph)是一种激酶,通过磷酸化使潮霉素 B 失活。
嘌呤霉素是一种氨基核苷类抗生素,衍生自 链霉菌 alboniger 细菌,它在核糖体发生的翻译过程中引起过早的链终止。该分子的一部分类似于氨酰化 tRNA 的 3' 端。它进入 A 位点并转移到生长的链上,导致形成嘌呤霉酰化的新生链和过早的链释放。
对嘌呤霉素的抗性是由 pac 基因赋予的,该基因编码一种嘌呤霉素 N-乙酰转移酶 (PAC),该酶是在 链霉菌 生产菌株中发现的。嘌呤霉素在水中的溶解度为 50 mg/ml,在 10 mg/ml 时为无色溶液。在 -20 °C 下储存时,嘌呤霉素溶液可稳定一年。作为细胞培养中选择剂的推荐剂量范围为 1-10 μg/ml,尽管在低至 1 μg/ml 的浓度下它可能对真核细胞有毒。嘌呤霉素作用迅速,可在 2 天内杀死多达 99% 的非抗性细胞。
杀稻瘟菌素是一种糖肽类抗生素,是来自 链霉菌 verticillus 的弗莱霉素之一,属于博来霉素类抗生素家族。它是一种广谱抗生素,对大多数细菌、丝状真菌、酵母菌、植物和动物细胞有效。它通过插入 DNA 引起细胞死亡,并诱导 DNA 的双链断裂。
对杀稻瘟菌素的抗性是由首先从 链霉菌 hindustanus 中分离出的 Sh ble 基因的产物赋予的。Sh ble 基因产物以一对一的比率结合抗生素,因此它不再能引起 DNA 的裂解。
- Addgene 是一个非营利性的全球质粒库。Addgene 通过存储质粒及其相关的克隆数据来促进实验室之间遗传物质的交换。
- The PlasMapper 服务器仅使用质粒 DNA 序列作为输入,自动生成和注释质粒图。
- SnapGene Viewer 可用于查看和创建富含注释的质粒图。
- Dale, J., Park, S.F., 2004. 细菌的分子遗传学,第 4 版。Wiley,奇切斯特。
- Snyder, L., 2013. 细菌的分子遗传学,第 4 版。ASM 出版社,华盛顿特区。
