NCEA 1 级科学/物质结构

所有物质都是由非常小的粒子组成的,这些粒子被称为原子。原子这个名字来自希腊语,意思是不可切割,即无法进一步分割的东西。原子是元素的基本组成部分。
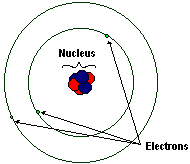
原子有三种亚原子粒子
- 质子 (+): 带正电荷
- 电子 (-): 带负电荷
- 中子 (0): 不带电荷
它们有时可以写成 (质子), (电子) 和 (中子)
通常,原子不带总电荷(中性),因为带正电荷的质子数量等于带负电荷的电子数量。中子的数量往往会有所不同,例如氢原子中没有中子。具有相同质子数量但质量不同的原子被称为同位素。

中子在原子的功能中起着非常重要的作用。在原子核中,几个质子紧密地聚集在一起。由于异性相吸,同性相斥,通常质子会相互排斥并使原子核散开。然而,存在一种强核力将原子核束缚在一起。这种不可思议的力量导致核子(质子和中子)相互吸引的力量比电磁力排斥它们的力量大得多,但只在极短的距离内有效。
质子和中子的数量之间存在微妙的平衡。质子通过强核力相互吸引,但也同时受到其电磁电荷的排斥,因此在原子核中不能大量存在,除非有中子的稳定作用,中子通过强核力相互吸引,但没有电荷。相反,中子会将自身的固有失稳性传递给原子核,过多的中子会使原子核失稳。
屏蔽(或筛选)效应类似于有效核电荷。内层电子在一定程度上排斥价电子(最外层电子)。电子层越多(元素周期表每行对应一个新层),屏蔽效应就越大。本质上,内层电子屏蔽了价电子免受原子核正电荷的影响。
原子序数是原子核中质子的数量。原子序数决定了原子属于哪个元素。元素周期表上的元素是根据它们的原子序数排列的。每个元素都有一个独特的识别符号。
如果用中子或加速器中的带电粒子轰击重金属,如果质子数量增加,则原子序数也会增加。这就是创造新的被称为超铀元素的人造元素的方法,即元素周期表上大于 92 的元素。
质量数是原子中质子和中子数量的总和。
| 原子的质量数与元素的原子质量之间存在差异。质量数测量的是特定原子的原子核中质子和中子的数量。原子质量测量的是元素所有原子的平均质量。例如,碳原子的质量数可能是 12 或 14(或其他值),但碳的整体质量为 12.011 amu。 |
镁的原子质量为 24.3051,但其质量数为 24。
元素是一种只包含相同类型原子的物质。也就是说,原子具有相同的质子数量。
在原子核内部,存在质子和中子。电子绕着原子核运行,排列在不同的能级或电子层上。对于前 20 种元素,每个电子层的最大电子构型为
- 第 1 电子层:2
- 第 2 电子层:8
- 第 3 电子层:8
- 第 4 电子层:2(剩余电子)
电子排布告诉我们每个电子层可以容纳多少个电子。
- 示例
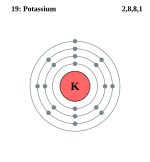
K(钾;原子序数:19)的电子构型为 2,8,8,1。
这告诉我们第 1 电子层上有 2 个电子,第 2 电子层上有 8 个电子,第 3 电子层上有 8 个电子,第 4 电子层上有 1 个电子。
另一种计算前 20 种元素的电子构型的方法是查看元素周期表。元素周期表上的行称为周期,列称为族。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 H |
2 He | ||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 55 Cs |
56 Ba |
57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 87 Fr |
88 Ra |
89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn | ||||||
| 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||
| 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||
要查看更完整的元素周期表,请查看这个元素周期表。 |
要计算电子的排列,我们可以放心地假设前 20 个元素的周期数等于它具有的电子层数。我们也可以假设每个周期中元素的数量等于每个电子层中的电子数量。
- 示例
Cl(氯;原子序数:17)位于第7族或第17族,位于第3周期。因此,它有 3 个电子层,最外层有 7 个电子。它的电子构型是 2,8,7。

元素所在的族(列)可以决定其反应性。第 18 族元素具有完整的价电子,因此它们不活泼或稳定。它们不会形成像 O2 或 CO2 这样的化合物。另一方面,第 1 族和第 17 族非常活泼,因为它们只有一个价电子,很容易失去,因此第 1 族和第 17 族元素在自然界中从未单独存在过——它们总是以化合物形式存在,例如 H2 和 Cl2。第 2 族和第 16 族略微活泼,在自然界中也以化合物形式存在。
| +1 | +2 | +3 | -2 | -1 |
|---|---|---|---|---|
| NH4+ | Ca 2+ | Al3+ | O2- | OH- |
| Na+ | Mg2+ | Fe3+ | S2- | Cl- |
| K+ | Cu2+ | CO32- | NO3- | |
| Ag + | Pb 2+ | SO42- | HCO3- | |
| H+ | Fe 2+ | |||
| Ba2+ | ||||
| Zn 2+ |
离子是获得或失去电子的原子或原子团。结果是它们变成了带电粒子。
元素周期表分为两组:金属和非金属。金属位于左侧,非金属位于右侧。中间的元素是金属,但被称为过渡金属。金属会带正电荷,被称为阳离子。非金属会带负电荷,被称为阴离子。失去一个电子的金属将拥有比电子更多的质子,因此它们会形成正离子,例如 H+ 和 Al3+。而获得电子的非金属将拥有比质子更多的电子,因此它们会形成负离子,例如 Cl- 和 HCO3-。
- 在一个化学反应中,氢原子失去它唯一的电子形成一个包含 1 个质子和 0 个电子的离子。该氢离子 (H+) 带有 +1 的电荷,因为有一个质子而没有电子来平衡电荷。
- 一个氯 (2,8,7) 原子获得一个电子形成一个包含 17 个质子和 18 个电子的离子。该氯离子 (Cl-) 带有 -1 的电荷,因为有 17 个质子而有 18 个电子。电子数量比质子数量多一个。
- 通常,一个钠原子 (2,8,1) 在最外层有一个电子。在一个化学反应中,它将失去这个电子形成一个 Na+ 离子 (2,8)。
- 氧 (2,6) 在一个化学反应中将获得 2 个电子来填满其最外层。它将形成 O2+ 离子。
原子希望具有完整的价能级,这样它就会变得不活泼并稳定。这可以通过在化学反应中获得或失去电子来实现。化学反应不仅仅发生在科学实验室中。第 1 族和第 17 族元素在自然界中并不存在。将第 1 族元素,如钠,暴露在大气中(包含 78% 氮气、21% 氧气、0.9% 氩气和 0.03% 二氧化碳)或专门暴露在氧气中,会导致立即的氧化反应。
| 失去电子 | 正离子 |
|---|---|
| 获得电子 | 负离子 |
离子的反应性和电荷与其在元素周期表中的位置有关。
- 第 1 族金属在最外层有一个电子,因此它们非常活泼,会失去这个电子形成 +1 的正离子,例如 Li+ 和 Na +。
- 第 2 族金属在最外层有两个电子,因此它们略微活泼,会失去这两个电子形成 +2 的正离子,例如 Be2+ 和 Mg2+。
- 第 16 族非金属在最外层有 6 个电子,因此它们略微活泼,会获得 2 个电子形成 -2 的负离子,例如 O2-、S2-。
- 第 17 族非金属在最外层有 7 个电子。它们非常活泼,会获得 1 个电子形成 -1 的负离子,例如 F-、Cl-。
- 第 18 族非金属拥有完整的最外层。它们不活泼,不会形成离子,例如 He、Ne、Ar。
| 元素 | 电子排列 | 电荷 |
|---|---|---|
| 氢 | H +1 | |
| 氦 | He 0 | |
| 锂 | Li +1 | |
| 铍 | Be +2 | |
| 氧 | O -2 | |
| 氟 | F -1 | |
| 氖 | Ne O |

当一个正离子(金属)和一个负离子(非金属)化学结合时,就会形成一个离子化合物。这个过程是反应物 → 产物。
有两种类型的方程式
- 文字方程式
- 化学方程式
文字方程式涉及识别反应物和产物。化学方程式涉及使用文字和符号来写出你的方程式。在考试中,一定要仔细阅读你的问题,并写下要求的方程式类型。
- 示例
- 文字方程式:镁 + 氧气 → 氧化镁
- 化学方程式:Mg2+ + O2- → MgO

要写出离子化合物的化学式,可以使用交叉相乘规则。
步骤:
1. 在离子表上找到离子,然后去掉 + 和 - 符号。
2. 如果数字相同,则互相抵消。
3. 如果数字不同,则将它们移到另一边并交叉相乘。
4. 如果数字被移到化合物上,则需要插入括号。
| 化合物名称 | 寻找离子电荷 | 交叉相乘后的数字 |
|---|---|---|
| 氧化镁 | Mg2+ + O2- | MgO |
| 氢氧化铝 | Al3+ + OH- | (Al(OH))3 [不平衡] |
| 硝酸钾 | K+ + NO3- | KNO3 |
| 氯化钙 | Ca2+ + Cl- | CaCl2 [不平衡] |
| 硝酸锌 | Zn2+ + NO3- | Zn[(NO3)]2 [不平衡] |
| 硫酸钠 | Na+ + SO42- | Na2SO4 [不平衡] |

当两种或多种元素结合在一起时,就会形成化合物,例如 CaCl2。化学式中的下标数字表示每个元素存在的原子数量。
- 示例
-
- Ca(Cl)2 - 1 个 Ca、2 个 Cl
- Mg(OH)2 - 1 个 Mg、2 个 H、2 个 O
系数表示该化合物有多少个分子。要计算每个元素存在的原子数量,需要将系数乘以原子数量。
- 示例
-
- 3Cu(SO)4 - 3 个 Cu、3 个 S、12 个 O
- 2CO2 - 2 个 C、4 个 O
- 5H2SO4 - 10 个 H、5 个 S 和 20 个 O
- 3Cu(OH)2 - 3 个 Cu、6 个 O、6 个 H




