OCR 高级普通教育证书化学/元素周期表:过渡元素

过渡元素被定义为d区元素,形成一个或多个具有未填满d轨道的稳定离子。
如果我们看一下一些过渡元素的电子构型示例,我们可以看到它是如何工作的
钪 (Sc) - [Ar] 3d1 4s2
钛 (Ti) - [Ar] 3d2 4s2
记住电子首先从4s亚层移除
钛可以形成2+、3+(和4+),它们都导致具有未填满d轨道的离子
然而,钪只形成3+离子,并且它们具有空的d亚层。因此,钪不被归类为过渡元素。锌也是如此,因为它只形成2+离子,从4s亚层失去两个电子并保持完整的d亚层。
因此,现在我们在第4族过渡元素的3d亚层中形成了一个电子数递增的良好模式。然而,一如既往,此规则也存在例外情况
人们期望铬具有如下电子结构
[Ar] 3d4 4s2
但实际上它的结构是
[Ar] 3d5 4s1
这是因为半满亚层和完全填满的亚层最稳定,因此它们更受青睐。铜也是如此
[Ar] 3d10 4s1
其中具有完整的d亚层比在4s亚层中具有9个电子和2个电子更受青睐
过渡元素可以形成多种氧化态的化合物。大多数元素只形成一种氧化态的化合物,因此过渡元素很少见。发生这种情况的原因与4s亚层之间以及d亚层内的能级有关;它们都非常相似,因此多个电子的移动不需要太多能量。
铁和铜化合物的氧化态主要(必须知道的)如下
Fe +2 +3 +4 +5 +6
Cu +1 +2 +3
最常见的氧化态以粗体显示
过渡金属离子在水溶液中是有色的,因为它们具有部分填充的d轨道(这在过渡元素考试中会更多地发现)。因此,这表明锌和钪的化合物不会有颜色 - 这是真的。
需要学习的最重要的有色离子是
Fe2+ 绿色
Fe3+ 黄色
Cu2+ 蓝色
通过具有部分填充的d轨道,过渡金属可以吸收我们可见光谱中的光。这意味着反射的光(我们看到的光)将缺少吸收的光的波长。因此,吸收光的波长和颜色与我们看到的光的波长和颜色不同。

此色轮演示了如果化合物在可见光谱中只有一个吸收,它将呈现什么颜色。例如,如果化合物吸收红光,它将呈现绿色。
λ 吸收 与颜色 观察
400nm 紫罗兰色吸收,黄绿色观察 (λ 560nm)
450nm 蓝色吸收,黄色观察 (λ 600nm)
490nm 蓝绿色吸收,红色观察 (λ 620nm)
570nm 黄绿色吸收,紫罗兰色观察 (λ 410nm)
580nm 黄色吸收,深蓝色观察 (λ 430nm)
600nm 橙色吸收,蓝色观察 (λ 450nm)
650nm 红色吸收,绿色观察 (λ 520nm)
本节中有3个沉淀反应,必须学习并记住相应的观察结果。它们都非常相似,过渡金属离子的溶液与氢氧化钠水溶液反应
- Cu2+(aq) + 2OH-(aq) ---> Cu(OH)2(s)
(蓝色) --------> (浅蓝色)
- Fe2+(aq) + 2OH-(aq) ---> Fe(OH)2(s)
(绿色) --------> (绿色)
- Fe3+(aq) + 3OH-(aq) ---> Fe(OH)3(s)
(黄色) --------> (锈色)
这些反应产生固体“胶状”沉淀物(称为胶状物,因为它们像果冻一样)

过渡金属有形成配合物(配位化合物)的趋势,这是由于它们部分填充的d亚层接受来自其他离子或分子的供体电子对。
配合离子是指含有中心原子或离子且其他原子、离子或分子与之结合的离子。原子、离子或分子通过配位共价键与之结合,并被称为配体
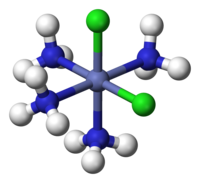
右侧是六水合钒(III)配合离子的示例。中心钒3+金属离子已与水分子配体提供的孤对电子形成了配位键。由于水是中性的,因此总电荷将保持为3+,但对于其他带电配体(如Cl-和CN-),总电荷将受到影响。
中心金属与配体之间形成的配位共价键(配位键)的数量称为配位数。
最初,配合物的命名可能看起来很棘手,但一旦你习惯了命名化合物的系统方法,就很容易遵循这些规则
1. 确定配体的数量并使用适当的前缀 - 1 一、2 二、3 三、4 四、5 五、6 六
2. 确定配体的名称
- 如果配体是阴离子,则名称以“o”结尾,例如氯 (Cl-)、氰 (CN-)、羟 (OH-)
- 大多数中性配体使用其常用名称,但水为aqua、氨为ammine、一氧化碳为羰基。
3. 确定中心金属并考虑配合物的总电荷
- 如果为中性或正电荷,则使用金属的正常名称,例如铜
- 如果为负电荷,则名称以“ate”结尾,例如铁酸盐(铁)、铜酸盐(铜)、铅酸盐(铅)
4. 确定中心金属离子的氧化态,并在末尾用罗马数字括号表示。

左侧是一个总电荷为(2-)的配合物的例子,因此使用铜酸盐而不是铜。
右侧是具有两种不同类型配体的配合物的示例,这除了必须分别执行步骤1和2两次之外,不会影响命名过程。
以下是一些配合物的更多示例
[Co(H2O)6]2+ 六水合钴(II)离子
[CuCl4]2- 四氯合铜(II)酸盐离子
[FeCN6]4- 六氰合铁(II)酸盐离子
[CrCl2(NH3)4]+ 二氯四氨合铬(III)离子
形状 - 如上所示,六水合钒(III)的形状为八面体,四氯合铜(II)酸盐的形状为四面体
当存在更稳定的配合物时,配体可以被其他配体取代。对于考试,必须知道3种配体取代
[Cu(H2O)6]2+(aq) + 4Cl-(aq) ---> [CuCl4]2-(aq) + 6H2O(l)
在此反应中,当逐滴加入浓盐酸时,蓝色的六水合铜(II)发生配体取代,形成黄色的四氯合铜(II)酸盐。
[CuCl4]2-(aq) + 4NH3(aq) + 2H2O(l) ---> [Cu(NH3)4(H2O)2]2+(aq) + 4Cl-(aq)
然后,黄色四氯合铜(II)酸盐会与浓氨水和水反应,生成深蓝色的四氨二水合铜(II)。
因此,在我们提到的三个复杂离子中,四氨二水合铜(II)是最稳定的,六水合铜(II)是最不稳定的。
[Fe(H2O)6]3+(aq) + SCN-(aq) ---> [Fe(H2O)5SCN]2+(aq) + H2O(l)
这里,黄色的六水合铁(III)变成血红色的五水硫氰合铁(III)。
我们可以利用我们在配体取代反应中学到的颜色变化来确定配合物中配体与金属的比例。这可以通过向原始配合物中加入不同体积的新配体来实现。然后,可以将一束窄光束照射到一个滤光片上,该滤光片只允许一种波长的光被溶液吸收(否则白光会被所有颜色吸收,颜色变化将毫无意义)。然后,溶液另一侧的光电管检测剩余的光,并由仪表记录结果。
滤光片的颜色应与新配合物将吸收的颜色(与反射的颜色相反)相同。这意味着随着反应的进行,将吸收越来越多的光。
如果使用足够的样品,应该会出现一个模式,其中在达到一定体积后吸光度会达到极限。这是因为所有配体都已被取代。利用n=cv可以计算出第一次达到最大吸光度值时所用新配体和原始配合物的摩尔数。这两个值之间的比率就是配合物中配体与金属的比率。
氧化还原反应是指还原和氧化同时发生的反应。过渡金属具有多种不同的氧化态,因此很容易被还原或氧化。一旦你有了两个半反应方程式,构建氧化还原方程式就不太困难了。
例如:铁(II)离子与酸性水溶液中的高锰酸根(VII)离子的氧化还原反应
Fe(II)氧化的半反应方程式
Fe2+(aq) ---> Fe3+(aq) + e-
酸性溶液中高锰酸钾(VII)还原的半反应方程式
MnO4-(aq) + 8H+(aq) + 5e- ---> Mn2+(aq) + 4H2O(l)
为了构建完整的方程式,电子数必须相等,因此Fe方程式必须乘以5。
5Fe2+(aq) ---> 5Fe3+(aq) + 5e-
现在可以通过将两个方程式的两边相加来构建完整的方程式。
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) + 5e- ---> 5Fe3+(aq) + 5e- + Mn2+(aq) + 4H2O(l)
去掉电子后的方程式
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) ---> 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
观察结果:颜色从紫色变为非常浅的粉红色(几乎无色),并且Fe3+离子由于颜色太淡而无法看到。
利用上一节中学习的方程式,我们可以计算出(例如)药店购买的铁片中铁的质量百分比。
在滴定反应中,将2.13克铁片溶解在硫酸中,过滤并用水洗涤到一个标准容量瓶中,制成250cm3溶液。然后用0.01M高锰酸钾(VII)溶液滴定25cm3溶液。经过3次一致的滴定后,平均滴定体积为12.0cm3。
记住,下面的方程式将确认反应在第一次出现永久粉红色时完成。
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) ---> 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
首先,必须使用n=cv计算MnO4-的摩尔数。
0.01 x 12 = 1.2x10-4 摩尔
然后,可以通过查看方程式中的摩尔比来计算Fe2+的摩尔数。
1.2x10-4 x 5 = 6 x 10-4
这是25cm3溶液的摩尔数,为了找到所有铁片(在250cm3溶液中)的总摩尔数,该值必须乘以10,得到6 x 10-3 摩尔。
最后,将溶液中的摩尔数乘以铁的摩尔质量56,并除以5,得到一片铁片的摩尔质量。
6 x 10-3 x 56 x 1/5 = 0.00672
因此:0.0672/0.425 x 100 = 15.77%
不幸的是,此值与包装盒上的值不同,这是由于操作过程中存在误差造成的。
1. 为什么过渡金属Cu和Cr不遵循通常的电子结构模式?
2. 什么是过渡金属?第4周期d区元素中哪些不是过渡金属?为什么?
3. 为什么过渡金属离子有颜色?
4. Fe2+(aq)离子的水溶液是什么颜色?因此,它们最吸收哪种颜色和波长的光?
5. Fe3+(aq) + 3OH-(aq) ---> Fe(OH)3(s) 你会观察到什么现象?
6. 给出该配合物的名称:[CrCl2(NH3)4]+
7. 写出两个涉及Cu的配体取代反应,并描述如何利用比色法确定配体与金属的比例。
8. 将1.7克钢溶解在稀硫酸中,然后用蒸馏水稀释到250cm3的容量瓶中。取25cm3样品用0.02M高锰酸钾(VII)溶液滴定。完全反应需要26.05cm3的高锰酸钾(VII)溶液。计算钢样品中铁的百分含量。(Ar:Fe = 56)
