有机化学/有机化学基础概念/原子结构
|
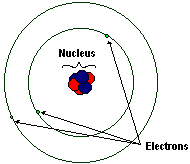
| 锂原子的简单模型。 未按比例绘制! |
原子由一个原子核和围绕原子核运行的电子构成。原子核由质子和中子组成。一个处于自然状态的未带电原子,其电子数量与质子数量相同。
原子核由质子(带正电)和中子(不带电)组成。中子和质子的质量大致相同,它们共同构成了原子的大部分质量。
电子是带负电的粒子。电子的质量大约是质子或中子的 2000 分之一,为 0.00055 amu。电子绕核高速旋转,以至于无法确定电子在任何时刻的位置。该图像描绘了旧的玻尔原子模型,在该模型中,电子像行星绕太阳运行一样,占据着原子核周围的离散“轨道”。该模型已经过时。当前的原子结构模型认为,电子占据着原子核周围的模糊云状区域,这些区域具有特定的形状,有些是球形的,有些是哑铃形的,有些甚至具有更复杂的形状。
电子在原子中以不同形状和大小的云状区域运行。电子云以层状形式一层套一层,称为电子层,最内层占据最简单轨道的电子具有最低的能量状态,最外层占据最复杂轨道的电子具有最高的能量状态。能量状态越高,电子具有的能量就越多,就像山顶上的岩石比山谷底部的岩石具有更高的势能。电子存在于较高能量轨道的主要原因是,任何轨道中只能存在两个电子。因此,电子会填充轨道,始终占据可用的最低能量轨道。电子也可以被推到更高的能量轨道,例如通过光子。通常情况下,这不是一个稳定的状态,一段时间后,电子会自发地跃迁到较低的能量状态,并释放出光子。这些概念对于理解后面的一些概念非常重要,例如手性化合物的旋光性,以及有机化学以外许多有趣的现象(例如,激光的工作原理)。
每个不同的电子层都被细分为一个或多个轨道,这些轨道也具有不同的能量级别,尽管轨道之间的能量差异小于电子层之间的能量差异。
较长的波长具有较低的能量;s 轨道具有绕核电子允许的最长波长,并且观察到该轨道具有最低的能量。
每个轨道都具有其特有的形状,表示电子最常存在的位置。轨道使用字母表中的字母来命名。按能量递增的顺序,轨道为:s、p、d 和f 轨道。
随着人们向上穿过电子层(由主量子数n表示),更多的轨道类型变得可能。电子层用数字表示。因此,2s 轨道指的是第二电子层中的 s 轨道。
s 轨道是能量最低的轨道,形状为球形。该轨道中的电子处于基频状态。该轨道最多可以容纳两个电子。
下一个能量最低的轨道是p 轨道。它的形状通常被描述为类似于哑铃。有三个 p 轨道,分别沿着三维坐标 x、y 或 z 方向排列。这三个“p”轨道中的每一个最多可以容纳两个电子。
这三个不同的 p 轨道可以分别称为 px、py 和 pz。
s 和p 轨道对于理解大多数有机化学很重要,因为这些是存在于有机化合物中最常见的原子类型中所占据的轨道。
还存在 d 和 f 轨道。d 轨道存在于过渡金属中。硫和磷具有空的 d 轨道。涉及具有 d 轨道的原子的化合物确实存在,但很少是构成有机分子的一部分。f 轨道存在于镧系元素和锕系元素中。镧系元素和锕系元素在有机化学中大部分是不相关的。
当原子或离子在其轨道中接收电子时,轨道和电子层以特定的方式填充。
有三个原则支配着这个过程
- 泡利不相容原理,
- 泡利不相容原理,以及
- 洪特规则.
在一个原子中,没有两个电子的所有四个量子数都相同。这在我们对轨道的图像中意味着,每个轨道最多只能容纳两个电子,一个“自旋向上”和一个“自旋向下”。
这表明填充和半填充的电子层往往具有额外的稳定性。因此,在某些情况下,例如,4s 轨道将在 3d 轨道之前填充。
此规则仅适用于具有 d 电子的元素,因此在有机化学中不太重要(尽管在有机金属化学中很重要)。
八隅体规则指出,原子倾向于在其价层中具有八个电子,因此将倾向于结合以使每个原子在其价层中具有八个电子,类似于惰性气体的电子构型。简而言之,当构成原子的外层电子壳为空、满或在外层电子壳中具有八个电子时,分子更稳定。
该规则的主要例外是氦,当它在其价层中具有两个电子时,它处于最低能量状态。
其他值得注意的例外是铝和硼,它们可以使用六个价电子正常运行;以及周期表上第三族之后的某些原子,例如硫,它们可以具有超过八个电子。此外,一些惰性气体在扩展其价层时可以形成化合物。
杂化是指两个或多个共价键合原子的轨道的组合。根据给定原子有多少个自由电子以及它形成多少个键,s 和 p 轨道中的电子将以某种方式组合以形成键。
根据路易斯结构很容易确定原子的杂化。首先,您计算自由电子对的数量和σ键(单键)的数量。不要计算双键,因为它们不会影响原子的杂化。一旦确定了这两个的总和,杂化模式如下所示
Sigma Bonds + Electron Pairs Hybridization
2 sp
3 sp2
4 sp3
这里的模式与电子轨道的模式相同,可以作为记忆指南。

