 > 反应简介
> 反应简介
化学平衡是反应正向和逆向方向之间相互关联的比率。该比率用字母K表示,在以下等式中
K = 产物 / 反应物
反应速率是指化学反应发生的快慢,用每单位时间和每单位体积的摩尔数表示。一般反应 的速率r定义为
的速率r定义为

从上面的表达式可以看出,通常约定是将反应速率视为产物生成速率。
速率是反应物和产物浓度、温度、压力以及催化剂存在与否的函数。
反应速率的常见表达式是幂律

 称为动力学常数,
称为动力学常数, 、
、 等称为相对于反应物 A、B 的反应级数(或A、B等的偏级数),分别。所有级数的总和是速率表达式的全局级数。因此速率表达式
等称为相对于反应物 A、B 的反应级数(或A、B等的偏级数),分别。所有级数的总和是速率表达式的全局级数。因此速率表达式 是二级和一级,分别对 A 和 B。
是二级和一级,分别对 A 和 B。
对于基元反应,反应级数仅等于化学计量系数;在大多数情况下,它们必须通过实验确定,并且在实验条件范围内有效。
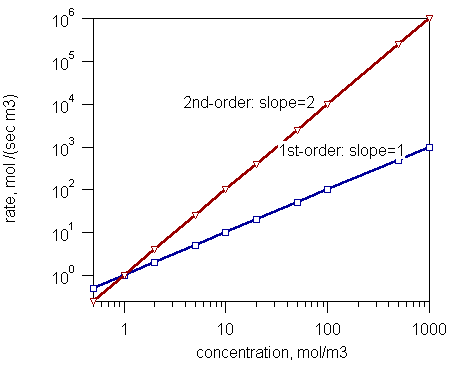
可以通过改变其中一种反应物的浓度 C,例如 A,并测量初始速率 r 来获得关于反应级数的基本数据。绘制速率与浓度的对数-对数图,得到一条直线,根据关系 ,该直线的斜率就是偏级数,例如 A。
,该直线的斜率就是偏级数,例如 A。

也被称为阿累尼乌斯方程式
动力学研究最重要的应用是确定反应机理。事实上,速率表达式是反应机理的函数。
根据推测的反应机理(模型),可以推导出速率方程,并用于分析实验数据。如果得到的拟合在统计上不显著,则该方案被拒绝。在复杂的体系中,几种方案可以产生兼容的速率表达式,模型辨别的问题至关重要。
反应通常有两个或多个步骤。其中一步,通常是最后一步,是最慢的步骤,被称为限速步骤。
有时在计算反应速率时,假设没有特定的步骤是限速步骤是有用的。相反,反应中间体可以以相等的速率进行到产物或返回到原始反应物。这被称为稳态近似。
一个典型的例子是卤代烷的 水解
- R-X + H2O → ROH + HX
这个反应可以通过两种机理发生:SN1 和 SN。前者是一分子取代:它的速率仅由 R-X 的浓度决定,与新取代基的浓度无关。后者是双分子取代:它的速率对 R-X 和新取代基都是一级,总反应级数为 2。
化学平衡是指净反应既不向前也不向后进行的状态。这是一个动态平衡。正向反应的速率等于逆向反应的速率,因此两者相互抵消,净变化速率为零。
化学平衡由平衡常数(通常写为Keq)决定,由质量作用定律表示

浓度C可以用任何尺度表示,例如摩尔分数、摩尔浓度、分压。
如果温度和压力保持不变,无论初始浓度如何,体系都会发生变化,直到质量作用乘积等于 Keq。一般来说,体系中 在平衡时高度偏向反应物侧(几乎没有转化),而当
在平衡时高度偏向反应物侧(几乎没有转化),而当 反应会进行到底。
反应会进行到底。
从经典热力学可以证明以下关系成立

其中 是反应的吉布斯自由能总变化(产物减去反应物)。
是反应的吉布斯自由能总变化(产物减去反应物)。
温度的影响可以通过对上述方程求导得到

也称为范特霍夫方程。因此,对于放热反应( ),温度升高会降低
),温度升高会降低 的数量,导致较低的Keq,反之亦然,对于吸热反应。
的数量,导致较低的Keq,反之亦然,对于吸热反应。
![]() > 反应简介
> 反应简介

















