地球行星/3e. 元素周期表与电子轨道
如果没有原子内部的电子,原子将永远不会键合或相互作用形成分子、晶体和其他复杂材料。电子在化学中极其重要,因为它们决定了原子如何相互作用。难怪大多数科学教室都展示元素周期表,而不是更繁琐的核素图表,因为元素周期表根据质子和电子的数量来组织元素,而不是质子和中子的数量。


如前所述,电子是难以捉摸的亚原子粒子,它们可以增加其能量状态,甚至完全离开原子形成等离子体,也称为电。电是自由电子的流动,这些电子可以在金属线等导电材料中以接近光速的速度移动。在下一节中,我们将详细研究电子如何在原子中以轨道的形式排列。但是,请记住,被高水平的电磁辐射轰击的高激发原子,例如升高的温度和高压,电子可以离开原子,而在接近绝对零度开尔文的极低温度下,电子将非常靠近原子核形成玻色-爱因斯坦凝聚。当我们想到温度(热量)时,真正指示的是物质原子内部电子的能量状态,无论它是气体、液体还是固体。物质越热,电子具有的振动能量就越多。
电子以非常快的速度绕原子核运行,没有离散的轨道路径,而是像一个被称为轨道壳的电磁场。 海森堡原理描述了测量这些电子轨道壳的不可能性质,因为任何时候科学家使用光子来测量电子的位置,它都会移动并改变其能量水平。电子在原子核周围的轨道中确切位置始终存在不确定性。因此,电子轨道壳是电子在任何时刻都可能存在的概率场。
带负电的电子被吸引到带正电的质子,因此在大多数原子中观察到数量相等的电子和质子。

19 世纪中期工作的早期化学家只知道少数几种元素,这些元素根据它们之间的反应性被分为三大类,即卤素、碱金属和碱土金属。到 1860 年,其中许多元素的原子质量已被报道,这使得俄罗斯科学家德米特里·门捷列夫能够根据它们的反应性和原子质量来排列元素。

在编写化学教科书时,门捷列夫偶然发现了每一组元素都有递增原子质量的想法,因此一组卤素将具有不同质量的元素。在不知道潜在原因的情况下,门捷列夫根据它们的原子序数(质子数)来组织元素,这与原子质量和电子轨道数有关,而电子轨道数与元素与其他元素键合的反应性有关。虽然这些早期的元素周期表与我们现代的元素周期表看起来完全不同,但它们激发了化学家发现更多元素的热情。下一个重大突破是惰性气体的发现和广泛接受,其中包括氦和氩,它们是已知的反应性最弱的元素。
那么,原子的反应性如何与其原子质量相关?电子被吸引到原子核,数量与质子数相等,而质子数是原子质量的一半。原子质量越大,质子越多,吸引的电子就越多。但是,电子更喜欢以组的形式填充电子轨道壳,因此不完整的电子轨道壳会吸引其他电子,即使电子和质子数量相等。如果一个原子具有完整的电子组,该组与质子数相匹配,那么它将不具有反应性,而那些需要少一个电子或多一个电子才能填充轨道组的元素是反应性最强的元素类型。
| 族 → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ 周期 | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
58 Ce |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89 Ac |
90 Th |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Uuq |
115 Uup |
116 Uuh |
117 Uus |
118 Uuo |
| * 镧系元素 | 59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||
| ** 锕系元素 | 91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||
| 碱金属2 | 碱土金属2 | 镧系元素12 | 锕系元素12 | 过渡金属2 |
| 贫金属 | 类金属 | 非金属 | 卤素3 | 惰性气体3 |
1锕系元素和镧系元素统称为“稀土金属”。2碱金属、碱土金属、过渡金属、锕系元素和镧系元素统称为“金属”。3卤素和惰性气体也是非金属。
在标准温度和压力下的状态
- 原子序数为蓝色的元素在 STP 下未知
- 原子序数为红色的元素在标准温度和压力 (STP) 下为气体
- 原子序数为绿色的元素在 STP 下为液体
- 原子序数为黑色的元素在 STP 下为固体
自然界中的存在
未知性质。
- 带有青色背景的元素具有未知的化学性质。

元素周期表的第一行包含两个元素:氢和氦。
氢原子核有一个质子,因此它吸引一个电子。然而,电子轨道壳层更倾向于包含两个电子,因此氢与其他元素反应性很高,例如在氧气存在的情况下,它会爆炸!氢更希望在它的电子轨道壳层中拥有两个电子,但由于它只有一个质子,所以它会尽可能地“偷取”或“借用”附近原子的其他电子。
氦原子核有两个质子,因此它吸引两个电子。由于两个电子是第一个轨道壳层的理想数量,氦不会与其他元素发生反应,事实上,将氦与其他元素结合起来非常困难(几乎不可能)。氦是一种惰性气体,这意味着它在轨道壳层中包含了完整的电子集。
元素周期表的列按每个轨道壳层中电子的数量排列,而原子序数(质子数量)由行表示。
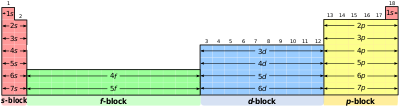

元素周期表的第一行是当前两个电子填充第一个轨道壳层时,称为 1s 轨道壳层。第二行是当接下来的两个电子填充 2s 轨道壳层,而 6 个电子填充 2p 轨道壳层。第三行是当接下来的 6 个轨道填充 3p 轨道壳层,而 2 个电子填充 4s 轨道壳层。第四行是当接下来的 10 个轨道填充 3d 轨道壳层,而 6 个电子填充 4p 轨道,而 2 个电子填充 5s 轨道。
一个价电子是与原子相关的最外层电子,但没有完全填充最外层轨道壳层,因此参与原子间的键合。价层是原子的最外层壳层。具有完整价层的元素(惰性气体)化学反应性最低,而那些价层中只有一个电子(碱金属)或只有一个电子缺失才能形成完整壳层(卤素)的元素反应性最高。氢原子价层中只有一个电子,但它也只有一个电子缺失才能形成完整壳层,它具有独特且反应性非常强的性质。
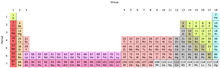
元素的价电子数量可以通过元素周期表中的族(垂直列)确定。除了第 3-12 族(过渡金属和稀土元素)之外,这些列通过与元素的中性原子相关的价电子数量来识别。每个 s 亚层最多容纳 2 个电子,而 p 亚层容纳 6 个,d 亚层容纳 10 个电子,然后是 f 亚层容纳 14 个,最后是 g 亚层容纳 18 个电子。观察元素周期表的前几行,了解它是如何起作用以确定特定元素的每个原子中包含多少价电子(<)。
| 元素 | 电子数 | 1s | 2s | 2p | 2p | 2p | 价电子数 电子 |
|---|---|---|---|---|---|---|---|
| 氢 | 1 | < | 1 | ||||
| 氦 | 2 | <> | 0 | ||||
| 锂 | 3 | <> | < | 1 | |||
| 铍 | 4 | <> | < | < | 2 | ||
| 硼 | 5 | <> | < | < | < | 3 | |
| 碳 | 6 | <> | < | < | < | < | 4 |
| 氮 | 7 | <> | <> | < | < | < | 3 |
| 氧 | 8 | <> | <> | <> | < | < | 2 |
| 氟 | 9 | <> | <> | <> | <> | < | 1 |
| 氖 | 10 | <> | <> | <> | <> | <> | 0 |
请注意,氦和氖没有价电子,这意味着它们没有反应性,也不会与其他原子形成键。但是,锂有 1 个价电子,如果这个电子被移除,它将有 0 个价电子,这使得锂具有高度反应性。此外,请注意,氟只需要再获得一个价电子就可以完成它的 2s 和 2p 轨道,这使得氟也具有高度反应性。碳在这个元素集中具有最多的价电子,它会吸引或放弃 4 个电子来完成 2s 和 2p 轨道的集合。
了解价电子数量对于理解原子如何相互形成键合形成分子至关重要。例如,元素周期表中包含锂的第一列中的所有元素都有 1 个价电子,它们很可能与需要 1 个价电子才能填充轨道壳层的元素形成键合,例如元素周期表中氟列中的元素。
元素周期表中的某些列具有特定的历史名称。包含锂的第一列元素统称为碱金属(氢气是独特的,通常不被认为是碱金属的一部分),包含氦的最后一列元素都有 0 个价电子,统称为惰性气体。氟列下的元素需要 1 个价电子才能填充轨道壳层,被称为卤素,而铍列下的元素被称为碱土金属,它们有 2 个价电子。大多数其他列没有特定的名称(有时统称为过渡金属),但它们可以用来确定价电子数量,例如碳和列出的元素会有 4 个价电子,而列出的所有元素都会有 2 个价电子氧。请注意,在元素钡之后,插入了两行元素,它们是镧系元素和锕系元素,它们包含 4s、4p、4d、4f 轨道中的电子,最大可能总共 32 个电子,在漂亮的表格中显示太长了,因此这些元素通常在元素周期表底部显示。
典型的大学化学课程会详细讲解电子轨道壳层,但了解电子轨道如何工作很重要,因为电子的排列决定了每个元素的原子如何在分子中形成键。在下一节中,我们将考察原子如何聚合形成键,以及如何以不同的方式组合在一起形成你在地球上观察到的物质。
| 上一页 | 当前页 | 下一页 |
|---|---|---|
