生物化学原理/细胞膜和受体

| 此页面已导入,需要进行去维基化. 书籍应该谨慎使用维基链接,并且只用于引用理解内容至关重要的技术或深奥术语。大多数,如果不是全部,维基链接都应该简单地删除。请在页面去维基化后删除 {{dewikify}}。 |
细胞膜是一种生物膜,将所有细胞的内部与外部环境隔开。细胞膜对离子和小分子具有选择性渗透性,控制物质进出细胞的运动。它由嵌入蛋白质的磷脂双层组成。细胞膜参与各种细胞过程,如细胞粘附、离子传导和细胞信号传导,并作为细胞外糖萼和细胞壁以及细胞内细胞骨架的附着表面。
细胞膜包含多种生物分子,特别是脂类和蛋白质。物质通过多种机制被整合到膜中或从膜中删除。
- 细胞内囊泡与膜融合(胞吐作用)不仅排出囊泡的内容物,而且将囊泡膜的成分整合到细胞膜中。膜可以在细胞外物质周围形成小泡,这些小泡会收缩并变成囊泡(内吞作用)。
- 如果膜与由膜物质制成的管状结构连续,则可以将管状结构中的物质连续地吸入膜中。
- 虽然膜成分在水相中的浓度很低(稳定的膜成分在水中的溶解度很低),但脂类和水相之间存在分子交换。
细胞膜由三类两亲性脂类组成:磷脂、糖脂和胆固醇。每种脂类的含量取决于细胞类型,但在大多数情况下,磷脂含量最丰富。在红细胞研究中,30% 的质膜是脂类。
磷脂和糖脂中的脂肪链通常含有偶数个碳原子,通常在 16 到 20 之间。16 碳和 18 碳脂肪酸最常见。脂肪酸可以是饱和的或不饱和的,双键的构型几乎总是顺式。脂肪酸链的长度和不饱和度对膜流动性有很大影响[1],因为不饱和脂类会产生一个扭结,阻止脂肪酸紧密堆积在一起,从而降低膜的熔化温度(提高流动性)。某些生物体通过改变脂类成分来调节其细胞膜流动性的能力称为稳态粘度适应。
整个膜通过疏水尾部的非共价相互作用保持在一起,但结构非常流动,没有固定在适当的位置。在生理条件下,细胞膜中的磷脂分子处于液晶态。这意味着脂类分子可以自由扩散并沿其存在的层快速横向扩散。然而,磷脂分子在双层细胞内和细胞外小叶之间的交换是一个非常缓慢的过程。脂筏和caveolae是细胞膜中富含胆固醇的微域的例子。
在动物细胞中,胆固醇通常以不同程度分散在整个细胞膜中,存在于膜脂类疏水尾部之间的不规则空间中,在那里它赋予膜强化和增强作用。
脂质囊泡或脂质体是脂质双层封闭的圆形口袋。这些结构在实验室中用于研究化学物质对细胞的影响,方法是将这些化学物质直接递送到细胞,以及更深入地了解细胞膜的渗透性。脂质囊泡和脂质体是通过首先将脂类悬浮在水溶液中,然后通过超声处理搅拌混合物而形成的,从而形成均匀的圆形囊泡。通过测量从囊泡内部到周围溶液的流出速率,研究人员可以更好地了解膜渗透性。囊泡可以通过在存在所需分子或离子的溶液中形成囊泡来形成,囊泡内部包含分子和离子。蛋白质也可以通过在存在去垢剂的情况下溶解所需的蛋白质并将它们连接到形成脂质体所用的磷脂中来嵌入膜中。这些为研究人员提供了一种研究各种膜蛋白功能的工具。
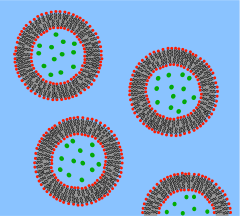
囊泡是脂质双层卷成球形外壳,包裹少量水,并将它与囊泡外部的水隔开。由于这种与细胞膜的根本相似性,囊泡已被广泛用于研究脂质双层的特性。囊泡被如此频繁地使用的原因还在于它们比较容易制备。如果将脱水的脂类样品暴露在水中,它会自发形成囊泡。[2] 这些最初的囊泡通常是多层(多壁)的,并且尺寸范围很广,从几十纳米到几微米。[3] 需要诸如超声处理或通过膜挤压之类的方法来将这些最初的囊泡分解成更小的、单壁囊泡,这些囊泡具有被称为小单层囊泡 (SUVs) 的均匀直径。[4] 或者,与其合成囊泡,不如从细胞培养物或组织样本中简单地分离它们。[5] 囊泡用于在细胞内以及进出细胞运输脂类、蛋白质和许多其他分子。这些天然分离的囊泡由不同脂类和蛋白质的复杂混合物组成,因此,尽管它们为研究特定的生物现象提供了更大的真实性,但简单的合成囊泡更适合研究基本的脂类特性。
由于人工 SUV 可以大量生产,因此它们适用于批量材料研究,例如 X 射线衍射以确定晶格间距[6] 和差示扫描量热法以确定相变。[7] 双极化干涉仪 可以测量单层和多层结构,以及在无标记分析格式中插入和破坏囊泡[8]。囊泡也可以用荧光染料标记,以允许灵敏的基于 FRET 的融合分析。[9] 尽管进行了这种荧光标记,但由于 SUV 太小,因此通常很难对 SUV 进行详细成像。为了解决这个问题,研究人员开发了巨型单层囊泡 (GUV)。GUV 足够大(几十微米),可以用传统的荧光显微镜进行研究。由于这个原因,许多关于人工脂质系统中脂筏的研究都是用 GUV 进行的。[10] 与支撑双层相比,GUV 提供了更“自然”的环境,因为没有附近的固体表面会导致缺陷或使蛋白质变性。然而,GUV 相对脆弱,制作起来耗时,而且与 SUV 相比,产量有限。
为了规避这些问题,人们报道了一种针对 GUV 的微流体组装线方法。[11]
碳水化合物
[edit | edit source]质膜还含有碳水化合物,主要是糖蛋白,但也有一些糖脂(脑苷脂和神经节苷脂)。在大多数情况下,细胞内的膜不会发生糖基化;相反,糖基化通常发生在质膜的细胞外表面。
糖萼是所有细胞的重要特征,尤其是具有微绒毛的上皮细胞。最近的数据表明糖萼参与细胞粘附、淋巴细胞归巢以及许多其他功能。
倒数第二个糖是半乳糖,末端糖是唾液酸,因为糖骨架在高尔基体中被修饰。唾液酸带负电荷,为带电粒子提供外部屏障。
蛋白质
[edit | edit source]膜内的蛋白质是整体膜功能的关键。这些蛋白质主要在膜之间运输化学物质和信息。每种膜的蛋白质含量都不同。蛋白质可以是外周蛋白或整合蛋白的形式。
| 类型 | 描述 | 示例 |
| 整合蛋白 或 *跨膜蛋白* |
跨越膜并具有亲水性胞质结构域(与内部分子相互作用)、疏水性跨膜结构域(将蛋白锚定在细胞膜内)和亲水性细胞外结构域(与外部分子相互作用)。疏水结构域由一个、多个或组合的 α螺旋 和 β折叠 蛋白质 基序 组成。 | 离子通道、质子泵、G蛋白偶联受体 |
| 脂质锚定蛋白 | 共价结合到一个或多个脂质分子上;疏水性插入细胞膜并锚定蛋白质。蛋白质本身不与膜接触。 | G 蛋白 |
| 外周蛋白 | 附着在整合膜蛋白上,或与脂质双层的周边区域相关联。这些蛋白质往往与生物膜只有短暂的相互作用,并且,一旦反应后,分子就会解离以在细胞质中继续发挥作用。 | 一些酶、一些激素 |
细胞膜是大量蛋白质的宿主,这些蛋白质负责其各种活动。不同物种之间的蛋白质含量不同,并且根据功能而不同,但是细胞膜中典型的蛋白质含量为 50%。[1] 这些蛋白质无疑对细胞很重要:大约三分之一的 基因 在 酵母 中专门编码这些蛋白质,而在多细胞生物中,这个数字甚至更高。
细胞膜暴露在外部环境中,是细胞间通讯的重要场所。因此,膜表面存在大量蛋白质受体和识别蛋白,如 抗原。膜蛋白的功能还可以包括细胞间接触、表面识别、细胞骨架接触、信号传导、酶活性或跨膜运输物质。
大多数膜蛋白必须以某种方式插入膜中。为了实现这一点,氨基酸的 N 端“信号序列”将蛋白质引导至内质网,内质网将蛋白质插入脂质双层中。插入后,蛋白质在囊泡中被运输到其最终目的地,囊泡与靶膜融合。

膜以浅棕色表示。
跨膜蛋白 (TP)
[edit | edit source]跨膜蛋白 (TP) 是一种从膜的一侧穿过膜到另一侧的蛋白质。许多 TP 充当“闸门”或“装货码头”,以拒绝或允许特定物质跨越生物膜运输,进入细胞,或像废物副产品一样从细胞中排出。作为对某些分子形状的响应,这些“货物处理”TP 可能具有特殊的折叠或弯曲方式,这些方式将通过生物膜移动物质。跨膜蛋白是一种跨越整个生物膜的多拓扑蛋白。跨膜蛋白在水中聚集和沉淀。它们需要去垢剂或非极性溶剂进行提取,尽管其中一些(β 桶)也可以使用变性剂提取。
所有跨膜蛋白都是整合膜蛋白,但并非所有 IMP 都是跨膜蛋白。
跨膜蛋白主要有两种类型:α 螺旋。这些蛋白质存在于细菌细胞的内膜或真核生物的质膜中,有时也存在于外膜中。这是跨膜蛋白的主要类别。据估计,人类所有蛋白质中有 27% 是 α 螺旋膜蛋白。β 桶。到目前为止,这些蛋白质仅在革兰氏阴性菌的外膜、革兰氏阳性菌的细胞壁以及线粒体和叶绿体的外膜中发现。所有 β 桶跨膜蛋白都具有最简单的上下拓扑结构,这可能反映了它们的共同进化起源和类似的折叠机制。另一种分类是指 N 端和 C 端结构域的位置。I、II 和 III 型是单次跨膜分子,而 IV 型是多次跨膜分子。I 型跨膜蛋白通过停止转移锚定序列锚定在脂质膜上,并且在合成过程中将其 N 端结构域靶向 ER 腔(如果成熟形式位于质膜上,则靶向细胞外空间)。II 和 III 型通过信号锚定序列锚定,II 型将其 C 端结构域靶向 ER 腔,而 III 型将其 N 端结构域靶向 ER 腔。IV 型细分为 IV-A,其 N 端结构域靶向胞质溶胶,IV-B,其 N 端结构域靶向腔。四种类型划分的意义在易位和与 ER 结合的翻译时尤其明显,此时蛋白质必须穿过 ER 膜,其方向取决于蛋白质类型。
整合膜蛋白 (IMP)
[edit | edit source]整合膜蛋白 或穿透 脂质双层 的外围区域。例如,许多离子通道和 跨膜受体 的调节蛋白亚基可以定义为外周膜蛋白。与整合膜蛋白不同,外周膜蛋白往往在 蛋白质纯化 程序中提取的所有蛋白质的水溶性组分或部分中聚集。具有 GPI 锚的蛋白质是此规则的例外,并且可以具有与 整合膜蛋白 相似的纯化特性。整合膜蛋白 (IMP) 是永久附着在生物膜上的蛋白质分子(或蛋白质组装体)。穿过膜的蛋白质被“环状”脂质包围,这些脂质被定义为直接与膜蛋白接触的脂质。此类蛋白质只能使用去垢剂、非极性溶剂或有时使用变性剂从生物膜中分离出来。IMP 构成生物体基因组中编码的蛋白质的很大一部分。所有跨膜蛋白都是 IMP,但并非所有 IMP 都是跨膜蛋白。
外周膜蛋白是指仅暂时附着在与其相关的生物膜上的蛋白质。这些分子附着在跨膜蛋白上,或穿透脂双层的周边区域。例如,许多离子通道和跨膜受体的调节蛋白亚基可以定义为外周膜蛋白。与跨膜蛋白不同,外周膜蛋白倾向于在蛋白质纯化过程中提取的所有蛋白质的水溶性组分或级分中收集。具有 GPI 锚的蛋白质是这一规则的例外,并且可以具有与跨膜蛋白类似的纯化特性。蛋白质与生物膜的可逆结合已证明通过多种机制调节细胞信号传导和许多其他重要的细胞事件。例如,许多酶与生物膜之间的紧密结合可能会使它们与它们的脂质底物(s)紧密接近。膜结合也可能促进许多蛋白质结构域内的重排、解离或构象变化,从而导致其生物活性的激活。此外,许多蛋白质的定位被定位于其驻留膜的内表面或外表面或小叶。这通过提高任何适当的蛋白质-蛋白质相互作用的概率来促进多蛋白复合物的组装。
外周膜蛋白可能与其他蛋白质或直接与脂双层相互作用。在后一种情况下,它们被称为两亲蛋白。某些蛋白质,如 G 蛋白和某些蛋白激酶,同时与跨膜蛋白和脂双层相互作用。某些多肽激素、抗菌肽和神经毒素在定位和与它们的细胞表面受体靶点相互作用之前会在膜表面积累,这些靶点本身可能就是外周膜蛋白。构成细胞表面膜的磷脂双层由一个疏水性内芯区域夹在两个亲水性区域之间,一个在细胞膜的内表面,另一个在细胞膜的外表面(有关细胞膜的更详细结构描述,请参阅脂双层文章)。模型磷脂双层的内表面或界面区域已被证明具有大约 8 到 10 Å 的厚度,尽管这在包含大量神经节苷脂或脂多糖的生物膜中可能更宽。通过小角 X 射线散射 (SAXS) 估计,典型生物膜的疏水性内芯区域可能具有大约 27 到 32 Å 的厚度。疏水性内芯与亲水性界面区域之间的边界区域非常窄,大约为 3 Å(有关其组成化学基团的描述,请参阅脂双层文章)。从疏水性核心区域向外移动并进入界面亲水性区域,水的有效浓度在这个边界层上迅速变化,从几乎为零到大约 2M 的浓度。[8][9] 磷脂双层内的磷酸基团被完全水化或饱和水,并位于疏水性核心区域边界之外约 5 Å 处(见图)。某些水溶性蛋白质与脂双层不可逆地结合,并且可以形成跨膜 α-螺旋或 β-桶通道。这种转化发生在孔形成毒素中,例如大肠杆菌素 A、α-溶血素等。它们也可能发生在 [[Bcl-2 相关 X 蛋白|BcL-2 样蛋白]]、某些两亲性抗菌肽以及某些膜联蛋白中。这些蛋白质通常被描述为外周蛋白质,因为它们的构象状态之一是水溶性的或仅松散地与膜结合。

在生物化学中,受体是一种蛋白质分子,嵌入细胞的质膜或细胞质中,一种或多种特定类型的信号分子可以附着到该蛋白质分子上。与受体结合(附着)的分子被称为配体,可以是肽(短蛋白质)或其他小分子,例如神经递质、激素、药物或毒素。每种受体只能结合某些配体形状。每个细胞通常具有许多不同种类的受体。简单地说,受体充当一个钥匙孔,当插入适当的配体时,会打开神经通路。配体结合稳定受体的一种特定构象(受体蛋白的三维形状,没有序列变化)。这通常与获得或失去蛋白质活性有关,通常导致某种细胞反应。然而,某些配体(例如拮抗剂)仅阻断受体,而不会诱导任何反应。配体诱导的受体变化导致细胞变化,这些变化构成配体的生物活性。人体的许多功能都由这些受体对诸如此类特定分子做出独特反应来调节。
受体的形状和作用通过 X 射线晶体学、双偏振干涉测量法、计算机建模和结构-功能研究进行研究,这些研究促进了对受体结合位点药物作用的理解。结构活性关系将诱导的构象变化与生物分子活性相关联,并使用循环二色性和双偏振干涉测量法等动态技术进行研究。
根据其功能和配体,可以识别几种类型的受体:一些受体蛋白是外周膜蛋白。许多激素和神经递质受体是跨膜蛋白:跨膜受体嵌入细胞膜的磷脂双层中,允许信号转导途径在响应结合分子或配体的激活而激活。代谢型受体与 G 蛋白偶联,并通过控制离子通道的酶间接影响细胞。离子型受体(也称为配体门控离子通道)包含一个中央孔,该孔响应配体的结合而打开。另一类主要的受体是胞内蛋白,例如类固醇和胞内肽激素受体。这些受体通常可以进入细胞核,并响应配体的激活来调节基因表达。膜受体通过使用溶剂、去垢剂和/或亲和纯化的复杂提取程序从细胞膜中分离出来。
代谢型受体是真核细胞表面或囊泡中膜受体的一种亚型。在神经系统中,根据其结构和功能特征,神经递质受体可以分为两大类:代谢型受体和离子型受体。与后者相反,代谢型受体不形成离子通道孔;相反,它们通过信号转导机制(通常是 G 蛋白)间接与细胞质膜上的离子通道连接。因此,它们是 G 蛋白偶联受体的一种类型。其他是酪氨酸激酶或鸟苷酸环化酶受体。这两种受体类型的共同点是它们被特定神经递质激活。当离子型受体被激活时,它会打开一个通道,允许诸如 Na+、K+ 或 Cl- 等离子流过。相反,当代谢型受体被激活时,会触发一系列细胞内事件,这些事件也会导致离子通道打开,但必须涉及一系列第二信使化学物质。
配体门控离子通道 (LGICs) 是一种离子型受体或通道连接受体。它们是一组跨膜离子通道,响应化学信使(即配体,如神经递质)的结合而打开或关闭。内源性配体在 LGICs 蛋白复合物上的结合位点通常位于蛋白质的不同部分(变构结合位点),而不是离子传导孔所在的位点。配体结合与离子通道打开或关闭之间直接联系是配体门控离子通道的特征,这与代谢型受体的间接功能形成对比,代谢型受体使用第二信使。LGICs 也不同于电压门控离子通道(根据膜电位打开和关闭)和牵张激活离子通道(根据细胞膜的机械变形打开和关闭)。
G蛋白偶联受体(GPCR),也称为七跨膜结构域受体、7TM受体、七螺旋受体、蛇形受体和G蛋白连接受体(GPLR),是一个大型跨膜受体蛋白家族,它们感知细胞外的分子并激活细胞内的信号转导途径,最终导致细胞反应。G蛋白偶联受体仅存在于真核生物中,包括酵母、领鞭毛虫和动物。与这些受体结合并激活它们的配体包括光敏化合物、气味、信息素、激素和神经递质,大小从小的分子到肽再到大的蛋白质不等。G蛋白偶联受体参与许多疾病,也是约30%现代药物的靶点。
GPCR超家族的确切大小尚不清楚,但从基因组序列分析中预测出近800个不同的基因(或约占整个蛋白质编码基因组的4%)。尽管已经提出了许多分类方案,但超家族通常分为三个主要类别(A、B和C),类别之间没有可检测到的共享序列同源性。迄今为止,最大的类别是A类,占GPCR基因的近85%。在A类GPCR中,预计超过一半编码嗅觉受体,而其余的受体则由已知的内源性化合物配体化,或被归类为孤儿受体。尽管类别之间缺乏序列同源性,但所有GPCR都共享一个共同的结构和信号转导机制。

总的来说,GPCR可以根据序列同源性和功能相似性分为6类
A类(或1类)(视紫红质样)
B类(或2类)(促胰液素受体家族)
C类(或3类)(代谢型谷氨酸/信息素)
D类(或4类)(真菌交配信息素受体)
E类(或5类)(环状腺苷酸受体)
F类(或6类)(Frizzled/Smoothened)
非常大的视紫红质A组被进一步细分为19个亚组(A1-A19)。最近,提出了一种名为GRAFS(谷氨酸、视紫红质、粘附、Frizzled/Taste2、促胰液素)的替代分类系统。人类基因组编码数千个G蛋白偶联受体,其中约350个检测激素、生长因子和其他内源性配体。人类基因组中发现的约150个GPCR功能未知。一些网络服务器和生物信息学预测方法已被用于根据GPCR的氨基酸序列单独预测其分类,通过伪氨基酸组成方法。
GPCR的结构
[edit | edit source]在结构上,GPCR的特征是细胞外N端,之后是七个跨膜(7-TM)α-螺旋(TM-1到TM-7),由三个细胞内(IL-1到IL-3)和三个细胞外环(EL-1到EL-3)连接,最后是细胞内C端。GPCR自身排列成类似桶状的三级结构,七个跨膜螺旋在质膜内形成一个腔,该腔充当配体结合域,通常被EL-2覆盖。然而,配体也可能结合在其他地方,例如体积较大的配体(如蛋白质或大肽)与细胞外环相互作用,或者,如C类代谢型谷氨酸受体(mGluR)所示,与N端尾部相互作用。C类GPCR以其大的N端尾部为特征,该尾部也包含配体结合域。谷氨酸与mGluR结合后,N端尾部会发生构象变化,导致其与细胞外环和TM域的残基相互作用。三种类型的激动剂诱导激活的最终效应是TM螺旋的相对方向发生变化(类似于扭曲运动),导致更宽的细胞内表面和“揭示”对信号转导功能至关重要的细胞内螺旋和TM域的残基(即,G蛋白偶联)。逆向激动剂和拮抗剂也可能结合到许多不同的位点,但最终的效应必须是防止这种TM螺旋重新定向。GPCR的N端和C端尾部的结构也可能在配体结合之外发挥重要作用。特别是,C端通常包含丝氨酸(Ser)或苏氨酸(Thr)残基,当磷酸化时,会增加细胞内表面与称为β-arrestin(β-arr)的支架蛋白的结合亲和力。一旦结合,β-arrestin既可以空间阻止G蛋白偶联,也可以招募其他蛋白质,导致形成参与细胞外信号调节激酶(ERK)途径激活或受体内吞(内化)的信号复合物。由于这些Ser和Thr残基的磷酸化通常是GPCR激活的结果,因此β-arr介导的G蛋白解偶联和GPCR内化是脱敏的重要机制。GPCR中的一种最终的共同结构主题是C端尾部或细胞内环的一个或多个位点的棕榈酰化。棕榈酰化是通过添加疏水酰基来对半胱氨酸(Cys)残基进行的共价修饰,它具有将受体靶向质膜中称为脂筏的富含胆固醇和鞘磷脂的微域的作用。由于GPCR的许多下游转导器和效应分子(包括参与负反馈途径的那些分子)也被靶向到脂筏,因此这有利于促进快速的受体信号传导。GPCR响应由各种激动剂介导的细胞外信号,从蛋白质到生物胺再到质子,但所有这些信号都是通过G蛋白偶联机制进行转导的。这得益于主要由IL-2和IL-3以及相关的TM螺旋的相邻残基组成的鸟嘌呤核苷酸交换因子(GEF)结构域。
受体酪氨酸激酶 (RTK)
[edit | edit source]受体酪氨酸激酶 (RTK) 是许多多肽生长因子、细胞因子和激素的高亲和力细胞表面受体。在人类基因组中鉴定的90个独特的酪氨酸激酶基因中,58个编码受体酪氨酸激酶蛋白。受体酪氨酸激酶已被证明不仅是正常细胞过程的关键调节因子,而且在许多类型的癌症的发生和发展中也起着至关重要的作用。
大多数RTK是单亚基受体,但有些以多聚体复合物的形式存在,例如胰岛素受体,在没有激素的情况下形成二硫键连接的二聚体;此外,配体与细胞外域的结合会诱导受体二聚体的形成。每个单体都有一个由25-38个氨基酸组成的单一疏水性跨膜结构域、一个细胞外N端区域和一个细胞内C端区域。细胞外N端区域表现出多种保守元件,包括免疫球蛋白 (Ig) 样或表皮生长因子 (EGF) 样结构域、纤连蛋白 III 型重复序列或富含半胱氨酸的区域,这些区域是每种RTK亚家族的特征;这些结构域主要包含配体结合位点,该位点结合细胞外配体,例如特定的生长因子或激素。细胞内C端区域显示出最高水平的保守性,并包含负责这些受体激酶活性的催化结构域,该结构域催化受体自身磷酸化和RTK底物的酪氨酸磷酸化。
RTK家族
[edit | edit source]表皮生长因子受体家族
ErbB蛋白家族或表皮生长因子受体 (EGFR) 家族是一个由四个结构相关的受体酪氨酸激酶组成的家族。人类中ErbB信号传导不足与神经退行性疾病的发生有关,如多发性硬化症和阿尔茨海默病。在小鼠中,ErbB家族中任何成员的信号传导缺失会导致胚胎致死,并伴有肺、皮肤、心脏和大脑等器官的缺陷。ErbB信号传导过度与多种类型的实体瘤的发生有关。ErbB-1 和 ErbB-2 在许多人类癌症中被发现,它们过度的信号传导可能是这些肿瘤发生和恶性增殖的关键因素。
成纤维细胞生长因子受体 (FGFR) 家族
成纤维细胞生长因子包括 23 个成员,是最大的生长因子配体家族。四个成纤维细胞生长因子受体 (FGFR) 基因的自然选择性剪接导致产生超过 48 种不同的 FGFR 同种型。这些同种型在配体结合特性和激酶结构域方面有所不同;但是,它们都共享一个由三个免疫球蛋白 (Ig) 样结构域 (D1-D3) 组成的共同细胞外区域,因此属于免疫球蛋白超家族。与 FGF 的相互作用发生在 FGFR 结构域 D2 和 D3 处。每个受体可以被几种 FGF 激活。在许多情况下,FGF 本身也可以激活不止一个受体,但 FGF-7 除外,它只能激活 FGFR2b。一个第五个 FGFR 蛋白 FGFR5 的基因也被鉴定出来。与 FGFR 1-4 相比,它缺乏细胞质酪氨酸激酶结构域,并且一个同种型 FGFR5γ 仅包含细胞外结构域 D1 和 D2。
血管内皮生长因子受体 (VEGFR) 家族
血管内皮生长因子 (VEGF) 是血管内皮细胞增殖和血管通透性的主要诱导剂之一。两种 RTK 在细胞表面结合 VEGF,即 VEGFR-1 (Flt-1) 和 VEGFR-2 (KDR/Flk-1)。VEGF 受体有一个由七个 Ig 样结构域组成的细胞外部分,因此,与 FGFR 一样,属于免疫球蛋白超家族。它们还拥有一个单一的跨膜跨越区域和一个包含分裂酪氨酸激酶结构域的细胞内部分。VEGF-A 与 VEGFR-1 (Flt-1) 和 VEGFR-2 (KDR/Flk-1) 结合。VEGFR-2 似乎介导了 VEGF 的几乎所有已知细胞反应。VEGFR-1 的功能尚不清楚,尽管它被认为可以调节 VEGFR-2 的信号传导。VEGFR-1 的另一个功能可能是作为假受体/诱饵受体,将 VEGF 从 VEGFR-2 结合中隔离出来(这似乎在胚胎血管生成过程中尤其重要)。第三个受体已被发现 (VEGFR-3);但是,VEGF-A 不是该受体的配体。VEGFR-3 介导响应于 VEGF-C 和 VEGF-D 的淋巴管生成。
RET 受体家族
RET 基因的自然选择性剪接导致产生 3 种不同的 RET 蛋白异构体。RET51、RET43 和 RET9 分别在其 C 末端尾部含有 51、43 和 9 个氨基酸。异构体 RET51 和 RET9 的生物学作用在体内得到了最深入的研究,因为它们是 RET 存在的最常见异构体。RET 是神经生长因子 (GDNF) 家族的细胞外信号分子或配体 (GFL) 的受体。为了激活 RET,首先 GFL 必须与一个糖基磷脂酰肌醇 (GPI) 锚定的共受体形成复合物。共受体本身被归类为 GDNF 受体-α (GFRα) 蛋白家族的成员。GFRα 家族的不同成员 (GFRα1-GFRα4) 对特定的 GFL 表现出特异性结合活性。在 GFL-GFRα 复合物形成后,该复合物然后将两个 RET 分子聚集在一起,触发每个 RET 分子中酪氨酸激酶结构域内特定酪氨酸残基的顺式自磷酸化。这些酪氨酸的磷酸化随后启动细胞内信号转导过程。
Eph 受体家族
Ephrin 和 Eph 受体是 RTK 最大的亚家族。
- ↑ a b Jesse Gray, Shana Groeschler, Tony Le, Zara Gonzalez (2002). "膜结构" (SWF). Davidson College. Retrieved 2007-01-11.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ↑ A D Bangham and R W Horne."磷脂的负染色及其表面活性剂结构修饰在电子显微镜下的观察."《分子生物学杂志》. 8. (1964) 660-668.
- ↑ D D Lasic."囊泡形成的机制."《生物化学杂志》. 256. (1988) 1-11.
- ↑ F Szoka and D Papahadjopoulos."脂质囊泡 (脂质体) 的比较性质和制备方法."《生物物理学和生物工程年度回顾》. 9. (1980) 467-508.
- ↑ W S Trimble, D M Cowan, and R H Scheller."VAMP-1:一种突触囊泡相关整合膜蛋白."《美国国家科学院院刊》. 85. (1988) 4538-4542.
- ↑ D Papahadjapoulos and N Miller."磷脂模型膜 I. 水合液晶的结构特征."《生物化学与生物物理学报》. 135. (1967) 624-638.
- ↑ H Trauble and D H Haynes."脂质双层薄片层状结构在晶体-液晶相变时的体积变化."《化学物理学脂质》. 7. (1971) 324-335.
- ↑ J Popplewell, M Swann, N Freeman, C McDonnell and R Ford, "定量研究蜂毒肽对脂质体的影响."《生物化学与生物物理学报》(2007)1768 13-20
- ↑ L Guohua and R C Macdonald."脂质双层囊泡融合:高速显微荧光光谱捕获的中间体."《生物物理学杂志》. 85. (2003) 1585-1599.
- ↑ C Dietrich, L A Bagatolli, Z N Volovyk, N L Thompson, et al."在模型膜中重建的脂筏."《生物物理学杂志》. 80. (2001) 1417-1428.
- ↑ Matosevic, S.; Paegel, B. 美国化学学会杂志 文章 ASAP DO1: 10.1021/ja109137s
