生物化学原理/酶
酶是有机催化剂,对所有生物体都很重要,因为细胞中不断地进行着受控的化学活动。酶通过改变化学反应的速度来调节代谢。降低活化能是为了改变化学反应的速度。此外,酶能够将一种形式的能量转化为另一种形式的能量。由于酶具有高度选择性,它们可能只催化一种或一类特定的反应。酶与底物结合的地方称为活性位点。底物是酶作用的分子。
有两种理论描述了酶的结合:1) 锁钥理论和 2) 诱导契合理论。
1) 锁钥理论:酶的活性位点的形状与其底物的形状互补。
2) 诱导契合理论:活性位点具有形状的灵活性,因此当合适的底物与酶的活性位点接触时,活性位点的形状会发生改变以适应底物。
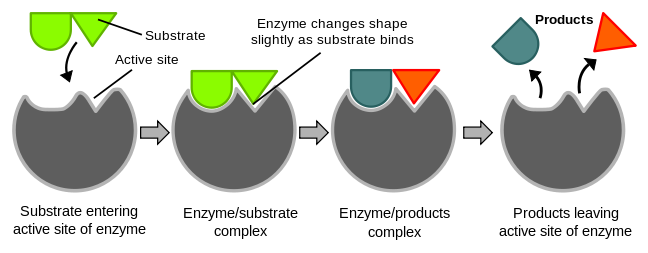
Figure 1 demonstrates the induced fit theory. Reference: en.Wikipedia, author: TimVickers
温度
由于大多数酶反应是可逆的,因此酶可以合成和分解分子。酶反应速率取决于几个因素:pH、温度以及酶和底物的浓度。一般来说,酶反应速率随着温度的升高而增加;然而,如果达到最佳温度 - 通常在 40°C 左右 - 酶会变性并失去与底物反应的能力。
pH
尽管每个酶都有自己的最佳 pH 值,但大多数酶反应在 pH 值 6 - 9 之间具有更高的反应速率。人体内酶反应的最大活性速率约为 pH 7.2,但胃蛋白酶除外,它在酸性条件下(通常约为 pH 2)具有较高的反应速率,胰腺酶在碱性条件下(通常约为 pH 9)具有较高的反应速率。
浓度
此外,底物和酶的浓度也会影响反应速率。酶和底物的浓度越低,反应速度越慢,因为酶上的活性位点被占用的越少。另一方面,酶和底物的浓度越高,反应速率越快,因为被占用的活性位点更多。然而,一旦酶反应的反应速度达到一定程度,反应速率将不再增加。

图 2 显示了浓度与反应速率之间的关系。参考:en.Wikipedia,作者:fullofstars
酶抑制剂 酶抑制剂有两类:1) 可逆抑制剂和 2) 不可逆抑制剂。可逆抑制剂在动力学上是可区分的,其特征是酶抑制剂复合物迅速解离。
可逆抑制剂有三个子类别:1) 竞争性 2) 非竞争性 和 3) 非竞争性 竞争性抑制
虽然酶的活性位点具有高度特异性,但与底物形状相似的分子有可能与活性位点结合。与分子结合的活性位点会干扰酶反应。因此,底物与活性位点结合的可能性更低,因此称为竞争性抑制。然而,只有在分子和底物含量相似的情况下才会发生竞争性抑制。在竞争性抑制剂中,酶只能与底物或抑制剂结合,而不能同时结合两者。此外,在竞争性抑制期间,底物的浓度会增加,而最大速度保持不变。

图 3 展示了酶的竞争性抑制是如何工作的。参考:en.Wikipedia,作者:Jerry Crimson Mann,由 TimVickers 修改,由 Fvasconcellos 矢量化。
非竞争性抑制 在非竞争性抑制中,抑制剂只与酶底物复合物结合。此外,在非竞争性抑制中,底物的浓度和最大速度都会降低。
非竞争性抑制
非竞争性抑制反应是不可逆的,因为分子与酶之间形成了不可通过添加过量底物来置换的强共价键。该分子也称为非竞争性抑制剂。在非竞争性抑制中,抑制剂和底物可以同时在不同的结合位点与酶结合。此外,它可以结合游离酶或酶底物复合物。此外,在非竞争性抑制期间,底物的浓度会增加,而最大速度会降低。
不可逆抑制剂有三个子类别:1) 基团特异性,2) 活性底物类似物,3) 机制依赖性抑制剂。基团特异性抑制剂只与氨基酸的特定侧链或某些化学基团反应。
活性底物类似物,也称为亲和标记。在活性底物类似物中,分子在结构上类似于酶的底物,并共价结合到活性位点残基。
机制依赖性抑制剂也称为自杀抑制剂。该机制有三个步骤,第一步是氧化,然后是烷基化,最后是质子化。
辅因子
某些催化反应需要辅因子。辅因子可以是无机元素(金属)或复杂的生物有机分子,其中许多来自维生素。全酶是指具有催化活性的酶;而脱辅酶是指没有辅因子的酶。
吉布斯自由能 (ΔG)
酶降低活化能。酶通过降低过渡态的吉布斯自由能来加速反应,过渡态也称为活化自由能。吉布斯自由能还提供了有关反应自发性的信息。
反应是自发的,如果 : ΔG<0
反应是非自发的,如果 : ΔG > 0
反应处于平衡状态,如果 : ΔG=0
 此图显示了酶的催化反应。参考:维基百科,作者:Fvasconcellos (talk · contribs)。
此图显示了酶的催化反应。参考:维基百科,作者:Fvasconcellos (talk · contribs)。
要确定反应的总吉布斯自由能,将产物的吉布斯自由能形成的总和减去反应物的吉布斯自由能形成的总和。关于 ΔG 的另一个重要点是,ΔG 无法解释反应的反应速率。
Active Site
酶的活性位点是底物结合的地方,也是化学反应发生的地方。活性位点是蛋白质上的一个小部分,是一个裂缝或裂隙。它还具有独特的微环境,底物通过多种弱相互作用结合。此外,酶的特异性取决于原子的精确排列。
生物化学反应
主要有两种酶促反应:1) 顺序反应和 2) 双置换反应
1) 顺序反应:在顺序反应中,所有底物都在任何产物释放之前与酶结合。在有序顺序反应中,底物以确定的顺序与酶结合;而在随机顺序反应中,底物以不确定的顺序与酶结合。
2) 双置换反应:在双置换反应中,一种或多种产物在所有底物与酶结合之前被释放。
- ↑ Kaplan PCAT 2010-2011 版
