生物化学原理/糖异生和糖原合成
| 此页面已导入,需要去维基化. 书籍应谨慎使用维基链接,仅用于引用理解内容至关重要的技术或深奥术语。大多数(如果不是全部)维基链接都应该被删除。页面去维基化后,请删除{{dewikify}}。 |
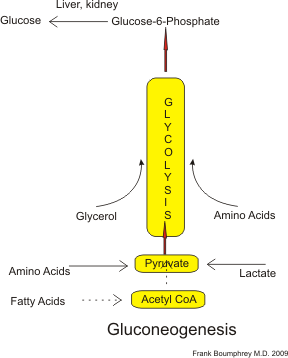
糖异生(简称GNG)是一条代谢途径,通过该途径可以从非碳水化合物碳底物(如乳酸、甘油和生糖氨基酸)生成葡萄糖。它是人类和其他许多动物维持血糖水平不至于过低(低血糖)的两种主要机制之一。维持血糖水平的另一种方式是通过糖原降解(糖原分解)。糖异生是一个普遍存在的过程,存在于植物、动物、真菌、细菌和其他微生物中。在动物中,糖异生主要发生在肝脏中,在较小程度上发生在肾脏皮质中。此过程发生在禁食、饥饿、低碳水化合物饮食或剧烈运动期间,并且是高度吸能的。例如,从磷酸烯醇丙酮酸到葡萄糖-6-磷酸的途径需要 6 个 ATP 分子。糖异生通常与酮症相关。糖异生也是治疗 II 型糖尿病的目标,如二甲双胍,它抑制葡萄糖形成并刺激细胞对葡萄糖的摄取。
乳酸被运回肝脏,在那里它通过使用乳酸脱氢酶的科里循环被转化为丙酮酸。丙酮酸是糖异生途径的第一个指定底物,然后可以用来生成葡萄糖。所有柠檬酸循环中间体,通过转化为草酰乙酸,除赖氨酸或亮氨酸以外的氨基酸,以及甘油也可以作为糖异生的底物。氨基酸的转氨或脱氨有助于它们的碳骨架直接进入循环(作为丙酮酸或草酰乙酸),或间接地通过柠檬酸循环进入循环。脂肪酸是否可以转化为动物体内的葡萄糖一直是生物化学中的一个长期问题。已知奇数链脂肪酸可以氧化产生丙酰辅酶 A,它是琥珀酰辅酶 A 的前体,琥珀酰辅酶 A 可以转化为丙酮酸并进入糖异生。在植物中,更确切地说,在幼苗中,乙醛酸循环可用于将脂肪酸(乙酸盐)转化为生物体的主要碳源。乙醛酸循环产生可以进入糖异生的四碳二羧酸。1995 年,研究人员在线虫中发现了乙醛酸循环。此外,乙醛酸酶类,苹果酸合酶和异柠檬酸裂解酶已在动物组织中被发现。编码苹果酸合酶基因的基因已在其他[后生动物]中被发现,包括节肢动物、棘皮动物,甚至一些脊椎动物。被发现拥有这些基因的哺乳动物包括单孔目动物(鸭嘴兽)和有袋目动物(负鼠),但不包括胎盘哺乳动物。异柠檬酸裂解酶基因仅在线虫中被发现,在线虫中,很明显它们起源于来自细菌的水平基因转移。人类中是否存在乙醛酸循环尚未确定,并且普遍认为脂肪酸不能直接转化为人类中的葡萄糖。然而,已发现当碳-14 供应在脂肪酸中时,它最终会出现在葡萄糖中。尽管有这些发现,但认为来自脂肪酸氧化的 2 碳乙酰辅酶 A 不会通过柠檬酸循环产生葡萄糖的净产量。然而,有可能在其他途径通过其他碳源,葡萄糖可以从乙酰辅酶 A 合成。事实上,已知酮体,尤其是 β-羟丁酸,可以至少少量转化为葡萄糖(β-羟丁酸转化为乙酰乙酸转化为丙酮转化为丙二醇转化为丙酮酸转化为葡萄糖)。甘油是三酰甘油分子的组成部分,可以用于糖异生。在人类中,糖异生限于肝脏,在较小程度上限于肾脏。在所有物种中,从丙酮酸和 TCA 循环中间体形成草酰乙酸的反应限于线粒体,而将 PEP 转化为葡萄糖的酶存在于细胞质中。将这两个部分连接起来的酶,将草酰乙酸转化为 PEP,PEP 羧激酶,其位置因物种而异:它可以在线粒体内完全存在,在细胞质内完全存在,或均匀分布在这两者之间,如人类一样。PEP 通过专用转运蛋白穿过线粒体膜的转运得以完成;然而,草酰乙酸没有这样的蛋白质。因此,缺乏线粒体内 PEP 的物种必须将草酰乙酸转化为苹果酸或天冬氨酸,从线粒体中输出,然后转化回草酰乙酸,以便糖异生能够继续进行。
糖异生是一条由 11 个酶催化反应组成的途径。该途径可以从线粒体或细胞质开始,具体取决于所使用的底物。许多反应是糖酵解中发现的可逆步骤。
糖异生从线粒体开始,通过丙酮酸的羧化生成草酰乙酸。该反应还需要一个 ATP 分子,并由丙酮酸羧化酶催化。该酶被乙酰辅酶 A(在肝脏的 β-氧化中产生)的高水平刺激,并被 ADP 的高水平抑制。草酰乙酸使用 NADH 还原为苹果酸,这是从线粒体中运输出去的必要步骤。
苹果酸使用 NAD+ 在细胞质中氧化为草酰乙酸,糖异生的其余步骤发生在那里。
草酰乙酸被脱羧和磷酸化,通过磷酸烯醇丙酮酸羧激酶产生磷酸烯醇丙酮酸。在这个反应中,一个 GTP 分子被水解成 GDP。反应的后续步骤与糖酵解的逆过程相同。然而,果糖-1,6-二磷酸酶将果糖-1,6-二磷酸转化为果糖 6-磷酸,需要一个水分子并释放一个磷酸盐。这也是糖异生的限速步骤。
葡萄糖-6-磷酸通过磷酸葡萄糖异构酶从果糖 6-磷酸形成。葡萄糖-6-磷酸可以用于其他代谢途径或被脱磷酸化成游离葡萄糖。虽然游离葡萄糖可以轻松地扩散进出细胞,但磷酸化形式(葡萄糖-6-磷酸)被锁在细胞中,这是一种机制,通过该机制细胞控制细胞内葡萄糖水平。
糖异生的最后一步,葡萄糖的形成,发生在内质网的腔内,在那里葡萄糖-6-磷酸被葡萄糖-6-磷酸酶水解生成葡萄糖。葡萄糖通过位于内质网膜上的葡萄糖转运蛋白被转运到细胞质中。
虽然糖异生中的大多数步骤是糖酵解中发现的步骤的逆反应,但三个受调节的并且强烈吸能的反应被替换为动力学上更有利的反应。糖酵解的己糖激酶/葡萄糖激酶、磷酸果糖激酶和丙酮酸激酶被葡萄糖-6-磷酸酶、果糖-1,6-二磷酸酶和 PEP 羧激酶取代。这种互惠控制系统允许糖酵解和糖异生相互抑制,并防止形成无用循环。糖异生的大多数负责酶存在于细胞质中;例外是线粒体丙酮酸羧化酶,以及在动物中,磷酸烯醇丙酮酸羧激酶。后者以存在于线粒体和细胞质中的同工酶的形式存在。糖异生的速率最终由关键酶果糖-1,6-二磷酸酶的作用控制,该酶也通过 cAMP 及其磷酸化作用被信号转导调节。大多数调节糖异生途径活性的因素通过抑制关键酶的活性或表达来实现。然而,乙酰辅酶 A 和柠檬酸分别激活糖异生酶(丙酮酸羧化酶和果糖-1,6-二磷酸酶)。由于循环的互惠控制,乙酰辅酶 A 和柠檬酸在丙酮酸激酶的活性中也起抑制作用。
 |
NAD+ NADH + H+  乳酸- 脱氢酶 |
 |
HCO3− ATP ADP + Pi 丙酮酸- 羧化酶 |
 |
GTP GDP +CO2 PEPCK |
 |
|
| L-乳酸 | 丙酮酸 | 草酰乙酸 | 磷酸烯醇丙酮酸 |
 |
+H2O 烯醇化酶  |
 |
磷酸- 甘油酸- 变位酶  |
 |
ATP ADP 磷酸- 甘油酸- 激酶 |

|
| 磷酸烯醇丙酮酸 | D-2-磷酸甘油酸 | D-3-磷酸甘油酸 | D-1,3-二磷酸甘油酸 |
 |
NADH NAD+ +H+ + Pi  甘油醛-3-磷酸脱氢酶 |
 |
三碳- 磷酸- 异构酶  |
 |
果糖-1,6-二磷酸醛缩酶 |
|
| D-1,3-二磷酸甘油酸 | D-甘油- 醛- 3-磷酸 |
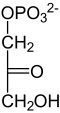
二羟基- 丙酮- 磷酸 |
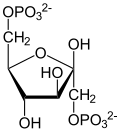
β-D-果糖-1,6-二磷酸 |
 |
H2O Pi 果糖-1,6-二磷酸酶 |
 |
葡萄糖-6-磷酸异构酶 |
 |
H2O Pi 葡萄糖-6-磷酸酶 |

|
| β-D-果糖-1,6-二磷酸 | β-D-果糖-6-磷酸 | α-D-葡萄糖-6-磷酸 | α-D-葡萄糖 |
在糖异生过程中,丙酮酸羧化酶是该途径中第一个从丙酮酸合成磷酸烯醇式丙酮酸(PEP)的酶。丙酮酸羧化酶在线粒体基质中起作用,利用一个ATP分子水解产生的能量将丙酮酸转化为草酰乙酸(OAA)。在下一步中,OAA 被脱羧并同时磷酸化,该过程由细胞质或线粒体中两种磷酸烯醇式丙酮酸羧激酶 (PEPCK) 同工酶之一催化,以产生 PEP。在正常的糖异生条件下,OAA 通过线粒体 PEPCK 转化为 PEP;生成的 PEP 然后通过柠檬酸循环载体系统从线粒体中转运出去,并被细胞质糖异生酶转化为葡萄糖。然而,在饥饿状态下,当细胞质 NADH 浓度低而线粒体 NADH 水平高时,草酰乙酸可以用作还原当量穿梭体。因此,OAA 通过线粒体苹果酸脱氢酶 (MDH) 转化为苹果酸。出口到细胞质后,苹果酸被转化回 OAA,伴随 NAD+ 的还原;OAA 随后转化为 PEP,与转运的还原当量 NADH 一起,可用于细胞质中的糖异生。肝脏和肾皮质中 PC 活性水平很高,以及其他糖异生酶(包括 PEPCK、果糖-1,6-二磷酸酶和葡萄糖-6-磷酸酶)活性很高,表明 PC 的主要作用是在这些器官中参与糖异生。在禁食或饥饿期间,当内源性葡萄糖需要某些组织(大脑、白细胞和肾髓质)时,PC 和其他糖异生酶的表达会升高。在大鼠和小鼠中,营养状况的改变已被证明会影响肝脏 PC 的活性。禁食促进肝脏葡萄糖生成,这种生成由丙酮酸通量增加维持,并且 PC 活性和蛋白质浓度增加;糖尿病通过提高底物的摄取并增加肝脏 PC 中的通量,同样会增加小鼠和大鼠的糖异生。与其他糖异生酶类似,PC 受胰高血糖素和糖皮质激素的正向调节,而受胰岛素的负向调节。进一步支持 PC 在糖异生中的关键作用的是,在奶牛中,它们在足够的营养水平下具有己糖吸收能力,PC 和相关的糖异生酶 PEPCK 在过渡到泌乳期间显着升高,以支持乳汁生产中乳糖的合成。除了 PC 在糖异生中的作用外,PC 还为三羧酸循环 (TCA) 循环发挥补充作用(酶催化反应,可以补充 TCA 循环中中间体的供应),当中间体被用于不同的生物合成目的时 (对于提供草酰乙酸至关重要)。
磷酸烯醇式丙酮酸羧激酶 (PEPCK) 是一种裂合酶家族中的酶,用于糖异生代谢途径。它将草酰乙酸转化为磷酸烯醇式丙酮酸和二氧化碳。它以两种形式存在,细胞质形式和线粒体形式。研究表明,PEPCK 催化糖异生的限速步骤,糖异生是合成葡萄糖的过程。因此,该酶被认为在葡萄糖稳态中至关重要,这一点可以通过实验室小鼠的实验得到证明,这些小鼠由于 PEPCK 过表达而患上了 2 型糖尿病。最近的一项研究表明,PEPCK 在糖异生中发挥的作用可能是通过柠檬酸循环介导的,柠檬酸循环的活性与 PEPCK 的丰度直接相关。发现 PEPCK 水平本身与小鼠肝脏中的糖异生没有高度相关性,正如以前的研究表明的那样。因此,PEPCK 在糖异生中的作用可能比以前认为的更复杂,并且涉及更多因素。
该基因属于 GPI 家族,其成员编码参与能量途径的多功能磷酸葡萄糖异构酶蛋白。该基因编码的蛋白质是一种二聚体酶,催化葡萄糖-6-磷酸和果糖-6-磷酸的可逆异构化。
葡萄糖 6-磷酸 <=> 果糖 6-磷酸
该蛋白质在细胞内部和外部具有不同的功能。在细胞质中,该蛋白质参与糖酵解和糖异生,而在细胞外,它充当脊髓和感觉神经元的营养因子。相同的蛋白质也由癌细胞分泌,在那里它被称为自分泌运动因子,并刺激转移。该基因的缺陷是导致非球形红细胞溶血性贫血的原因,严重的酶缺乏症可能与胎儿水肿、新生儿死亡和神经损伤有关。
什么是科里循环?
科里循环 科里循环,以其发现者卡尔·科里和格蒂·科里命名,指的是肌肉中由无氧糖酵解产生的乳酸转移到肝脏并转化为葡萄糖的代谢途径,然后葡萄糖返回肌肉并再次转化为乳酸。肌肉活动需要能量,这种能量由骨骼肌中糖原的分解提供。糖原分解(称为糖原分解)释放葡萄糖的形式为葡萄糖-6-磷酸 (G-6-P)。G-6-P 容易被糖酵解消耗,糖酵解过程为肌肉细胞提供 ATP 作为能量来源。在肌肉活动期间,ATP 的储存需要不断补充。当氧气供应充足时,这种能量来自将糖酵解的产物之一丙酮酸送入克雷布斯循环。当氧气供应不足时,通常发生在剧烈的肌肉活动期间,能量必须通过无氧呼吸释放。无氧呼吸通过乳酸脱氢酶将丙酮酸转化为乳酸。最重要的是,发酵再生了 NAD+,保持了 NAD+ 的浓度,以便可以发生额外的糖酵解反应。有关详细信息,请参阅糖酵解和发酵的主要文章。乳酸通过无氧发酵产生,而不是在肌肉细胞内积累,而是被肝脏吸收。这启动了科里循环的另一半。在肝脏中,发生糖异生。从直观的角度来看,糖异生通过将乳酸首先转化为丙酮酸,然后最终转化回葡萄糖,逆转了糖酵解和发酵。葡萄糖然后通过血液供应给肌肉;它已经准备好被送入进一步的糖酵解反应。如果肌肉活动停止,则葡萄糖用于通过糖原合成来补充糖原的供应。总的来说,循环的糖酵解部分产生 2 个 ATP 分子,而糖异生部分消耗 6 个 ATP 分子。循环的每一次迭代都必须通过净消耗 4 个 ATP 分子来维持。因此,该循环不能无限期地持续下去。ATP 分子的密集消耗表明,科里循环将代谢负担从肌肉转移到肝脏。该循环的重要性基于在无氧条件下防止肌肉中乳酸酸中毒。但是,通常在这种情况发生之前,乳酸会从肌肉中移出并进入肝脏。该循环在肌肉活动期间产生 ATP(能量来源)中也很重要。科里循环在肌肉活动停止时运行得更有效。这使得氧债能够得到偿还,从而使克雷布斯循环和电子传递链能够以最高效率产生能量。
糖原合成是糖原合成的过程,其中葡萄糖分子被添加到糖原链中以进行储存。该过程在科里循环后的休息期间在肝脏中被激活,并且还被胰岛素激活以响应高葡萄糖水平,例如在含有碳水化合物的膳食后。

葡萄糖在葡萄糖激酶或己糖激酶的作用下转化为葡萄糖-6-磷酸。**葡萄糖-6-磷酸在磷酸葡萄糖变位酶的作用下转化为葡萄糖-1-磷酸,并经过一个必需的中间步骤,即葡萄糖-1,6-二磷酸。** 磷酸葡萄糖变位酶 (EC 5.4.2.2) 是一种酶,它在正向反应中将葡萄糖单体上的磷酸基团从 1' 位转移到 6' 位,或在反向反应中将磷酸基团从 6' 位转移到 1' 位。具体来说,它促进葡萄糖 1-磷酸和葡萄糖 6-磷酸的相互转化。当存在高浓度的葡萄糖-6-磷酸时,磷酸葡萄糖变位酶也会以相反的方式起作用。在这种情况下,是 1 号碳被磷酸化,而 6 号碳被去磷酸化。生成的葡萄糖-1-磷酸然后通过一些中间步骤转化为 UDP-葡萄糖。如果被胰岛素激活,糖原合成酶将继续从 UDP-葡萄糖复合物中剪切葡萄糖,并将其添加到糖原分子中。
葡萄糖-1-磷酸在尿苷转移酶 (也称为 UDP-葡萄糖焦磷酸化酶) 的作用下转化为 UDP-葡萄糖,并形成焦磷酸,焦磷酸被焦磷酸酶水解为 2 个 Pi 分子。
UTP-葡萄糖-1-磷酸尿苷转移酶,也称为葡萄糖-1-磷酸尿苷转移酶 (或 UDP-葡萄糖焦磷酸化酶),是一种与糖原生成相关的酶。它从葡萄糖-1-磷酸和 UTP 合成 UDP-葡萄糖,即:
葡萄糖-1-磷酸 + UTP -- UDP-葡萄糖 + 焦磷酸

控制和调节
[edit | edit source]糖原合成酶将葡萄糖分子组装成一条链,糖原合成酶必须作用于预先存在的糖原引物或糖原蛋白 (形成引物的小蛋白)。连接葡萄糖单元的机制是糖原合成酶与 UDPG 结合,导致它分解为一个鎓离子,在糖原分解中也会形成。这种鎓离子可以很容易地添加到糖原链 4 端的葡萄糖基残基的 4-羟基上。分支是由分支酶 (也称为淀粉-α(1:4)->α(1:6) 转糖基酶) 形成的,它将链的末端通过 α-1:6 糖苷键转移到更早的部分,形成分支,这些分支通过添加更多 α-1:4 糖苷单元进一步生长。
糖原生成对激素控制有反应。主要的控制方式之一是糖原合成酶和糖原磷酸化酶的不同磷酸化。这由受激素活性控制的酶调节,而激素活性又受许多因素调节。因此,与变构调节系统相比,存在许多不同的效应器。
肾上腺素 (肾上腺素)
糖原磷酸化酶被磷酸化激活,而糖原合成酶被抑制。糖原磷酸化酶被酶磷酸化酶激酶从其活性较低的 b 型转化为活性 a 型。后者被蛋白激酶 A 激活,被磷蛋白磷酸酶-1 失活。蛋白激酶 A 本身被激素肾上腺素激活。肾上腺素与激活腺苷酸环化酶的受体蛋白结合。后者导致 ATP 生成环状 AMP;两个环状 AMP 分子与蛋白激酶 A 的调节亚基结合,使其激活,从而允许蛋白激酶 A 的催化亚基从组装中分离出来,并磷酸化其他蛋白质。回到糖原磷酸化酶,活性较低的型 (b) 本身可以在没有构象变化的情况下被激活。5'AMP 作为变构激活剂,而 ATP 作为抑制剂,如前所述的磷酸果糖激酶控制,有助于改变流量速率以响应能量需求。肾上腺素不仅激活糖原磷酸化酶,而且抑制糖原合成酶。这放大了激活糖原磷酸化酶的效果。这种抑制作用是通过类似的机制实现的,因为蛋白激酶 A 磷酸化该酶,从而降低了活性。这被称为协调的相互控制。有关糖原生成调节的更多信息,请参考糖酵解。
胰岛素
胰岛素对肾上腺素有拮抗作用。当胰岛素结合到 G 蛋白偶联受体上时,G 蛋白中 GDP 的 α 亚基转变为 GTP 并与抑制性 β 和 γ 亚基分离。α 亚基与腺苷酸环化酶结合以抑制其活性。结果,产生的 cAMP 较少,因此产生的蛋白激酶 A 较少。因此,蛋白激酶 A 的目标之一,糖原合成酶,将处于非磷酸化状态,这是糖原合成酶的活性状态。活性糖原合成酶可以在饱餐后降低血糖水平。
钙离子
钙离子或环状 AMP (cAMP) 作为第二信使。这是一个负控制的例子。钙离子激活磷酸化酶激酶。这激活糖原磷酸化酶并抑制糖原合成酶。
糖原分支酶
[edit | edit source]糖原分支酶是一种参与将葡萄糖转化为糖原的酶。它在生长的糖原分子中添加分支。糖原是由大量葡萄糖单元连接在一起的支链聚合物。该结构基于葡萄糖单元链,每对单元的 1 号碳原子和 4 号碳原子之间有连接 (α 1, 4 连接)。这些连接由酶糖原合成酶催化。每 10 到 14 个葡萄糖单元,就会出现一个带有额外葡萄糖单元链的侧支。侧链连接到葡萄糖单元的 6 号碳原子,连接被称为 α-1,6 糖苷键。为了形成这种连接,使用了另一种被称为分支酶的酶。分支酶将七个葡萄糖单元的链连接到葡萄糖单元的第六个碳原子,通常位于糖原分子的内部位置。
这种酶属于转移酶家族,更具体地说,是那些转移己糖 (己糖转移酶) 的糖基转移酶。该酶类别的系统名称是 1,4-α-D-葡聚糖:1,4-α-D-葡聚糖 6-α-D-(1,4-α-D-葡聚糖)-转移酶。其他常用名称包括分支酶、淀粉-(1,4→1,6)-转糖基酶、Q 酶、α-葡聚糖-分支糖基转移酶、淀粉酶异构酶、酶分支因子、分支糖基转移酶、酶 Q、葡聚糖转糖基酶、1,4-α-葡聚糖分支酶、植物分支酶、α-1,4-葡聚糖:α-1,4-葡聚糖-6-糖基转移酶和淀粉分支酶。这种酶参与淀粉和蔗糖的代谢。
葡萄糖的转运
[edit | edit source]葡萄糖是大多数细胞代谢的必需底物。由于葡萄糖是极性分子,因此通过生物膜的转运需要特定的转运蛋白。
**主动转运 - 共转运蛋白** 葡萄糖通过肠道和肾脏上皮细胞的顶端膜的转运取决于次级主动 Na+/葡萄糖同向转运蛋白 SGLT-1 和 SGLT-2 的存在,它们利用 Na+ 离子沿其电化学梯度共转运提供的能量,将葡萄糖浓缩到细胞内。
**被动转运 - GLUTs** 葡萄糖通过细胞膜的促进扩散由葡萄糖转运蛋白 (蛋白符号 GLUT,基因符号 SLC2 代表溶质转运蛋白家族 2) 催化,这些转运蛋白属于转运促进剂超家族 (主要促进剂超家族),包括有机阴离子和阳离子转运蛋白、酵母己糖转运蛋白、植物己糖/质子同向转运蛋白和细菌糖/质子同向转运蛋白。此类转运蛋白的分子运动是通过促进扩散进行的。这使得它们与主动转运蛋白不同,主动转运蛋白通常需要 ATP 的存在来驱动它们的转运机制,并在 ATP/ADP 比例下降过低时停滞。它们不依赖于能量。
结构
[edit | edit source]GLUTs 是整合膜蛋白,包含 12 个跨膜螺旋,氨基末端和羧基末端都暴露在质膜的胞质侧。GLUT 蛋白根据一种交替构象模型[1][2][3]转运葡萄糖和相关己糖,该模型预测转运蛋白将一个底物结合位点暴露在细胞的外侧或内侧。葡萄糖与一个位点的结合会引起与转运相关的构象变化,并将葡萄糖释放到膜的另一侧。内部和外部的葡萄糖结合位点似乎位于跨膜片段 9、10、11 中;[4] 此外,位于第七个跨膜片段的 QLS 基序可能参与转运底物的选择和亲和力。[5][6]
**葡萄糖转运蛋白 1 (或 GLUT1)**,也称为溶质转运蛋白家族 2,促进葡萄糖转运蛋白成员 1 (SLC2A1) 是一种蛋白质,在人类中由 SLC2A1 基因编码。GLUT1 促进葡萄糖穿过哺乳动物细胞质膜的转运。GLUT1 的行为类似于米氏酶,包含 12 个跨膜 α 螺旋,每个螺旋包含 20 个氨基酸残基。螺旋轮分析表明,跨膜 α 螺旋是两亲性的,一侧是极性的,另一侧是疏水的。这 6 个跨膜 α 螺旋被认为在膜中结合在一起,在中心形成一个极性通道,葡萄糖可以通过该通道穿过,疏水区域位于通道外侧,紧邻膜的脂肪酸尾部。红细胞的能量产生代谢取决于从血液血浆中不断供应葡萄糖,其中葡萄糖浓度维持在大约 5mM。葡萄糖通过特定的葡萄糖转运蛋白通过促进扩散进入红细胞,其速度比非催化跨膜扩散快约 50,000 倍。红细胞的葡萄糖转运蛋白 (称为 GLUT1,以区别于其他组织中相关的葡萄糖转运蛋白) 是一种 III 型整合蛋白,具有 12 个疏水片段,每个片段被认为形成一个跨膜螺旋。GLUT1 的详细结构尚不清楚,但一种合理的模型表明,几个螺旋的侧边组装会产生一个由亲水残基衬里的跨膜通道,当葡萄糖穿过该通道时,可以与葡萄糖形成氢键。GLUT1 负责所有细胞维持呼吸所需的低水平基础葡萄糖摄取。细胞膜中 GLUT1 的表达水平随着葡萄糖水平的降低而增加,随着葡萄糖水平的升高而降低。GLUT1 也是维生素 C 以及葡萄糖的主要受体,尤其是在不产生维生素 C 的哺乳动物中,作为适应性的一部分,通过参与维生素 C 回收过程来补偿。在能够产生维生素 C 的哺乳动物中,通常表达 GLUT4 而不是 GLUT1。
葡萄糖转运蛋白 2 (GLUT2),也称为溶质载体家族 2 (促进葡萄糖转运蛋白),成员 2 (SLC2A2),是一种跨膜载体蛋白,可以使葡萄糖被动地穿过细胞膜。它是肝脏和血液之间葡萄糖转移的主要转运蛋白,也是肾脏葡萄糖重吸收的主要转运蛋白。在人类中,这种蛋白质由 SLC2A2 基因编码。
GLUT2 存在于以下细胞膜中:肝脏 胰腺 β 细胞 下丘脑 小肠的基底外侧膜和刷状缘膜 肾小管细胞的基底外侧膜
SLC2A2 基因的缺陷与一种特殊的糖原储存病相关,称为范科尼-比克尔综合征。哈佛大学医学院和贝斯以色列女执事医疗中心新生儿和母胎医学的遗传学研究人员提出,这会给接受药物治疗的糖尿病孕妇造成问题,因为这些孕妇的葡萄糖水平不受控制,会使胎儿在早期发育的脑、脊髓和心脏中出现神经管和心脏缺陷。然而,尽管缺乏 GLUT2 的适应性是负面的,但重要的是要记住,未经治疗的妊娠糖尿病的主要结果似乎会导致婴儿体型过大,这可能是一种优势,在健康的 GLUT2 状态下可以很好地管理。在某些水肿的情况下,包括脑水肿,维持血液循环和间隙空间之间糖浓度的调节性渗透平衡至关重要。GLUT2 似乎对渗透调节特别重要,并且可以预防水肿引起的卒中、短暂性脑缺血发作或昏迷,尤其是在血糖浓度高于平均水平时。GLUT2 可以合理地称为“糖尿病葡萄糖转运蛋白”或“应激性高血糖葡萄糖转运蛋白”。
GLUT3 是一种高亲和力的 I 型葡萄糖转运蛋白同种型,主要在神经元中表达,据信是主要的葡萄糖转运蛋白同种型。它也在胎盘中表达。
葡萄糖转运蛋白 4 型,也称为 GLUT4,是一种蛋白质,在人类中由 GLUT4 基因编码。GLUT4 是存在于脂肪组织和横纹肌(骨骼肌和心肌)中的胰岛素调节葡萄糖转运蛋白,负责胰岛素调节的葡萄糖转运到细胞内。这种蛋白质仅在肌肉和脂肪细胞中表达,这是身体中对胰岛素有反应的两个主要组织。1988 年,David James 首次提供了这种独特葡萄糖转运蛋白的证据。
GLUT4 主要存在于
骨骼肌 心肌 脂肪组织
在没有胰岛素的情况下,GLUT4 会被隔离在肌肉和脂肪细胞内部的囊泡脂质双层中。胰岛素诱导 GLUT4 从细胞内储存部位转运到质膜。胰岛素与其二聚体形式的胰岛素受体结合。受体磷酸化并随后激活 IRS-1,IRS-1 又与 PI-3 激酶结合,PI-3 激酶将膜脂质 PIP2 转换为 PIP3。PIP3 生成 PKB(蛋白激酶 B)的结合位点,以及 PDK1 的结合位点,PDK1 与 PKB 共同定位,可以磷酸化并激活 PKB。一旦磷酸化,PKB 就处于其活性形式并磷酸化 TBC1D4,从而抑制与 TBC1D4 相关的 GTPase 激活域。对 GTPase 激活域的抑制使级联反应中的下一个蛋白质处于其活性形式,并刺激 GLUT4 在质膜上表达。在细胞表面,GLUT4 允许循环葡萄糖顺浓度梯度被动扩散到肌肉和脂肪细胞中。一旦进入细胞,葡萄糖就会在肝脏中被葡萄糖激酶和在其他组织中被己糖激酶迅速磷酸化形成 6-磷酸葡萄糖,然后进入糖酵解或聚合成糖原。6-磷酸葡萄糖不能扩散回细胞外,这也有助于维持葡萄糖被动进入细胞的浓度梯度。
糖原磷酸化酶是第一个被发现的别构酶。[7] 这一成就只是 卡尔 和 格蒂·科里 取得的许多里程碑成就之一。1943 年,在阿达·格林的帮助下,这对夫妇证明了糖原磷酸化酶根据其磷酸化状态存在于 a 或 b 形式,以及根据 AMP 的存在存在于 R 或 T 状态。[8] 糖原磷酸化酶单体是一种大型蛋白质,由 842 个氨基酸组成,在肌肉细胞中的质量为 97.434 kDa。虽然该酶可以以无活性单体或四聚体形式存在,但它以两个相同亚基的 二聚体 形式具有生物活性。[9]

糖原磷酸化酶二聚体具有许多具有生物学意义的区域,包括 催化 位点、糖原结合位点、别构 位点,以及一个可逆磷酸化的丝氨酸残基。首先,催化位点相对埋藏,距离蛋白质表面和亚基界面 15Å。[10] 催化位点不易接触到表面的特点非常重要,因为它使得蛋白质活性极易受到调节,因为小的别构效应可以极大地增加糖原进入该位点的相对通量。
也许最重要的 调节位点 是 Ser14,它是可逆 磷酸化 的位点,非常靠近亚基界面。与磷酸化以及磷酸化酶 b 转换为磷酸化酶 a 相关的结构变化是最初无序的残基 10 到 22 排列成 α 螺旋。即使在没有 AMP 的情况下,这种变化也会使磷酸化酶活性提高高达 25%,并且会进一步增强 AMP 的激活。[11]
糖原磷酸化酶肌肉同种型上 AMP 结合的别构位点与 Ser14 一样,都靠近亚基界面。AMP 在该位点的结合,对应于酶从 T 状态转换为 R 状态的变化,会导致亚基界面处的二级结构发生微小变化,从而导致四级结构发生重大变化。[7] AMP 结合会使两个亚基的塔状螺旋(残基 262-278)旋转 50˚,从而通过更大的组织和亚基间相互作用来实现。这种塔状螺旋的旋转会导致两个亚基彼此旋转 10˚,更重要的是会使阻碍 T 状态催化位点访问但不会阻碍 R 状态访问的残基 282-286(280s 环)无序。[10]
糖原磷酸化酶蛋白质上最后一个,也许是最奇怪的位点是所谓的糖原储存位点。残基 397-437 形成这种结构,使蛋白质能够与糖原链共价结合,距离催化位点 30 Å。该位点很可能是该酶在开始切割末端葡萄糖分子之前与糖原颗粒结合的位点。事实上,细胞中 70% 的二聚体磷酸化酶以与糖原颗粒结合的形式存在,而不是自由漂浮的形式。[12]
在哺乳动物中,糖原磷酸化酶的主要 同工酶 存在于肌肉、肝脏和脑中。脑型在成年脑和胚胎组织中占主导地位,而肝脏型和肌肉型分别在成年肝脏和骨骼肌中占主导地位。[13]
糖原磷酸化酶的总反应写成
(α-1,4 糖原链)n + Pi ↔ (α-1,4 糖原链)n-1 + D-葡萄糖-1-磷酸。[14]
糖原磷酸化酶将 糖原 分解成 葡萄糖 亚基。糖原 中缺少一个 葡萄糖 分子,并且游离的 葡萄糖 分子以 葡萄糖-1-磷酸 的形式存在。为了用于 代谢,它必须通过 磷酸葡萄糖变位酶 转换为 葡萄糖-6-磷酸。
虽然该反应在溶液中是可逆的,但在细胞中,该酶仅如上所示在正向方向上起作用,因为无机磷酸的浓度远高于葡萄糖-1-磷酸的浓度。[14]

糖原磷酸化酶只能作用于糖原的线性链(α1-4 糖苷键)。它在距离α1-6 支链(在糖原中非常常见)四个残基的地方就会停止工作。在这种情况下,需要一种去支链酶来使该区域的链变直。此外,转移酶将 3 个葡萄糖基残基从外侧支链转移到另一端,然后需要 α1-6 葡萄糖苷酶来断裂新线性链中剩余的(单个葡萄糖)α1-6 残基。完成所有这些步骤后,糖原磷酸化酶可以继续工作。该酶对 α1-4 链具有特异性,因为该分子包含一个 30 埃长的裂缝,其半径与糖原链形成的螺旋相同;这可以容纳 4-5 个葡萄糖基残基,但对于支链来说太窄了。该裂缝将糖原储存部位连接到活性催化部位。
糖原磷酸化酶在每个催化部位都含有磷酸吡哆醛(PLP,来源于维生素 B6)。磷酸吡哆醛与碱性残基(在本例中为 Lys680)连接,并共价形成希夫碱。一旦希夫碱连接形成,将 PLP 分子固定在活性部位后,PLP 上的磷酸基团就会很容易地向无机磷酸分子提供质子,从而使无机磷酸被形成 α-1,4 糖苷键的氧脱质子化。PLP 容易被脱质子化,因为它的负电荷不仅在磷酸基团中稳定,而且在吡啶环中也稳定,因此由 PLP 脱质子化产生的共轭碱非常稳定。质子化的氧现在代表了一个良好的离去基团,糖原链以SN1方式从末端糖原分离,形成一个在 1 位具有二级碳正离子的葡萄糖分子。最后,脱质子化的无机磷酸充当亲核试剂,并与碳正离子结合,形成葡萄糖-1-磷酸和一个缩短了一个葡萄糖分子的糖原链。
还有一种涉及半椅式构象中带正电荷的氧的替代机制。 [15]
抑制糖原磷酸化酶已被提出作为治疗2 型糖尿病的一种方法。[16] 由于肝脏中的葡萄糖生成已被证明在 2 型糖尿病患者中增加,[17] 抑制肝脏中糖原供应中葡萄糖的释放似乎是一种有效的方法。人类肝糖原磷酸化酶 (HLGP) 的克隆揭示了一个新的变构结合位点,该位点位于亚基界面附近,在通常用于研究的兔肌肉糖原磷酸化酶 (RMGP) 中不存在。该位点对与 AMP 变构位点相同的抑制剂不敏感,[18] 并且合成模拟葡萄糖结构的新抑制剂取得了最大的成功,因为葡萄糖-6-磷酸是 HLPG 的已知抑制剂,并且稳定了活性较低的 T 状态。 [19] 这些葡萄糖衍生物在抑制 HLPG 方面取得了一些成功,预测的 Ki 值低至 0.016 mM。 [20]
糖原磷酸化酶 (PYGM) 的肌肉亚型突变与麦克阿德尔病(糖原累积症 V 型)有关。迄今为止,已鉴定出 65 种以上导致麦克阿德尔病的 PYGM 基因突变。 [21][22] 麦克阿德尔病的症状包括肌肉无力、肌痛和耐力下降,所有这些都是由于肌肉组织中葡萄糖水平低造成的。 [23]
糖原磷酸化酶 (PYGL) 的肝脏亚型突变与赫氏病(糖原累积症 VI 型)有关。 [24][25] 赫氏病通常与轻微症状有关,这些症状通常仅限于低血糖,由于残留的酶活性,有时难以诊断。 [26]
糖原磷酸化酶 (PYGLB) 的脑亚型已被提出作为胃癌的生物标志物。 [27]
- ↑ Oka Y, Asano T, Shibasaki Y, Lin J, Tsukuda K, Katagiri H, Akanuma Y, Takaku F (1990). "C-terminal truncated glucose transporter is locked into an inward-facing form without transport activity". Nature. 345 (6275): 550–3. doi:10.1038/345550a0. PMID 2348864.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Hebert D, Carruthers A (1992). "Glucose transporter oligomeric structure determines transporter function. Reversible redox-dependent interconversions of tetrameric and dimeric GLUT1". J. Biol. Chem. 267 (33): 23829–38. PMID 1429721.
- ↑ Cloherty E, Sultzman L, Zottola R, Carruthers A (1995). "Net sugar transport is a multistep process. Evidence for cytosolic sugar binding sites in erythrocytes". Biochemistry. 34 (47): 15395–406. doi:10.1021/bi00047a002. PMID 7492539.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Hruz P, Mueckler M (2001). "Structural analysis of the GLUT1 facilitative glucose transporter (review)". Mol. Membr. Biol. 18 (3): 183–93. doi:10.1080/09687680110072140. PMID 11681785.
- ↑ Seatter M,De la Rue S,Porter L,Gould G(1998)。“葡萄糖转运蛋白家族跨膜螺旋 VII 中的 QLS 基序与 D-葡萄糖的 C-1 位置相互作用,并参与胞外结合位点的底物选择”。生物化学。37(5):1322–6。doi:10.1021/bi972322u。PMID 9477959.
{{cite journal}}:CS1 维护:多个名称:作者列表(链接) - ↑ Hruz P,Mueckler M(1999)。“GLUT1 葡萄糖转运蛋白跨膜片段 7 的半胱氨酸扫描诱变”。J. Biol. Chem。274(51):36176–80。doi:10.1074/jbc.274.51.36176。PMID 10593902.
- ↑ a b Johnson LN,Barford,D(1990)。“糖原磷酸化酶。别构反应的结构基础及与其他别构蛋白的比较”。生物化学杂志。265(5):2409–2412。PMID 2137445.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:多个名称:作者列表(链接) - ↑ Cori GT,Green AA(1943)。“结晶肌肉磷酸化酶 II 辅基”。生物化学杂志。151(1):21–29。
{{cite journal}}: 未知参数|month=被忽略(帮助) - ↑ Browner MF,Fletterick RJ(1992)。“磷酸化酶:一种生物换能器”。生物化学科学趋势。17(2):66–71。doi:10.1016/0968-0004(92)90504-3。PMID 1566331.
{{cite journal}}: 未知参数|month=被忽略(帮助) - ↑ a b Johnson LN(1992)。“糖原磷酸化酶:磷酸化和别构效应物的控制”。FASEB 杂志。6(6):2274–82。PMID 1544539.
{{cite journal}}: 未知参数|month=被忽略(帮助) - ↑ Newgard CB,Hwang PK,Fletterick,RJ(1989)。“糖原磷酸化酶家族:结构和功能”。生物化学与分子生物学批判性评论。24(1):69–99。doi:10.3109/10409238909082552。PMID 2667896.
{{cite journal}}: 引用包含空未知参数:|month=(帮助)CS1 维护:多个名称:作者列表(链接) - ↑ Meyer F,Heilmeyer LM Jr,Haschke RH,Fischer EH(1970)。“肌肉糖原颗粒中磷酸化酶活性的控制。I. 蛋白质-糖原复合物的分离和表征”。生物化学杂志。245(24):6642–6648。PMID 4320610.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:多个名称:作者列表(链接) - ↑ David ES,Crerar MM(1986)。“成年大鼠组织中肌肉糖原磷酸化酶 mRNA 和酶量的定量”。生物化学与生物物理学报。880(1):78–90。PMID 3510670.
{{cite journal}}: 未知参数|month=被忽略(帮助) - ↑ a b Livanova NB, Chebotareva NA, Eronina TB, Kurganov BI (2002). "磷酸吡哆醛5′作为肌肉糖原磷酸化酶b的催化和构象辅因子". 生物化学(莫斯科). 67 (10): 1089–1998. doi:10.1023/A:1020978825802. PMID 12460107.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Palm D, Klein HW, Schinzel R, Buehner M, Helmreich, EJM (1990). "磷酸吡哆醛5'-磷酸在糖原磷酸化酶催化中的作用". 生物化学. 29 (5): 1099–1107. doi:10.1021/bi00457a001. PMID 2182117.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Somsák L, Nagya V, Hadady Z, Docsa T, Gergely P. (2003). "糖原磷酸化酶的葡萄糖类似物抑制剂作为潜在的抗糖尿病药物:最新进展". 当代药理学设计. 9 (15): 1177–89. doi:10.2174/1381612033454919. PMID 12769745.
{{cite journal}}: 引用有空闲未知参数:|month=(帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Moller DE (2001). "2型糖尿病和代谢综合征的新药靶点". 自然. 414 (6865): 821–7. doi:10.1038/414821a. PMID 11742415.
{{cite journal}}: 未知参数|month=被忽略 (帮助) - ↑ Coats WS, Browner MF, Fletterick RJ, Newgard CB (1991). "一种具有AMP变构激活作用的工程化肝糖原磷酸化酶". 生物化学杂志. 266 (24): 16113–9. PMID 1874749.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Oikonomakos NG, Kontou M, Zographos SE, Tsitoura HS, Johnson LN, Watson KA, Mitchell EP, Fleet GW, Son JC, Bichard CJ; et al. (1994). "潜在的抗糖尿病药物的设计:对一些β-D-葡萄糖类似物糖原磷酸化酶抑制剂的实验研究". 欧洲药物代谢与药理学杂志. 19 (3): 185–92. doi:10.1007/BF03188920. PMID 7867660.
{{cite journal}}: 在|author=中显式使用et al. (帮助); 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Hopfinger A J, Reaka A, Venkatarangan P, Duca J S, Wang S. (1999). "通过4D-QSAR分析预测配体-受体结合自由能:应用于一组糖原磷酸化酶的葡萄糖类似物抑制剂". 化学信息与计算机科学杂志. 39: 1141–1150. doi:10.1021.
{{cite journal}}: 检查|doi=值 (帮助); 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Nogales-Gadea G, Arenas J, Andreu AL (2007). "麦卡德尔病的分子遗传学". Curr Neurol Neurosci Rep. 7 (1): 84–92. doi:10.1007/s11910-007-0026-2. PMID 17217859.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Andreu AL,Nogales-Gadea G,Cassandrini D,Arenas J,Bruno C(2007)。“麦卡德尔病:分子遗传学更新”。Acta Myol. 26(1):53–7。 PMID 17915571.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接) - ↑ Grünfeld JP,Ganeval D,Chanard J,Fardeau M,Dreyfus JC(1972)。“麦卡德尔病的急性肾衰竭。两个病例报告”。新英格兰医学杂志. 286(23):1237–41。 doi:10.1056/NEJM197206082862304. PMID 4502558.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接) - ↑ Burwinkel B,Bakker HD,Herschkovitz E,Moses SW,Shin YS,Kilimann MW(1998)。"肝糖原磷酸化酶基因 (PYGL) 突变导致 VI 型糖原累积症". Am. J. Hum. Genet. 62(4):785–91。 doi:10.1086/301790. PMC 1377030. PMID 9529348.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接) - ↑ Chang S,Rosenberg MJ,Morton H,Francomano CA,Biesecker LG(1998)。“在 VI 型糖原累积症中识别肝糖原磷酸化酶的突变”。Hum. Mol. Genet. 7(5):865–70。 doi:10.1093/hmg/7.5.865. PMID 9536091.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接) - ↑ Tang NL,Hui J,Young E,Worthington V,To KF,Cheung KL,Li CK,Fok TF(2003)。“肝糖原累积症患者糖原磷酸化酶基因的新突变 (G233D) 及残留酶活性”。分子遗传学与代谢. 79(2):142–145。 doi:10.1016/S1096-7192(03)00068-4. PMID 12809646.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接) - ↑ Shimada S,Matsuzaki H,Marutsuka T,Shiomori K,Ogawa M(2001)。“参考脑 (胎儿) 型糖原磷酸化酶表达的胃癌的胃肠表型”。J. Gastroenterol. 36(7):457–64。 doi:10.1007/s005350170068. PMID 11480789.
{{cite journal}}: 未知参数|month=被忽略(帮助)CS1 维护:作者列表中有多个名称(链接)


