生物化学原理/脂类
在生物化学中,脂肪酸是具有长而不分支的脂肪族尾部(链)的羧酸,该尾部要么是饱和的,要么是不饱和的。大多数天然存在的脂肪酸具有偶数个碳原子的链,从 4 到 28 不等。脂肪酸通常来自甘油三酯或磷脂。当它们不连接到其他分子时,它们被称为“游离”脂肪酸。脂肪酸是重要的燃料来源,因为它们的代谢会产生大量的 ATP。许多细胞类型可以使用葡萄糖或脂肪酸来实现这一点。特别是心脏和骨骼肌更喜欢脂肪酸。大脑不能使用脂肪酸作为燃料来源;它依赖于葡萄糖或酮体。

脂肪酸使用几种不同的命名系统。下表描述了最常见的系统。
| 系统 | 示例 | 解释 |
|---|---|---|
| 普通命名法 | 棕榈油酸 | 普通名称(或俗名)是非系统的历史名称,它们是文献中最常用的命名系统。最常见的脂肪酸除了它们的系统名称(见下文)之外还有普通名称。这些名称通常不遵循任何模式,但它们简洁明了,并且通常是不含糊的。 |
| 系统命名法 | (9Z)-十八碳烯酸 | 系统名称(或IUPAC 名称)来自 1979 年发布的标准有机化学命名法 IUPAC 规则,[1] 以及 1977 年专门针对脂类发布的一项建议。[2] 计数从羧酸端开始。双键用顺反异构体-/反式-符号或E-/Z-符号标记,在适当的情况下。这种符号通常比普通命名法更冗长,但优点是它在技术上更清晰和描述性。 |
| Δx 命名法 | 顺式,顺式-Δ9,Δ12 十八碳二烯酸 | 在Δx(或delta-x)命名法中,每个双键用 Δx 表示,其中双键位于从羧酸端计数的第x个碳-碳键上。每个双键前都有一个顺式-或反式-前缀,指示分子绕键的构象。例如,亚油酸被命名为“顺式-Δ9,顺式-Δ12 十八碳二烯酸”。这种命名法具有比系统命名法更简洁的优势,但技术上并不比系统命名法更清晰或更具描述性。 |
| n−x 命名法 | n−3 | n−x(n 减 x;也称为ω−x 或omega-x)命名法既为单个化合物命名,又根据它们在动物体内可能的生物合成特性对其进行分类。双键位于从末端甲基碳(指定为n 或 ω)到羰基碳的第x个碳-碳键上。例如,α-亚麻酸被归类为n−3 或 omega-3 脂肪酸,因此它可能与该类型的其他化合物共享生物合成途径。ω−x、omega-x 或“omega”符号在流行的营养文献中很常见,但 IUPAC 已在技术文件中将其弃用,而采用n−x 符号。[1] 研究最多的脂肪酸生物合成途径是n−3 和n−6,它们被假设[by whom?] 会增加或减少[citation needed] 炎症。 |
| 脂类编号 | 18:3 18:3, n−6 18:3, 顺式,顺式,顺式-Δ9,Δ12,Δ15 |
脂类编号采用C:D 的形式,其中C 是脂肪酸中碳原子的数量,D 是脂肪酸中双键的数量。这种符号可能很模糊,因为一些不同的脂肪酸可能具有相同的数字。因此,当存在歧义时,这种符号通常与 Δx 或n−x 术语配对。[1] |
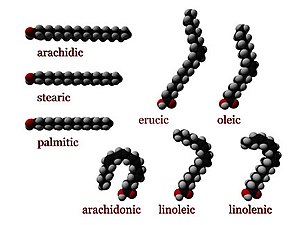
脂肪酸可以根据双键饱和或不饱和。它们在长度上也有所不同。
除了饱和度之外,脂肪酸还有不同的长度,通常分为短链、中链或长链。
- 短链脂肪酸 (SCFA) 是脂肪酸,其脂肪族尾部少于 6 个碳。
- 中链脂肪酸 (MCFA) 是脂肪酸,其脂肪族尾部为 6-12。[3] 个碳,可以形成中链甘油三酯。
- 长链脂肪酸 (LCFA) 是脂肪酸,其脂肪族尾部长于 12 个碳。[4]
- 超长链脂肪酸 (VLCFA) 是脂肪酸,其脂肪族尾部长于 22 个碳

不饱和脂肪酸类似于饱和脂肪酸,除了链中有一个或多个碳原子之间的双键。双键两侧相邻的两个碳原子可以处于顺式或反式构型。
- 顺式
- 顺式构型意味着相邻的氢原子位于双键的同一侧。双键的刚性使其构象固定,并且在顺式异构体的情况下,会导致链弯曲并限制脂肪酸的构象自由度。链中顺式构型的双键越多,它就越不灵活。当一条链在顺式构型中具有许多双键时,它在其最易接近的构象中变得相当弯曲。例如,具有一个双键的油酸具有一个“扭结”,而具有两个双键的亚油酸具有更明显的弯曲。具有三个双键的亚麻酸有利于钩状形状。这样做的结果是,在受限的环境中(例如,当脂肪酸是脂双层中磷脂的一部分,或脂滴中甘油三酯的一部分时),顺式键会限制脂肪酸紧密堆积的能力,因此会影响膜或脂肪的熔点。
- 反式
- 相反,反式构型意味着接下来的两个氢原子绑定到双键的相对侧。因此,它们不会导致链弯曲太多,并且它们的形状类似于直的饱和脂肪酸。
在大多数天然存在的非饱和脂肪酸中,每个双键之后都有三个n个碳原子,对于某个n,并且都是顺式键。大多数反式构型 (反式脂肪) 的脂肪酸在自然界中不存在,是人为加工 (例如氢化) 的结果。
各种类型的非饱和脂肪酸之间的几何差异,以及饱和脂肪酸和非饱和脂肪酸之间的几何差异,在生物过程和生物结构 (如细胞膜) 的构建中起着重要作用。
| 常用名称 | 化学结构 | Δx | C:D | n−x |
|---|---|---|---|---|
| 肉豆蔻油酸 | CH3(CH2)3CH=CH(CH2)7COOH | 顺式-Δ9 | 14:1 | n−5 |
| 棕榈油酸 | CH3(CH2)5CH=CH(CH2)7COOH | 顺式-Δ9 | 16:1 | n−7 |
| 二十碳四烯酸 | CH3(CH2)8CH=CH(CH2)4COOH | 顺式-Δ6 | 16:1 | n−10 |
| 油酸 | CH3(CH2)7CH=CH(CH2)7COOH | 顺式-Δ9 | 18:1 | n−9 |
| 亚油酸 | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | 顺式,顺式-Δ9,Δ12 | 18:2 | n−6 |
| α-亚麻酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | 顺式,顺式,顺式-Δ9,Δ12,Δ15 | 18:3 | n−3 |
| 花生四烯酸 | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOHNIST | 顺式,顺式,顺式,顺式-Δ5Δ8,Δ11,Δ14 | 20:4 | n−6 |
| 二十碳五烯酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | 顺式,顺式,顺式,顺式,顺式-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | n−3 |
| 芥酸 | CH3(CH2)7CH=CH(CH2)11COOH | 顺式-Δ13 | 22:1 | n−9 |
| 二十二碳六烯酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | 顺式,顺式,顺式,顺式,顺式,顺式-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | n−3 |
必需脂肪酸
[edit | edit source]人体必需但无法从其他底物中合成足够的量,因此必须从食物中获取的脂肪酸称为必需脂肪酸。哺乳动物缺乏在脂肪酸中引入碳9和10以外的双键的能力,因此ω-6亚油酸 (18:2,9,12),简称为LA,和ω-3亚麻酸 (18:3,9,12,15),简称为ALA,是人类饮食中必需的。在人类中,花生四烯酸 (20:4,5,8,11,14) 可以通过脱饱和和链延长从LA合成 (尽管一些肉食动物如猫无法做到这一点,并且需要饮食中的花生四烯酸)。此外,人体可以从ω-3 ALA合成一些长链ω-3 PUFA (EPA 和 DHA)。在1930年到1950年之间,花生四烯酸和亚麻酸被称为“必需”,因为它们或多或少都能满足给予无脂肪饮食的大鼠的生长需求。进一步的研究表明,人类代谢需要ω-3和ω-6脂肪酸。在一定程度上,任何ω-3和ω-6都能缓解其类别中脂肪酸缺乏症的最严重症状。某些特定的脂肪酸在关键的生命阶段 (例如哺乳期) 和某些疾病状态下仍然是必需的。在非科学写作中,常用用法是指必需脂肪酸包括所有ω-3或-6脂肪酸。共轭脂肪酸,如calendic酸,通常不被认为是必需的。权威来源包括所有家族,无条件。传统上来说,LC-PUFA不是必需的。参见 (Cunnane 2003) 关于“必需”一词的当前状态的讨论。由于LC-PUFA有时是必需的,因此它们可能被认为是“条件必需的”,或者对健康的成年人不是必需的。一项2005年的研究表明,ω-6脂肪酸γ-亚麻酸GLA已被证明可以抑制Her2/neu的乳腺癌促进基因。必需脂肪酸不应该与精油混淆,精油指的是浓缩精华[5]。
命名法和术语
[edit | edit source]脂肪酸是具有羧基 (COOH) 基团的直链烃。羧酸盐旁边的碳原子称为α,下一个碳原子称为β,依此类推。由于生物脂肪酸可能具有不同的长度,因此最后一个位置被标记为“ω”,是希腊字母表中的最后一个字母。由于非饱和脂肪酸的生理特性主要取决于第一个不饱和位置相对于末端位置,而不是相对于羧酸盐的位置,因此该位置由 (ω 减去 n) 表示。例如,ω-3 脂肪酸 (ω-3) 表示第一个双键存在于碳链的末端 CH3 (ω) 的第三个碳-碳键上。碳原子数和双键数也列出。ω-3 18:4 (硬脂油酸) 或 18:4 ω-3 或 18:4 n−3 表示一条具有 4 个双键的 18 个碳原子的链,并且第一个双键位于 CH3 末端处的第三个位置[citation needed]。双键为顺式,除非另有说明,否则它们之间由一个亚甲基 (CH2) 基团隔开。因此,在游离脂肪酸形式中,硬脂油酸的化学结构为[6]: 
例子
[edit | edit source]必需脂肪酸以短链多不饱和脂肪酸 (SC-PUFA)开始
- ω-3 脂肪酸
- α-亚麻酸或ALA (18:3)
- ω-6 脂肪酸
- 亚油酸或LA (18:2)
这两种脂肪酸不能被人体合成,因为人类缺乏产生它们的脱饱和酶。
它们构成更长和更不饱和脂肪酸的起点,这些脂肪酸也被称为长链多不饱和脂肪酸 (LC-PUFA)
- omega-3 脂肪酸 (ω-3 脂肪酸)
- 二十碳五烯酸或EPA (20:5)
- 二十二碳六烯酸或DHA (22:6)
- Omega-6 脂肪酸 (ω-6 脂肪酸)
- γ-亚麻酸或GLA (18:3)
- 二同型γ-亚麻酸或DGLA (20:3)
- 花生四烯酸或AA (20:4)
ω-9 脂肪酸对人体来说不是必需的,因为人类通常拥有合成它们的所需酶。
饱和脂肪酸
[edit | edit source]饱和脂肪酸是长链羧酸,通常具有 12 到 24 个碳原子,没有双键。因此,饱和脂肪酸被氢饱和 (因为双键会减少每个碳原子的氢原子数)。由于饱和脂肪酸只有单键,因此链内的每个碳原子都有 2 个氢原子 (除了末端的ω碳原子具有 3 个氢原子)。
| 常用名称 | 化学结构 | C:D |
|---|---|---|
| 月桂酸 | CH3(CH2)10COOH | 12:0 |
| 肉豆蔻酸 | CH3(CH2)12COOH | 14:0 |
| 棕榈酸 | CH3(CH2)14COOH | 16:0 |
| 硬脂酸 | CH3(CH2)16COOH | 18:0 |
| 花生酸 | CH3(CH2)18COOH | 20:0 |
| 山嵛酸 | CH3(CH2)20COOH | 22:0 |
| 木蜡酸 | CH3(CH2)22COOH | 24:0 |
| 蜂蜡酸 | CH3(CH2)24COOH | 26:0 |
脂肪酸合成
[edit | edit source]在人体中,脂肪酸主要在肝脏和泌乳乳腺中形成,在脂肪组织中形成的量较少。大多数乙酰辅酶A是由丙酮酸脱氢酶在线粒体中由丙酮酸形成的。在线粒体中产生的乙酰辅酶A通过柠檬酸合成酶与草酰乙酸缩合形成柠檬酸,柠檬酸然后被转运到胞质溶胶中,并通过ATP柠檬酸裂解酶分解产生乙酰辅酶A和草酰乙酸。胞质溶胶中的草酰乙酸通过胞质溶胶苹果酸脱氢酶还原为苹果酸,苹果酸被转运回线粒体以参与柠檬酸循环。
脂肪酸合酶 (FAS) 是一种多酶,在脂肪酸合成中起着关键作用。它不是单一酶,而是一个完整的酶系统,由 272 kDa 多功能多肽组成,其中底物从一个功能域传递到下一个功能域。
脂肪酸合酶主要分为两类。
I 型系统 使用单个大型多功能多肽,在哺乳动物和真菌中很常见(尽管真菌和哺乳动物合酶的结构排列不同)。在 CMN 类细菌(棒状杆菌、分枝杆菌和诺卡氏菌)中也发现了一种 I 型脂肪酸合酶系统。在这些细菌中,FAS I 系统产生棕榈酸,并与 FAS II 系统协同作用以产生更多种类的脂类产物。
II 型 存在于古细菌和真细菌中,其特征在于使用离散的单功能酶进行脂肪酸合成。该途径的抑制剂(FASII)正在被研究作为可能的抗生素。FAS I 和 FAS II 延长和还原的机制是相同的,因为 FAS II 酶的域与 FAS I 多酶多肽中的域对应物高度同源。然而,酶组织上的差异——FAS I 中整合,FAS II 中离散——导致了许多重要的生化差异。脂肪酸合酶的进化史与聚酮合酶 (PKS) 的进化史密切相关。聚酮合酶使用类似的机制和同源域来产生次生代谢脂类。此外,聚酮合酶也表现出 I 型和 II 型组织。动物体内的 FAS I 被认为是通过真菌体内 PKS I 的修饰产生的,而真菌和 CMN 类细菌体内的 FAS I 似乎是通过 FAS II 基因的融合而独立产生的[7]。
哺乳动物 FAS 由两个相同的多功能多肽组成,其中 N 末端部分的三个催化域(-酮酰基合酶 (KS)、丙二酰/乙酰基转移酶 (MAT) 和脱水酶 (DH))通过 600 个残基的核心区域与四个 C 末端域(烯酰还原酶 (ER)、-酮酰基还原酶 (KR)、酰基载体蛋白 (ACP) 和硫酯酶 (TE))分开。[8][9]
FAS 组织的传统模型(参见右侧的“头尾”模型)主要基于以下观察结果:双功能试剂 1,3-二溴丙酮 (DBP) 能够交联一个 FAS 单体中 KS 域的活性位点半胱氨酸硫醇与另一个单体中 ACP 域的磷酸泛酰巯基乙胺前体。[10][11] 携带不同突变的 FAS 二体的互补分析表明,KS 和 MAT 域可以与任一单体的 ACP 协同作用。[12][13] 以及对 DBP 交联实验的重新研究表明,KS 活性位点 Cys161 硫醇可以与任一单体的 ACP 4'-磷酸泛酰巯基乙胺硫醇交联。[14] 此外,最近报道称,只包含一个有能力单体的异二聚体 FAS 能够合成棕榈酸酯。[15]
上述观察结果似乎与 FAS 组织的经典“头尾”模型不一致,因此提出了一种替代模型,预测两个单体的 KS 和 MAT 域更靠近 FAS 二聚体的中心,在那里它们可以访问任一亚基的 ACP(参见右上角的图形)。[16]
最近,猪(同型二聚体)[17]和酵母 FAS(异十二聚体)[18]的低分辨率 X 射线晶体学结构的阐明,为这种重要酶提供了关键的结构和机制见解。
脂肪酰基
脂肪酰基,一个用于描述脂肪酸、它们的缀合物和衍生物的通用术语,是一组多种多样的分子,它们通过在称为脂肪酸合成的过程中使用乙酰辅酶 A 引物与丙二酰辅酶 A 或甲基丙二酰辅酶 A 基团链延长而合成。它们由一个以羧酸基团结束的烃链组成;这种排列赋予分子极性亲水端和非极性疏水端,该端不溶于水。脂肪酸结构是生物脂类中最基本的类别之一,通常用作结构更复杂的脂类的组成部分。碳链通常长 4 到 24 个碳原子,可以是饱和的或不饱和的,并且可以连接到包含氧、卤素、氮和硫的功能基团。在存在双键的情况下,可能存在顺式或反式几何异构体,这会显着影响分子的分子构型。顺式双键会导致脂肪酸链弯曲,这种效应随着链中双键数量的增加而更加明显。这反过来又在细胞膜的结构和功能中起着重要作用。大多数天然存在的脂肪酸是顺式构型,尽管反式形式确实存在于一些天然和部分氢化的脂肪和油中。生物学上重要的脂肪酸的例子是类二十烷酸,主要源自花生四烯酸和二十碳五烯酸,包括前列腺素、白三烯和血栓烷。脂肪酸类别的其他主要脂类类别是脂肪酯和脂肪酰胺。脂肪酯包括重要的生化中间体,如蜡酯、脂肪酸硫酯辅酶 A 衍生物、脂肪酸硫酯 ACP 衍生物和脂肪酸肉碱。脂肪酰胺包括 N-酰基乙醇胺,如大麻素神经递质花生四烯乙醇胺[19]。
甘油脂 甘油脂主要由单、二和三取代甘油组成,其中最著名的是甘油的脂肪酸酯(三酰基甘油),也称为甘油三酯。在这些化合物中,甘油的三个羟基分别被酯化,通常是不同的脂肪酸。由于它们充当食物储存,这些脂类构成了动物组织中大部分储存脂肪。三酰基甘油酯的酯键水解以及甘油和脂肪酸从脂肪组织中释放出来被称为脂肪动员。甘油脂的其他亚类由糖基甘油表示,其特征在于存在一个或多个糖残基通过糖苷键连接到甘油。此类别的结构示例包括植物膜中的二半乳糖基二酰基甘油和哺乳动物精子细胞中的半乳糖脂[20]。
甘油磷脂,也称为磷脂,在自然界中普遍存在,是细胞脂质双层的关键成分,同时也参与代谢和细胞信号传导。神经组织(包括大脑)含有相对大量的甘油磷脂,其组成的改变与各种神经系统疾病有关。甘油磷脂可以根据真核生物和真细菌中甘油骨架的 sn-3 位或古细菌中 sn-1 位的极性头部基团的性质进行细分[21]。
甘油磷脂是指任何含有至少一个 O-酰基、O-烷基或 O-烯丙基残基连接到甘油部分,以及由含氮碱基、甘油或肌醇单元组成的极性头部,衍生自 sn-甘油-3-磷酸的衍生物。它包含一个带有脂肪酸的甘油核心。这些脂肪酸亚基可以相同或不同。碳 1(尾部,非极性)包含一个脂肪酸,通常为饱和碳 2(尾部,非极性)包含一个脂肪酸,通常为不饱和且处于顺式构象,因此看起来“弯曲”碳 3(头部,极性)包含一个磷酸基团或连接到磷酸基团的醇
命名法和立体化学 一般来说,甘油磷脂使用“sn”符号,代表立体化学编号。当命名法中出现字母“sn”时,按照惯例,甘油第二个碳的羟基(sn-2)在费歇尔投影中位于左侧。编号遵循费歇尔投影的编号,sn-1 为顶部的碳,sn-3 为底部的碳。
这种特定符号的优点是可以直观地通过 sn-1 和 sn-3 位置上的残基来确定甘油分子的空间构象(R 或 L)。
例如,sn-甘油-3-磷酸和 sn-甘油-1-磷酸是对映异构体。
甘油磷脂的例子
| 名称 | 图像 | 头部 | 图像 | 电荷 |
| 磷脂酰胆碱(卵磷脂) |  |
胆碱 |  |
中性 |
| 磷脂酰乙醇胺(脑磷脂) | 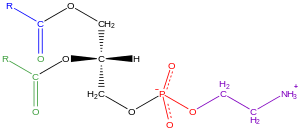 |
乙醇胺 | 中性 | |
| 磷脂酰肌醇 |  |
肌醇 | 负 | |
| 磷脂酰丝氨酸 |  |
丝氨酸 |  |
负 |
| 双磷脂酰甘油(心磷脂) |  |
- | - | 负 |
卵磷脂和脑磷脂在大多数人类膜中比其他甘油磷脂更常见,但心磷脂在线粒体的内膜中非常常见。
磷脂酰乙醇胺 在生物膜中发现的甘油磷脂的例子包括磷脂酰胆碱(也称为 PC、GPCho 或卵磷脂)、磷脂酰乙醇胺(PE 或 GPEtn)和磷脂酰丝氨酸(PS 或 GPSer)。除了作为细胞膜的主要成分和细胞内和细胞间蛋白质的结合位点之外,真核细胞中的一些甘油磷脂,如磷脂酰肌醇和磷脂酸,要么是膜衍生二线信使的前体,要么本身就是膜衍生二线信使。通常,这两个羟基中的一个或两个被长链脂肪酸酰化,但也存在烷基连接和 1Z-烯丙基连接(缩醛磷脂)甘油磷脂,以及古细菌中的二烷基醚变体。

黑色:鞘氨醇
红色:磷酸胆碱
蓝色:脂肪酸
鞘脂
[edit | edit source]鞘脂是一个复杂的化合物家族,它们共享一个共同的结构特征,即鞘氨醇碱骨架,它是从氨基酸丝氨酸和长链脂肪酰辅酶 A 从头合成,然后转化为神经酰胺、磷鞘脂、糖鞘脂和其他化合物。哺乳动物的主要鞘氨醇碱通常被称为鞘氨醇。神经酰胺(N-酰基鞘氨醇碱)是鞘氨醇碱衍生物的一个主要亚类,具有酰胺连接的脂肪酸。脂肪酸通常为饱和或单不饱和,链长为 16 到 26 个碳原子。哺乳动物的主要磷鞘脂是鞘磷脂(神经酰胺磷酸胆碱),而昆虫主要含有神经酰胺磷酸乙醇胺,真菌有植物神经酰胺磷酸肌醇和含甘露糖的头部基团。糖鞘脂是一个多样化的分子家族,由一个或多个糖残基组成,通过糖苷键连接到鞘氨醇碱。这些的例子包括简单的和复杂的糖鞘脂,如脑苷脂和神经节苷脂[22]。
鞘脂类型
- 神经酰胺是所有鞘脂共有的基本结构单元。它们仅由通过酰胺键连接到鞘氨醇的脂肪酸链组成。
鞘脂主要有三种类型,它们在头部基团上有所不同
- 鞘磷脂具有磷酸胆碱或磷酸乙醇胺分子,并通过酯键连接到神经酰胺的 1-羟基。
鞘磷脂(SPH,sfing-goh-mahy-uh-lin)是动物细胞膜中发现的一种鞘脂,特别是在包围某些神经细胞轴突的髓鞘膜中。它通常由磷酸胆碱和神经酰胺组成。在人类中,SPH 代表所有鞘脂的 ~85%。
- 糖鞘脂,它们在头部基团上的取代基不同(见图)。糖鞘脂是神经酰胺,在其 1-羟基位置具有一个或多个通过 β-糖苷键连接的糖残基[23]。
- 脑苷脂在 1-羟基位置具有单个葡萄糖或半乳糖。
- 硫脑苷脂是硫酸化脑苷脂。
- 脑苷脂在 1-羟基位置具有单个葡萄糖或半乳糖。
- 神经节苷脂至少有三种糖,其中一种必须是唾液酸。
鞘脂贮积症是一类与鞘脂代谢有关的疾病。
| 疾病 | 缺乏的酶 | 积累的产物 | 症状 | 遗传方式 |
|---|---|---|---|---|
| 尼曼-匹克病 | 鞘磷脂酶 | 脑和红细胞中的鞘磷脂 |
|
常染色体隐性遗传 |
| 法布里病 | α-半乳糖苷酶 A | 脑、心脏、肾脏中的糖脂 |
|
X 连锁[25] |
| 克莱布病 | 半乳糖脑苷脂酶 | 少突胶质细胞中的糖脂 |
|
常染色体隐性遗传 |
| 戈谢病 | 葡萄糖脑苷脂酶 | 红细胞、肝脏和脾脏中的葡萄糖脑苷脂 |
|
常染色体隐性遗传,在阿什肯纳兹犹太人中流行 |
| 泰-萨克斯病 | 己糖胺酶 A | 神经元中的 GM2 神经节苷脂 |
|
常染色体隐性遗传,在阿什肯纳兹犹太人中流行 |
| 亚急性硬化性脑白质营养不良 | 芳基硫酸酯酶 A 或前鞘氨醇 | 神经组织中的硫脑苷脂化合物 | 中枢神经系统和周围神经系统的脱髓鞘
|
常染色体隐性遗传[26] |
甾醇脂类 甾醇脂类,如胆固醇及其衍生物,是膜脂类的重要组成部分,与甘油磷脂和鞘磷脂一起。类固醇,所有这些都是从相同的融合四环核心结构衍生而来,具有不同的生物学作用,如激素和信号分子。十八碳 (C18) 类固醇包括雌激素家族,而 C19 类固醇包括雄激素,如睾酮和雄酮。C21 亚类包括孕激素以及糖皮质激素和盐皮质激素。维生素 D 的各种形式组成的甾醇类,其特征是核心结构的 B 环断裂。胆汁酸及其结合物是类固醇的另一个例子,在哺乳动物中,胆汁酸是胆固醇的氧化衍生物,在肝脏中合成。植物等价物是植物甾醇,如 β-谷甾醇、豆甾醇和油菜甾醇;后一种化合物也被用作藻类生长的生物标志物。真菌细胞膜中主要的甾醇是麦角甾醇[27]。
异戊二烯脂类 异戊二烯脂类由 5-碳前体异戊烯基焦磷酸和二甲基烯丙基焦磷酸合成,这些前体主要通过甲羟戊酸 (MVA) 途径产生。简单的异戊二烯类 (线性醇、二磷酸酯等) 是通过连续添加 C5 单元形成的,并根据这些萜类单元的数量进行分类。含有超过 40 个碳原子的结构被称为多萜类。类胡萝卜素是重要的简单异戊二烯类,它们充当抗氧化剂并作为维生素 A 的前体。醌类和氢醌类是另一个生物学上重要的分子类别,它们包含连接到非异戊二烯来源的醌核心的异戊二烯尾部。维生素 E 和维生素 K 以及泛醌都是这一类别的例子。原核生物合成多异戊二烯类 (称为细菌异戊二烯类),其中连接到氧的末端异戊二烯单元保持不饱和,而在动物多异戊二烯类 (多萜醇) 中,末端异戊二烯被还原[28]。
糖脂类
Kdo2-脂质 A 的结构。葡萄糖胺残基为蓝色,Kdo 残基为红色,酰基链为黑色,磷酸基团为绿色。糖脂类描述了脂肪酸直接连接到糖骨架的化合物,形成与膜双层相容的结构。在糖脂类中,单糖取代了甘油脂和甘油磷脂中存在的甘油骨架。最熟悉的糖脂类是革兰氏阴性细菌中脂质 A 成分的脂多糖的酰化葡萄糖胺前体。典型的脂质 A 分子是葡萄糖胺的二糖,它们被多达七个脂肪酰基链衍生化。大肠杆菌生长所需的最小脂多糖是 Kdo2-脂质 A,它是葡萄糖胺的六酰化二糖,被两个 3-脱氧-D-甘露糖-辛酮酸 (Kdo) 残基糖基化[29]。
聚酮类 聚酮类是由经典酶以及具有与脂肪酸合酶类似的机制特征的迭代和多模块酶,聚合乙酰基和丙酰基亚基合成。它们包含大量来自动物、植物、细菌、真菌和海洋来源的次生代谢产物和天然产物,并且具有很大的结构多样性。许多聚酮类是环状分子,其主链通常通过糖基化、甲基化、羟基化、氧化和/或其他过程进一步修饰。许多常用的抗微生物、抗寄生虫和抗癌药物是聚酮类或聚酮类衍生物,例如红霉素、四环素、阿维菌素和抗肿瘤依托泊苷[30]。
半乳糖脂类和硫脂类
[edit | edit source]半乳糖脂 是一种糖脂,其糖基为半乳糖。它们与鞘糖脂的不同之处在于它们的组成中不含氮。它们是植物膜脂的主要组成部分,在植物膜中取代磷脂,以节省磷酸盐用于其他必需的过程。这些叶绿体膜含有大量的单半乳糖基二酰基甘油(MGDG)和二半乳糖基二酰基甘油(DGDG)。它们可能也直接参与光合作用,因为它们在光合复合物的 X 射线结构中被发现。半乳糖脂脑苷脂(GalC)及其硫酸化衍生物硫脂也大量存在于髓鞘中,髓鞘是脊椎动物神经系统轴突周围的膜(以及一小部分蛋白质)。
硫脂 是一类脂类,其含有含硫官能团。硫脂中最常见的成分之一是硫代奎宁糖,它被酰化形成硫代奎宁糖基二酰基甘油。在植物中,硫脂是硫循环中的重要中间体。
什么是硫代奎宁糖?
硫代奎宁糖,也称为 6-硫代奎宁糖和 6-脱氧-6-硫代-D-吡喃葡萄糖,是一种单糖,作为硫脂硫代奎宁糖基二酰基甘油 (SQDG) 的结构单元存在。硫代奎宁糖是葡萄糖的磺酸衍生物,磺酸基团由酶 UDP-硫代奎宁糖合酶 (SQD1) 引入糖中。
脂蛋白是一种生化组合,包含蛋白质和脂类,脂类与蛋白质结合。许多酶、转运蛋白、结构蛋白、抗原、粘附素和毒素都是脂蛋白。例如,高密度 (HDL) 和低密度 (LDL) 脂蛋白可以使脂肪在血液中运输,线粒体和叶绿体的跨膜蛋白以及细菌脂蛋白。
脂蛋白可以按照以下方式分类,从较大、密度较低到较小、密度较高。脂蛋白较大且密度较低,如果它们的脂肪含量高于蛋白质含量。它们的分类基于电泳和超速离心。
乳糜微粒将甘油三酯(脂肪)从肠道运送到肝脏、骨骼肌和脂肪组织。
极低密度脂蛋白 (VLDL) 将(新合成的)三酰甘油从肝脏运送到脂肪组织。
中密度脂蛋白 (IDL) 介于 VLDL 和 LDL 之间。它们通常在血液中检测不到。
低密度脂蛋白 (LDL) 将胆固醇从肝脏运送到身体细胞。LDL 有时被称为“坏胆固醇”脂蛋白。
高密度脂蛋白 (HDL) 从身体组织中收集胆固醇,并将其带回肝脏。HDL 有时被称为“好胆固醇”脂蛋白。
也可以根据血清蛋白电泳中的蛋白质分类,将脂蛋白分类为“α”和“β”。这种术语有时用于描述脂类疾病,例如无β脂蛋白血症。
脂蛋白 (a)
脂蛋白 (a) – Lp(a),心脏病学诊断测试 < 14 mg/dL : 正常 14-19 mg/dL : ? > 19 mg/dL : 高风险
如何降低:有氧运动、烟酸、阿司匹林、古格尔脂。
蜡是有机化合物,其特征在于包含长的烷基链。天然蜡通常是脂肪酸和长链醇的酯。合成蜡是缺乏官能团的长链烃。
蜡的类型
植物和动物蜡 许多植物或动物会生物合成蜡。它们通常包含几种成分,包括蜡酯、蜡酸、蜡醇和烃。蜡酯通常源自各种羧酸和各种脂肪醇。组成不仅取决于物种,还取决于生物体的地理位置。由于它们是混合物,因此天然产生的蜡比纯成分更软,熔点更低。动物蜡 最著名的动物蜡是蜂蜡,但其他昆虫也会分泌蜡。蜂蜡的主要成分是棕榈酸蜂蜡酯,这种物质用于建造蜂巢。它的熔点为 62-65 °C。鲸蜡在抹香鲸的头部油中大量存在。它的主要成分之一是棕榈酸鲸蜡醇,是脂肪酸和脂肪醇的另一种酯。羊毛脂是一种从羊毛中获得的蜡,由甾醇的酯组成[31]。例如,蜂蜡 - 由蜜蜂产生
中国蜡 - 由蜡虫 Ceroplastes ceriferus 产生[检查拼写]
耳垢 - 存在于人耳中。
羊毛脂(羊毛蜡) - 来自羊的皮脂腺
虫蜡 - 来自漆虫 Kerria lacca
鲸蜡 - 来自抹香鲸的头部空腔和鲸脂
植物蜡 尤其是在温暖的气候中,植物会分泌蜡来控制蒸发和水分。[2] 从商业角度来看,最重要的蜡是巴西棕榈蜡,这是一种从巴西棕榈树中获得的硬蜡。它含有棕榈酸蜂蜡酯,有许多应用。其他更专业的植物蜡包括小烛树蜡、乌拉圭蜡、甘蔗蜡、金雀花蜡、荷荷巴油。植物表皮蜡是长链脂肪族烃的混合物,含有烷烃、脂肪酸、伯醇和仲醇、二醇、酮、醛。
石油衍生蜡
虽然大多数天然蜡都是酯,但石蜡是烃,是烷烃的混合物,通常是同系物系列的链长。这些材料占石油的很大一部分。它们通过真空蒸馏精制。石蜡是正构烷烃和异构烷烃、环烷烃以及烷基和环烷烃取代的芳香族化合物的饱和混合物。支化程度对性质有重要影响。每年生产数百万吨石蜡。它们被用于粘合剂、食品(如口香糖和奶酪包装)、化妆品以及涂层。
蒙坦蜡 蒙坦蜡是一种从煤和褐煤中提取的化石蜡。它非常硬,反映了饱和脂肪酸和醇的高浓度,而不是特征更软蜡的酯。虽然它们是深棕色且有气味,但可以被提纯和漂白,从而产生商业上可用的产品。
聚乙烯及其相关衍生物 某些蜡是通过在 400 °C 下裂解聚乙烯获得的。产物的化学式为 (CH2)nH2,其中 n 的范围大约为 50 到 100。截至 1995 年,约有 2 亿公斤/年被消耗[32]。
脂滴如何与脂蛋白类似
脂滴和血浆脂蛋白都有一些共同的结构特征。脂滴和血浆脂蛋白中都存在被极性脂单层包裹的中性脂核心。这两种脂类还有另一个共同点,即它们都装饰着特定的表面蛋白,这些蛋白通常由两亲性 α-螺旋组成。然而,脂滴(直径从 100 纳米到 100 微米不等)通常比脂蛋白(直径从不到 20 纳米到约 500 纳米不等)更大。虽然脂滴和脂蛋白都是通过与内质网中的中性脂合成相连而形成的,但它们在生理功能上不同:脂类主要储存在脂滴中,而脂蛋白则将脂类分布到全身。此外,一些细胞类型(如肠上皮细胞、肝细胞和卵黄囊内胚层细胞)表达了脂蛋白组装所需的蛋白质(如微粒体 TG 转移蛋白和载脂蛋白 B),而大多数细胞会产生脂滴。因此,脂蛋白可能是通过适应脂滴进行分泌而进化来的。细胞如何调节脂滴中的储存与脂蛋白上的分泌仍然未知。只有当分泌细胞超过组装和分泌脂蛋白的能力时,脂滴中的脂类才能储存在这些分泌细胞中。或者,当达到储存阈值时,分泌可能会被激活。也可能脂滴库中的 TG 可通过某些特定的脂滴蛋白导向脂蛋白的形成。人们认为,通过脂蛋白分泌 TG 包括它们的分解,不仅在脂滴中,而且在内质网中的重新合成中。
去除脂滴蛋白 由于它们的类似性,去除脂滴蛋白的机制与去除膜蛋白的机制非常相似。在脂质体中,内吞的膜蛋白或自噬泡会降解。蛋白酶体还可以降解内质网膜蛋白(称为内质网相关降解)。脂滴蛋白可能通过这两种机制被降解。在一些脂滴蛋白被泛素修饰以进行蛋白酶体降解之前,脂滴会被带到自噬体。此外,通过非偏倚筛选,蛋白酶体成分被确定为正常脂滴形态所需的成分。最近,人们发现脂滴和蛋白酶体降解是如何在分子水平上联系起来的。在脂滴蛋白中,泛素 E2 连接酶 (Ube2g2) 与古老的泛素蛋白 1 (Aup1) 结合,Aup1 位于脂滴上或内质网中。泛素 E3 连接酶 (spartin/SPG20) 定位于脂滴,其耗竭或过表达会导致脂滴积累。然后,从这些发现可以推断出脂滴相关蛋白被特定的机制降解,但其细节尚不清楚。一些内质网相关降解底物可能定位于脂滴,但至少内质网相关降解不需要脂滴。
- ↑ a b c Rigaudy, J. (1979). 有机化学命名法. Pergamon. ISBN 0080223699. OCLC 5008199.
{{cite book}}: 未知参数|coauthors=被忽略 (|author=建议) (帮助) - ↑ "脂类命名法。推荐,1976". 欧洲生物化学杂志. 79 (1): 11–21. 1977. doi:10.1111/j.1432-1033.1977.tb11778.x.
{{cite journal}}: 多个|work=和|journal=指定 (帮助) - ↑ Medscape:免费 CME、医疗新闻、全文期刊文章等
- ↑ Christopher Beermann1, J Jelinek1, T Reinecker2, A Hauenschild2, G Boehm1 和 H-U Klör2, "膳食中链脂肪酸和 n-3 长链多不饱和脂肪酸对健康志愿者脂肪代谢的短期影响"
- ↑ http://en.wikipedia.org/w/index.php?title=Essential_fatty_acid&oldid=422687249
- ↑ http://en.wikipedia.org/w/index.php?title=Essential_fatty_acid&oldid=422687249
- ↑ http://en.wikipedia.org/w/index.php?title=Fatty_acid_synthase&oldid=416140503
- ↑ Chirala SS, Jayakumar A, Gu ZW, Wakil SJ (2001). "人脂肪酸合酶:域间在催化活性合酶二聚体形成中的作用". 美国国家科学院院刊. 98 (6): 3104–8. doi:10.1073/pnas.051635998. PMC 30614. PMID 11248039.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护:多重名称:作者列表 (链接) - ↑ Smith S (1994). "动物脂肪酸合酶:一个基因,一个多肽,七种酶". FASEB J. 8 (15): 1248–59. PMID 8001737.
{{cite journal}}: 未知参数|month=被忽略 (帮助) - ↑ Stoops JK, Wakil SJ (1981). "动物脂肪酸合酶。两个亚基域组成β-酮酰合成酶位点的全新排列". 生物化学杂志. 256 (10): 5128–33. PMID 6112225.
{{cite journal}}: 未知参数|month=被忽略 (帮助) - ↑ Stoops JK, Wakil SJ (1982). "动物脂肪酸合酶。鉴定构成β-酮酰合成酶位点全新排列的残基及其在冷失活中的作用". 生物化学杂志. 257 (6): 3230–5. PMID 7061475.
{{cite journal}}: 未知参数|month=被忽略 (帮助) - ↑ Joshi AK, Rangan VS, Smith S (1998). "动物脂肪酸合酶同二聚体两个亚基的差异亲和标记允许分离由独立修饰的亚基组成的异二聚体". J. Biol. Chem. 273 (9): 4937–43. doi:10.1074/jbc.273.9.4937. PMID 9478938.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Rangan VS, Joshi AK, Smith S (2001). "通过体外突变互补绘制动物脂肪酸合酶的功能拓扑". Biochemistry. 40 (36): 10792–9. doi:10.1021/bi015535z. PMID 11535054.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Witkowski A, Joshi AK, Rangan VS, Falick AM, Witkowska HE, Smith S (1999). "动物脂肪酸合酶的磷酸泛酰巯基乙醇和活性位点半胱氨酸硫醇的二溴丙酮交联可以在亚基间和亚基内发生。对侧边平行、反平行亚基模型的重新评估". J. Biol. Chem. 274 (17): 11557–63. doi:10.1074/jbc.274.17.11557. PMID 10206962.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Joshi AK, Rangan VS, Witkowski A, Smith S (2003). "构建具有一个具有活性的亚基的活性动物脂肪酸合酶二聚体". Chem. Biol. 10 (2): 169–73. doi:10.1016/S1074-5521(03)00023-1. PMID 12618189.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Asturias FJ, Chadick JZ, Cheung IK, Stark H, Witkowski A, Joshi AK, Smith S (2005). "哺乳动物脂肪酸合酶的结构和分子组织". Nat. Struct. Mol. Biol. 12 (3): 225–32. doi:10.1038/nsmb899. PMID 15711565.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Maier T, Leibundgut M, Ban N (2008). "哺乳动物脂肪酸合酶的晶体结构". Science. 321 (5894): 1315–22. doi:10.1126/science.1161269. PMID 18772430.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ Lomakin IB, Xiong Y, Steitz TA (2007). "酵母脂肪酸合酶的晶体结构,一台具有八个协同工作的活性位点的细胞机器". Cell. 129 (2): 319–32. doi:10.1016/j.cell.2007.03.013. PMID 17448991.
{{cite journal}}: 未知参数|month=被忽略 (帮助)CS1 维护: 多个名称:作者列表 (链接) - ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Sphingolipid&oldid=422417411
- ↑ http://en.wikipedia.org/w/index.php?title=Sphingolipid&oldid=422417411
- ↑ 如果没有特别说明,参考资料为:Marks, Dawn B.; Swanson, Todd; Sandra I Kim; Marc Glucksman (2007). 生物化学与分子生物学. 费城: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-8624-X.
{{cite book}}: CS1 维护: 多个名称:作者列表 (链接) - ↑ Banikazemi M, Desnick RJ, Astrin KH (2009-07-08). "法布里病". eMedicine 儿科学:遗传与代谢疾病. Medscape. Retrieved 2010-12-31.
{{cite web}}: Cite has empty unknown parameter:|coauthors=(help)CS1 maint: multiple names: authors list (link) - ↑ Gieselmann V, Zlotogora J, Harris A, Wenger DA, Morris CP (1994). "亚急性硬化性脑白质营养不良的分子遗传学". Hum. Mutat. 4 (4): 233–42. doi:10.1002/humu.1380040402. PMID 7866401.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Wax&oldid=423902940
- ↑ http://en.wikipedia.org/w/index.php?title=Wax&oldid=423902940



