生物化学原理/核酸 III:核苷酸合成
嘌呤在生物体内以核苷酸(碱基连接到核糖 5-磷酸)的形式合成。一个关键的调节步骤是通过 PRPP 合成酶产生核糖-5-磷酸-α-D-核糖 1-焦磷酸 (PRPP),PRPP 合成酶被无机磷酸激活并被嘌呤核苷酸抑制。它不是嘌呤合成的决定性步骤,因为 PRPP 也用于嘧啶合成和补救途径。第一个决定性步骤是 PRPP、谷氨酰胺和水与 5'-磷酸核糖胺、谷氨酰胺和焦磷酸的反应 - 由焦磷酸酰胺转移酶催化,该酶被 PRPP 激活,并被 AMP、GMP 和 IMP 抑制。
腺嘌呤和鸟嘌呤都衍生自肌苷酸 (IMP),肌苷酸是在一个预先存在的核糖-磷酸上通过一个复杂的途径合成的,使用来自甘氨酸、谷氨酰胺和天冬氨酸的氨基酸的原子,以及从辅酶四氢叶酸转移的甲酸离子[1]。
- IMP 脱氢酶将 IMP 转化为 XMP
- GMP 合成酶将 XMP 转化为 GMP
在酶学中,GMP 合成酶(谷氨酰胺水解)(EC 6.3.5.2)是一种催化化学反应的酶
- ATP + 黄嘌呤 5'-磷酸 + L-谷氨酰胺 + H2O AMP + 焦磷酸 + GMP + L-谷氨酸
该酶的 4 种底物分别是 ATP、黄嘌呤 5'-磷酸、L-谷氨酰胺和 H2O,而其 4 种产物分别是 AMP、焦磷酸、GMP 和 L-谷氨酸。该酶属于连接酶家族,特别是那些形成碳-氮键的碳-氮连接酶,谷氨酰胺作为酰胺-N-供体。该酶类的系统名称是黄嘌呤-5'-磷酸:L-谷氨酰胺酰胺连接酶(AMP 形成)。其他常用的名称包括 GMP 合成酶(谷氨酰胺水解)、鸟苷酸合成酶(谷氨酰胺水解)、鸟苷单磷酸合成酶(谷氨酰胺水解)、黄嘌呤 5'-磷酸酰胺转移酶和鸟苷 5'-单磷酸合成酶。该酶参与嘌呤代谢和谷氨酸代谢。已知至少一种化合物,即 Psicofuranin 可以抑制这种酶[2][3]。
- GMP 还原酶将 GMP 转化回 IMP
- 腺苷琥珀酸合成酶将 IMP 转化为腺苷琥珀酸
- 腺苷琥珀酸裂解酶将腺苷琥珀酸转化为 AMP
- AMP 脱氨酶将 AMP 转化回 IMP
磷酸核糖焦磷酸(PRPP)是一种戊糖磷酸。
它是由核糖-5-磷酸二磷酸激酶从核糖 5-磷酸形成的。
它在几个反应中起着转移磷酸核糖基团的作用
| 酶 | 反应物 | 产物 |
|---|---|---|
| 腺嘌呤磷酸核糖转移酶 | 腺嘌呤 | AMP |
| 次黄嘌呤-鸟嘌呤磷酸核糖转移酶 | 鸟嘌呤 | GMP |
| 次黄嘌呤-鸟嘌呤磷酸核糖转移酶 | 次黄嘌呤 | IMP |
| 乳清酸磷酸核糖转移酶 | 乳清酸 | OMP |
| 尿嘧啶磷酸核糖转移酶 | 尿嘧啶 | UMP |
在从头生成嘌呤中,酰胺磷酸核糖转移酶作用于 PRPP 以产生磷酸核糖胺。六种酶参与 IMP 合成。其中三种是多功能的
GART(反应 2、3 和 5)
PAICS(反应 6 和 7)
ATIC(反应 9 和 10)
三功能嘌呤生物合成蛋白腺苷-3 是一种酶,在人类中由基因GART编码。这种蛋白质是一种三功能多肽。它具有磷酸核糖甘氨酰胺甲酰转移酶(EC 6.3.4.13)、磷酸核糖甘氨酰胺合成酶(EC 6.3.3.1)、磷酸核糖氨基咪唑合成酶(EC 2.1.2.2)活性,这是从头合成嘌呤所必需的。
磷酸核糖氨基咪唑羧化酶(或 AIR 羧化酶)是一种参与核苷酸合成的酶。它催化 5'-磷酸核糖-5-氨基咪唑(“AIR”)转化为 5-磷酸核糖-4-羧基-5-氨基咪唑(“CAIR”)。
双功能嘌呤生物合成蛋白 PURH 是一种蛋白质,在人类中由 ATIC 基因编码。ATIC 编码一种酶,该酶从氨基咪唑甲酰胺核苷酸生成肌苷单磷酸。它有两个功能:EC 2.1.2.3 - 5-氨基咪唑-4-甲酰胺核苷酸甲酰转移酶 EC 3.5.4.10 - IMP 环化酶
| 嘌呤环原子的生物合成来源 N1 来自 Asp 的胺基 C2 和 C8 来自甲酸 N3 和 N9 由 Gln 的酰胺基贡献 C4、C5 和 N7 衍生自 Gly C6 来自 HCO3- (CO2) |

肌苷酸合成很复杂,从 5-磷酸核糖-1-焦磷酸 (PRPP) 开始。在第一步中,谷氨酰胺提供的氨基连接到 PRPP 的碳 1 上。由此产生的分子是 5-磷酸核糖胺,它非常不稳定,在生理 pH 值下半衰期为 30 秒。5-磷酸核糖胺获得一个氨基酸(甘氨酸),成为甘氨酰胺核苷酸 (GAR)。然后,N10-甲酰四氢叶酸 (THF) 将一个甲酰基转移到甘氨酰胺核苷酸,形成甲酰甘氨酰胺核苷酸 (FGAR)[4]。
使用一个 ATP 分子,将氨添加到该化合物中,使其成为甲酰甘氨酰亚胺核苷酸。另一个 ATP 分子导致一个分子内反应,产生一个咪唑环(5-氨基咪唑核苷酸)。
该途径的下一步是通过使用 ATP 添加碳酸氢盐以形成羧基氨基咪唑核苷酸(它只发生在真菌和细菌中;高等真核生物只是添加 CO2 以形成核苷酸)。然后,咪唑的羧酸盐基团磷酸化并添加天冬氨酸。
正如我们刚刚看到的,一个六步过程将甘氨酸、甲酸、碳酸氢盐、谷氨酰胺和天冬氨酸连接起来,形成一个中间体,该中间体包含合成嘌呤环所需的大部分原子。该中间体去除延胡索酸,并从 THF 添加第二个甲酰基。该化合物经过循环,并在经过一种分子内反应后形成肌苷酸。肌苷酸是该合成途径中第一个具有完整嘌呤环的中间体。
参与 IMP 合成的酶在细胞中构成一个多酶复合物。有证据表明存在多功能酶,其中一些催化该途径中的非连续步骤[5]。
“嘌呤” (purum uricum) 这个名称是由德国化学家埃米尔·费歇尔在 1884 年命名的。他于 1899 年首次合成它[6]。反应序列的起始物质是尿酸 (8),它是在 1776 年由谢勒从肾结石中分离出来的[7]。尿酸 (8) 与 PCl5 反应生成 2,6,8-三氯嘌呤 (10),它与 HI 和 PH4I 反应生成 2,6-二碘嘌呤 (11)。然后使用锌粉将产物还原为嘌呤 (1)。
除了嘌呤代谢中嘌呤的体内合成外,嘌呤也可以人工合成。
当甲酰胺在 170 oC 的开放容器中加热 28 小时时,可以以良好的产率获得嘌呤 (1)[8]。
这个非凡的反应以及其他类似的反应在生命的起源背景下已被讨论[9]。
步骤:[8] 在 170-190 oC 的油浴中,将甲酰胺(45 克)在带冷凝器的敞口容器中加热 28 小时。通过真空蒸馏除去过量的甲酰胺(32.1 克)后,将残余物与甲醇回流。过滤甲醇溶剂,通过真空蒸馏从滤液中除去溶剂,得到几乎纯的嘌呤;产率 4.93 克(以消耗的甲酰胺计,产率为 71%)。从丙酮中重结晶得到无色晶体状嘌呤;熔点 218 oC。
Oro、Orgel 及其同事已表明,四分子 HCN 四聚形成二氨基马来腈(12),它可以转化为几乎所有天然存在的嘌呤。[10][11][12][13][14]
Traube 嘌呤合成(1900 年)是一种经典反应(以 Wilhelm Traube 命名),它是在胺取代的嘧啶和甲酸之间进行的。[15]
从头 合成嘧啶
[edit | edit source]与嘌呤不同,嘧啶在连接到 5-磷酸核糖基-1-焦磷酸(PRPP)之前先组装好。
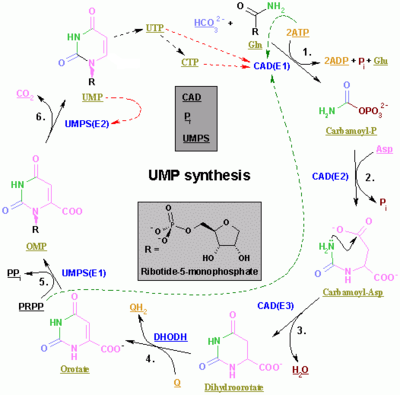
| 酶 | 产物 | 描述 |
| 氨基甲酰磷酸合成酶 II[16] | 氨基甲酰磷酸 | 这是嘧啶生物合成的调控步骤。 |
| 天冬氨酸转氨基甲酰酶(天冬氨酸氨基甲酰转移酶)[17] | 氨基甲酰天冬氨酸 | - |
| 二氢乳清酸酶[18] | 二氢乳清酸 | 脱水 |
| 二氢乳清酸脱氢酶[19](唯一的线粒体酶) | 乳清酸 | 二氢乳清酸进入线粒体,在那里通过去除氢原子而被氧化。这是核苷酸环生物合成中唯一的线粒体步骤。 |
| 乳清酸磷酸核糖基转移酶[20] | OMP | 使用 PRPP。 |
| OMP 脱羧酶[21] | UMP | 脱羧 |
| 尿苷-胞苷激酶 2[22] | UDP | 磷酸化。使用 ATP。 |
| 核苷二磷酸激酶 | 尿苷 5'-三磷酸(UTP) | 磷酸化。使用 ATP。 |
| CTP 合成酶 | 胞苷 5'三磷酸(CTP) | 使用谷氨酰胺和 ATP。 |
在后生动物中,前三种酶全部由同一个基因编码(CAD)。在真菌中,存在一种类似的蛋白质,但缺乏二氢乳清酸酶的功能:另一种蛋白质催化第二步。
在其他生物体(细菌、古细菌和其他真核生物]])中,前三步由三种不同的酶完成。
CTP 合成酶(或 CTP 合成酶)是一种参与嘧啶生物合成的酶。它可以相互转化 UTP 和 CTP。CTP 中胺/氨基的来源是谷氨酰胺。CTP 合成酶被 GTP(一种嘌呤)激活。这有助于平衡嘌呤和嘧啶核苷酸的相对含量。CTP 合成酶被 CTP 可逆抑制,例如被谷氨酰胺类似物 DON 不可逆抑制。以下人类基因编码具有 CTP 合成酶活性的蛋白质
CTPS - CTP 合成酶 1
CTPS2 - CTP 合成酶 2 嘧啶合成抑制剂用于治疗活动性中度至重度类风湿性关节炎和银屑病关节炎。例如,来氟米特和特立氟米特。
化学合成
[edit | edit source]嘧啶也可以通过有机合成在实验室中制备。一种方法是经典的 Biginelli 反应。许多其他方法依赖于羰基与胺的缩合,例如从硫脲和乙酰乙酸乙酯合成 2-硫-6-甲基尿嘧啶 [23] 或从 4,4-二甲氧基-2-丁酮和甲酰胺合成 4-甲基嘧啶。[24][25]
一种新方法是,在用 2-氯吡啶和三氟甲磺酸酐对酰胺进行亲电活化的情况下,使某些酰胺与碳腈反应 [26]
补救途径
[edit | edit source]补救途径是通过代谢途径|从核苷酸降解途径中的中间体合成核苷酸(嘌呤和嘧啶)的途径。
补救途径用于回收 RNA 和 DNA 降解过程中形成的碱基和核苷。这在某些器官中很重要,因为一些组织无法进行从头合成。
然后,回收的碱基和核苷可以被转化回核苷酸[27]。
底物
[edit | edit source]补救途径需要不同的底物
嘧啶
[edit | edit source]尿嘧啶磷酸化酶将核糖-1-磷酸添加到游离碱基尿嘧啶上,形成尿苷单磷酸。然后,尿苷激酶将该核苷磷酸化为其二磷酸和三磷酸形式。脱氧胸腺嘧啶磷酸化酶将脱氧核糖-1-磷酸添加到胸腺嘧啶上,形成脱氧胸腺嘧啶单磷酸。然后,胸腺嘧啶激酶可以将该化合物磷酸化为脱氧胸腺嘧啶二磷酸和三磷酸。
胸腺嘧啶激酶高级生物有两个化学性质完全不同的同工酶,TK1 和 TK2。前者最初是在胎儿组织中发现的,后者被发现更丰富地存在于成人组织中,最初它们被称为胎儿和成人胸腺嘧啶激酶。很快,就发现 TK1 仅在细胞分裂(细胞周期依赖性)之前才存在于细胞质中,而 TK2 位于线粒体中,并且与细胞周期无关。这两种类型的基因是在 1970 年代中期定位的。对 TK1 基因进行了克隆和测序。相应的蛋白质的分子量约为 25 kD。通常,它在组织中以二聚体的形式存在。它可以被 ATP 激活。激活后,它已转化为四聚体。重组 TK1 无法以这种方式激活并转化为四聚体,表明细胞中存在的酶在合成后已被修饰。TK1 在细胞分裂的 S 期由细胞合成。细胞分裂完成后,TK1 在细胞内被降解,因此它不会在正常细胞分裂后进入体液。细胞中胸腺嘧啶激酶的作用存在反馈调节:胸腺嘧啶三磷酸(TTP)是胸腺嘧啶进一步磷酸化的产物,它充当胸腺嘧啶激酶的抑制剂。这有助于维持用于核酸合成的平衡的 TTP 磷酸量,不会使系统过饱和。在单纯疱疹病毒、水痘带状疱疹病毒和EB病毒中已经鉴定出病毒特异性胸腺嘧啶激酶的基因[28][29]。
脱氧胸腺嘧啶与 ATP 反应生成脱氧胸腺嘧啶单磷酸和 ADP。
嘌呤
[edit | edit source]磷酸核糖基转移酶将活化的核糖-5-磷酸(称为磷酸核糖基焦磷酸或 PRPP)添加到碱基上,形成核苷酸单磷酸。磷酸核糖基转移酶有两种类型:腺嘌呤磷酸核糖基转移酶(APRT)和次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(HGPRT)。莱什-尼汉综合征与 HGPRT 缺乏有关。
| 核苷 | 酶 | 核苷酸 |
| 次黄嘌呤 | 次黄嘌呤/鸟嘌呤磷酸核糖基转移酶(HGPRT) | IMP |
| 鸟嘌呤 | 次黄嘌呤/鸟嘌呤磷酸核糖基转移酶(HGPRT) | GMP |
| 腺嘌呤 | 腺嘌呤磷酸核糖基转移酶(APRT) | AMP |
参考文献
[edit | edit source]- ↑ http://en.wikipedia.org/w/index.php?title=Purine_metabolism&oldid=423783946
- ↑ http://en.wikipedia.org/w/index.php?title=GMP_synthase&oldid=420670515
- ↑ Tesmer JJ, Klem TJ, Deras ML, Davisson VJ, Smith JL (January 1996). "The crystal structure of GMP synthetase reveals a novel catalytic triad and is a structural paradigm for two enzyme families". Nat. Struct. Biol. 3 (1): 74–86.
- ↑ http://en.wikipedia.org/w/index.php?title=Inosinic_acid&oldid=423592099
- ↑ http://en.wikipedia.org/w/index.php?title=Inosinic_acid&oldid=423592099
- ↑ Fischer, E. Berichte der Deutschen Chemischen Gesellschaft 1899, 32, 2550.
- ↑ Scheele, V. Q. Examen Chemicum Calculi Urinari, Opuscula, 1776, 2, 73.
- ↑ a b Yamada, H.; Okamoto, T. (1972). "从甲酰胺一步合成嘌呤环". 化学与药物公报. 20: 623.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Saladino; Crestini, Claudia; Ciciriello, Fabiana; Costanzo, Giovanna; Mauro, Ernesto; et al. (2006). "关于甲酰胺为基础的信息聚合物起源:核碱基的合成和早期聚合物的有利热力学位点". 生命起源与生物圈演化. 36 (5–6): 523–531. doi:10.1007/s11084-006-9053-2. PMID 17136429.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ↑ Sanchez, R. A.; Ferris, J. P.; Orgel, L. E. 分子生物学杂志, 1967, 30, 223.
- ↑ Ferris, J. P.; Orgel, L. E. 美国化学学会杂志, 1966, 88, 1074.
- ↑ Ferris, J. P.; Kuder, J. E.; Catalano, O. W. 科学, 1969, 166, 765.
- ↑ Oro, J.; Kamat, J. S. 自然, 1961, 190, 442.
- ↑ Houben-Weyl, Vol . E5, p. 1547
- ↑ 基于名称反应的有机合成, Alfred Hassner, C. Stumer ISBN 008043259X 2002
- ↑ "Entrez Gene:CAD 氨基甲酰磷酸合成酶 2、天冬氨酸转氨甲酰酶和二氢乳清酸酶".
- ↑ "Entrez Gene:CAD 氨基甲酰磷酸合成酶 2、天冬氨酸转氨甲酰酶和二氢乳清酸酶".
- ↑ "Entrez Gene:CAD 氨基甲酰磷酸合成酶 2、天冬氨酸转氨甲酰酶和二氢乳清酸酶".
- ↑ "Entrez Gene:DHODH 二氢乳清酸脱氢酶".
- ↑ "Entrez Gene:UMPS 尿苷单磷酸合成酶".
- ↑ "Entrez Gene:UMPS 尿苷单磷酸合成酶".
- ↑ "Entrez Gene:UCK2 尿苷-胞嘧啶激酶 2".
- ↑ 有机合成,Coll. Vol. 4, p.638 (1963); Vol. 35, p.80 (1955) 链接
- ↑ 有机合成,Coll. Vol. 5, p.794 (1973); Vol. 43, p.77 (1963) 链接
- ↑ http://en.wikipedia.org/w/index.php?title=Pyrimidine_metabolism&oldid=391209862
- ↑ 嘧啶衍生物的一步合成 Mohammad Movassaghi 和 Matthew D. Hill J. Am. Chem. Soc.; 2006; 128(44) pp 14254 - 14255; (通讯)
- ↑ http://en.wikipedia.org/w/index.php?title=Nucleotide_salvage&oldid=414293528
- ↑ http://en.wikipedia.org/w/index.php?title=Thymidine_kinase&oldid=422438046
- ↑ Wintersberger E (1997 年 2 月). "胸腺嘧啶激酶的调节和生物学功能". 生化学会学报. 25 (1): 303–8.








