蛋白质组学/翻译后修饰/糖基化
本节
蛋白质糖基化是指在翻译后将糖类选择性地添加到特定蛋白质残基的过程,该过程利用两种不同的机制来为天然蛋白质结构赋予更多结构稳定性或功能。具体而言,此过程对于蛋白质的正确修饰是必要的,从而使其能够正确锚定到磷脂双层中,或因酶介导的糖类在位点的添加而获得细胞信号功能。然而,由于缺乏酶识别或共有序列知识,这些机制在肽序列上发生的特定性很大程度上未知。因此,已经做了大量的研究工作来定义糖基化位点的预测模型,以帮助整体蛋白质建模。一个具体的例子是 pNetOGlyc 3.1 服务器,由生物序列分析中心开发。此工具使用神经网络从 PDB 中的实验验证的糖基化位点和结构同源性来推断 O-GalNAc 型糖基化位点。[1]

蛋白质被糖基化的原因有很多。一些糖蛋白在连接上多糖后更稳定,另一些则用于细胞识别和交流。还有一些蛋白质在没有伴随的侧链的情况下根本无法正确折叠。由于糖基化被认为主要是在高尔基体中进行的,因此在体内研究糖基化在蛋白质构象中的作用的实验设计起来很困难。
糖基化在维持蛋白质三级和四级结构方面起着至关重要的作用,最显着的是作为免疫球蛋白Fab 片段复杂结构的保持者。具体而言,免疫球蛋白 G 利用多达三十种独特的糖蛋白相互作用,以在血清糖蛋白的整个生命周期中创建和维持独特的 Fab 结构[2]。其他功能包括膜结合识别和粘附活性、代谢成分、运输职责以及蛋白质折叠/介导功能。总的来说,在需要多样化蛋白质且必须保持结构稳定性的细胞过程中,通常会涉及糖蛋白。
所有形式的糖基化都是利用活化核苷酸糖的酶促位点特异性反应。除了这三个基本要求之外,还存在几种特定的糖基化类型。

N-连接糖基化是最常见的糖基化形式。真核生物和古细菌广泛采用这种方式,但原核生物很少采用。这通过一系列步骤发生,这些步骤从形成一个由约 14 个糖组成的寡糖链开始。然后将该链锚定在一个称为多萜醇的多聚体上。然后,一种称为寡糖基转移酶的酶将结合的糖苷链转移到 ER 腔中,在那里它可以附着到正在产生的新生多肽上。
糖基化是由一个称为糖基化序列的短氨基酸序列触发的。该序列的特点是(在 N 情况下)一个天冬酰胺,然后是除脯氨酸以外的任何残基,然后是半胱氨酸、丝氨酸或苏氨酸。

大多数 N-连接寡糖属于两类,据认为这两类是由转录过程中存在糖修饰蛋白决定的。
复杂寡糖是通过从两个 N-乙酰葡糖胺分子开始将多种其他类型的糖连接在一起形成的。这通常以在链的特征性分支“触角”上添加唾液酸而终止。
真核细胞分泌或膜蛋白上的一组寡糖。它们含有 5-9 个甘露糖残基,但缺乏所谓复杂类型的唾液酸终止天线。
[O-连接糖基化]
[edit | edit source]O-连接糖基化通过将糖添加到苏氨酸和丝氨酸残基的羟基氧侧链来实现,这些侧链与脯氨酸残基非常接近。O-连接糖基化通常发生在高尔基体中。与蛋白质糖基化的N-连接变体的主要区别在于侧链相互作用的多样性,其中O型利用基于氧的连接机制。
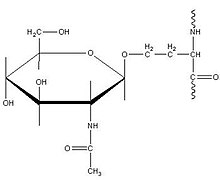
O-N-乙酰半乳糖胺 (O-GalNAc)
[edit | edit source]这种特定类型的O-连接糖基化理论上发生在高尔基体中,简单地表征为在后期加工中通过添加N-乙酰半乳糖胺基转移酶到丝氨酸或苏氨酸(通常是苏氨酸)残基来进一步修饰蛋白质。该机制由 UDP-N-乙酰-D-半乳糖胺:多肽N-乙酰半乳糖胺基转移酶催化,并由各种碳水化合物稳定以形成完整的O-GalNAc 结构。这种形式的糖基化对于形成蛋白聚糖至关重要,蛋白聚糖与细胞外基质形成和粘膜分泌物成分有关。
O-N-乙酰葡萄糖胺 (O-GlcNAc)
[edit | edit source]O-N-乙酰葡萄糖胺型糖基化发生在O-GlcNAc 添加到丝氨酸或苏氨酸残基上的情况下,当且仅当丝氨酸或苏氨酸激酶先前未在这些残基上发生磷酸化。通过O-GlcNAc 转移酶的机制,以这种方式糖基化的蛋白质存在于细胞核和细胞质中。由于它与磷酸化位点相关,这种糖基化事件的识别在当前和正在进行的癌症研究中具有重要意义,迄今为止,癌症研究仅集中于磷酸化活性。此外,O-GlCNAc 糖基化是信号转导通路终止处的营养感应六糖胺信号通路参与者。
O-甘露糖
[edit | edit source]这种形式的糖基化在脑和肌肉细胞中含量丰富,由O-甘露糖 β-1,2-N-乙酰葡萄糖胺基转移酶催化,该酶对甘露糖具有特异性,在先天性肌营养不良症 (CMD) 中具有重要意义,导致一种特定的疾病,特别是杜氏肌营养不良症。
O-岩藻糖 & O-葡萄糖
[edit | edit source]这些形式的糖基化发生在 Notch 蛋白(一种 EGF 信号蛋白)中的半胱氨酸残基之间。特别是人类 Notch-1(Notch 家族中的四种蛋白质之一)包含 12 个O-岩藻糖和 17 个O-葡萄糖位点,不当糖基化会导致异常发育、白血病和脑动脉硬化伴梗塞。对于O-果糖糖基化,这里的连接机制涉及 GDP-岩藻糖蛋白O-岩藻糖基转移酶 1。O-岩藻糖糖基化的另一种机制涉及 GDP-岩藻糖蛋白O-岩藻糖基转移酶 2 与特定血小板反应蛋白重复序列的融合,然后通过添加葡萄糖选择性地延长。有趣的是,这两个催化反应都发生在内质网中,而不是糖基转移酶在高尔基体中的传统定位。
C-甘露糖基化
[edit | edit source]C-甘露糖基化是一种独特的糖基化形式,其特征是 α-甘露吡喃糖与色氨酸的吲哚第二碳的共价结合。由于其惊人的特异性,这种糖基化形式直到 1990 年代初期才被表征,因此在细胞过程中的功能方面,它仍然是一种知之甚少的机制。

GPI 锚定
[edit | edit source]
这些膜结合蛋白在大多数真核系统中都很普遍,它们的作用是调节细胞表面分子的释放和膜分子的交换。具体来说,它们在酶和抗原分子的识别以及受体介导的信号转导通路中起着至关重要的作用。注定要锚定在膜表面的蛋白质首先在其羧基末端(C 端区域)附着到磷酸二酯连接系统。这包括磷酸乙醇胺吸附到三甘露糖基-非乙酰化葡萄糖胺的核心上。然后将这种葡萄糖胺结构连接到磷脂酰肌醇,磷脂酰肌醇最终通过另一个磷酸二酯连接体附着到脂质双层。膜结合蛋白质的溶解是通过磷脂酶 C 裂解磷脂酰肌醇键来实现的。
另见
[edit | edit source]参考文献
[edit | edit source]蛋白质 C-甘露糖基化:事实和问题 A. Furmanek & J Hofsteenge,波兰生物化学学报 200 47(3): 781-789
哺乳动物粘蛋白型 O-糖基化位点的预测、保守性分析和结构表征 K. Julenius 等人,糖生物学 2005 15(2):153-164 [1]
蛋白质酶促转化为糖蛋白,D.D. Pless,W.J. Lennarz,美国国家科学院院刊 74, 134-138 [2]
蛋白质糖基化:泰坦的冲突,B. Imperiali,化学研究帐目 30, 452-459
插入去垢剂胶束中的保守蛋白质 GPI 锚定核心的结构和动力学。F. Chevalier,糖生物学 16; 10, 969-980 [3]
糖基-磷脂酰肌醇锚定的膜蛋白,D. Brown,美国肾脏病学会杂志 3, 895-906 [4]
使用四极杆飞行时间质谱法鉴定血清反应因子 O-N-乙酰葡萄糖胺修饰的新位点,Chalkley,R.J,分子与细胞蛋白质组学,2, 182-190 [5]
克氏锥虫中 O-N-乙酰葡萄糖胺连接的聚糖的生物合成,Previato,J.O,生物化学杂志,273;24,14982-14988 [6]
Crit Rev Biochem Mol Biol.1998 ; 33 (3):151-208 9673446 (P,S,E,B)
O-连接糖基化的概念和原理。 P Van den Steen 等人。 比利时鲁汶大学雷加研究所。
作者
[edit | edit source]Jared Carter
Aubrey Bailey
- ↑ 哺乳动物粘蛋白型O-糖基化位点的预测、保守性分析和结构表征 K. Julenius等,糖生物学2005 15(2):153-164
- ↑ 可用地址 : <http://www.cryst.bbk.ac.uk/pps97/assignments/projects/emilia/Other_functions.HTM>
审稿人:Corey W.
翻译后修饰 (PTM) 影响许多蛋白质序列的发现导致蛋白质组学关注点从序列转向蛋白质的结构和功能特性。当蛋白质发生糖基化时,意味着糖被添加到氨基酸链中,这会影响蛋白质的结构、溶解度和稳定性。这些修饰在“胚胎发育、免疫反应以及涉及糖-糖或糖-蛋白质特异性识别的细胞间相互作用”中也发挥作用。糖基化是一种越来越受关注的PTM,因为它可以被用作生物标志物,这在检测前列腺癌和乳腺癌以及一些神经退行性疾病方面变得十分有用。本文重点关注比较糖蛋白质组学及其应用。
- 生物标志物
- 生物标志物,或生物标记,一般是指用作生物状态指示物的物质。(来源:http://en.wikipedia.org/wiki/Biomarker)
- 凝集素
- 凝集素是糖结合蛋白,对糖基团具有高度特异性。(来源:http://en.wikipedia.org/wiki/Lectin)
- MALDI MS
- 基质辅助激光解吸电离 (MALDI) 是一种用于质谱的软电离技术,允许分析生物分子(如蛋白质、肽和糖)以及大型有机分子(如聚合物、树状大分子和其他大分子),这些分子在用更传统的电离方法电离时往往很脆弱且会发生断裂。(来源:http://en.wikipedia.org/wiki/Matrix-assisted_laser_desorption/ionization)
- TOF MS
- 飞行时间质谱是一种质谱方法,其中离子被已知强度的电场加速。这种加速会导致离子具有与任何其他具有相同电荷的离子相同的动能。离子的速度取决于质荷比。随后粒子到达已知距离处的检测器所需的时间被测量。这个时间将取决于粒子的质荷比(较重的粒子达到较低的速度)。根据这个时间和已知的实验参数,可以找到离子的质荷比。(来源:http://en.wikipedia.org/wiki/Time-of-flight_mass_spectrometry)
- 在处理蛋白质时,在分离过程中存在动态范围问题。最有趣的蛋白质往往是那些浓度低的蛋白质。糖蛋白是总细胞蛋白的一个子集,可以通过使用凝集素选择性地富集。这些蛋白存在于植物、真菌、细菌和动物中,对碳水化合物具有独特的亲和力。凝集素亲和层析 (LAC) 基于每种凝集素对不同寡糖的可逆、特异性相互作用。这种方法可以富集糖蛋白和糖肽,还可以区分聚糖结构以及同一蛋白质的糖型。使用固定在琼脂糖固体块上的凝集素,可以在柱中分离糖蛋白。然后使用肽-N-糖苷酶 (PNGase) 用18O标记 N-糖基化位点。这种方法被称为同位素编码糖基化位点特异性标记 (IGOT)。质谱仪可以清楚地区分标记的肽和未标记的肽。这种方案的主要缺点是,可能发生对非糖基化蛋白质的一些非特异性结合。
- 这些蛋白上发现的功能基团可能会揭示更多关于信号通路的信息,并可能告诉我们更多关于某些疾病的机制和发病机理。分离技术的应用也将扩展动态范围,使我们能够靶向蛋白质的小子集,这将简化系统,并允许发现更多异常糖基化的位点。
- 已知糖基化谱在肿瘤发生的发生时会发生变化。作者提供了一个例子,其中 N-乙酰氨基葡萄糖基转移酶 V(负责 N-连接聚糖的分支)活性的上调与几种癌症的肿瘤侵袭和转移有关。从这种关于癌细胞中差异糖基化的知识,我们可以将一些糖蛋白作为生物标志物发现和诊断的靶点。在更著名的生物标志物(如前列腺特异性抗原 (PSA))的情况下,我们最终可能能够改变异常位点以用于免疫治疗。
- 已经表明,异常糖基化可能是阿尔茨海默病病因的一部分。特定蛋白质折叠的变化使位点更容易发生磷酸化,但更难发生去磷酸化。还发现,Reelin(一种用于细胞结构组织的蛋白质)中的糖模式会发生变化,导致上调!
获得前面提到的结果曾经很困难,但随着结构糖生物学与质谱技术的进步,实验变得更容易进行。这些新技术允许更详细地观察糖基化修饰。随着更多生物标志物的发现,人们希望这些类型的分析将成为正常诊断程序的一部分。将这些新型蛋白质组学付诸实践将阐明基本的生物过程。这些技术还有可能通过帮助我们发现这些罕见的蛋白质子集来解释某些疾病。
比较糖蛋白质组学方法和应用,X. Wei,L. Li,功能基因组学和蛋白质组学简报第 8 卷第 2 期,104-113 [7]


