感觉系统/疼痛生理学
疼痛被国际疼痛研究学会 (IASP) 定义为“与实际或潜在的组织损伤相关的令人不快的感觉和情绪体验,或用这种损伤来描述”。此外,疼痛也是一种复杂的感觉通路,对生存至关重要。神经系统中检测可能导致组织损伤的刺激的机制对于触发保护组织免受当前或进一步损伤的行为过程是必不可少的。这些刺激包括强烈的机械力、极端的温度和暴露于化学物质或缺氧。
一般来说,疼痛可以分为两类:急性疼痛或慢性疼痛。
急性疼痛的典型特征是突然发作,持续时间少于六个月。它的潜在病理学通常很容易确定,因为急性疼痛是局部的,并通过与其相关的组织损伤来定义。此外,急性疼痛通常随着组织愈合而消退。
相反,慢性疼痛超过了正常的恢复时间,并在正常的愈合过程发生后持续存在。它可能表明或可能不表明持续的组织损伤,并且通常与神经或心理反应功能障碍的激活相关。许多患有慢性疼痛的患者有长期的治疗失败史(即药物尝试无效)并表现出常见的副作用,如抑郁、愤怒、沮丧、活动水平下降或睡眠减少。
但是疼痛也可以根据引起疼痛的损伤类型进行分类。然后,两大类是:由组织损伤引起的伤害性疼痛和神经性疼痛,神经性疼痛是由于神经损伤引起的。表 1 列出了典型子类别以及特征和机制。一个广为讨论的第三类是精神性疼痛,它通常源于组织或神经损伤,但由该损伤引起的疼痛由于心理因素(如恐惧、抑郁、压力或焦虑)而加重或延长。疼痛仅源于心理状况的情况很少见。
| 疼痛类型 | 特点 | 机制 |
|---|---|---|
| 伤害性疼痛 - 体性疼痛(组织损伤) - 内脏性疼痛 - 炎症性疼痛(肌肉骨骼) |
持续性或痉挛性疼痛,定位不良 |
内脏扩张 与局部炎症相关 |
| 神经性疼痛 - 功能性疼痛(FM,丘脑综合征,...) |
CNS 中兴奋性或抑制性机制的失调 |

(基于 ScoreUSMLE (2015)[2])
要理解疼痛的生理学,最简单的方法是遵循从感觉受体到大脑的伤害感受信号通路。需要特别注意中枢神经系统 (CNS) 中不同步骤中伤害感受信号的整合和调节。疼痛是指感觉的感知,而伤害感受(拉丁语 nocere,“伤害”)是指触发的感官过程。强烈的机械力或极端温度等有害刺激由称为伤害感受器的神经元检测到,这些神经元将这些刺激转化为电信号。然后,这些信号通过初级传入神经纤维传导到脊髓背角。在那里,初级神经元与次级神经元建立突触接触,次级神经元立即在脊髓中交叉,然后形成脊髓丘脑束和脊髓网状束。通过这些束,投射被发送到丘脑,传入神经元随后在那里进行第二次突触。第三级神经元通向体感皮层,体感皮层参与疼痛的感觉质量,包括强度、持续时间和位置。

(基于 Hasudungan (2013) [3])
伤害性刺激会引发一系列事件。首先,一堆促伤害感受的炎症物质,包括钾、缓激肽、组胺和 P 物质,将在损伤附近的周围释放(表 2)。这些物质会导致痛觉过敏,即对疼痛的敏感性增加,可以测量为病变及其周围的疼痛阈值降低。
| 物质 | 来源 |
|---|---|
| 钾 (K+) | 受损细胞 |
| 血清素 | 血液(血小板) |
| 缓激肽 | 血液(血浆) |
| 组胺 | 肥大细胞 |
| 前列腺素 | 受损细胞 |
| 白三烯 | 受损细胞 |
| P 物质 | 初级神经传入纤维 |
接下来,称为伤害感受器的游离神经末梢将被有害刺激激活。它们将刺激转化为电信号,然后通过传入神经纤维传递到脊髓背角。

(基于 Marchand (2008)[1])
传入纤维分为三组:Aβ 纤维、Aδ 纤维和 C 纤维。Aβ 纤维通常传导非伤害性信号,但在此列出,因为它们参与疼痛调节,如后文所述。不同传入纤维的特征列于下表。
| Aβ 纤维 | Aδ 纤维 | C 纤维 | |
|---|---|---|---|
| 位置 | 皮肤 | 皮肤 | 皮肤、肌肉和 内脏器官 |
| 直径 | 6 至 12 µm 有髓鞘 |
1 至 5 µm 有髓鞘 |
0.2 至 1.5 µm 无髓鞘 |
| 传导 | 35 至 75 m/s | 6 至 30 m/s | 0.5 至 3 m/s |
| 作用 | 轻触, 本体感觉 |
温度, 伤害感受 |
伤害感受 (机械性,热性 |
直径和髓鞘的增加会提高刺激向脊髓的传导速度。Aδ 纤维相对快速地传导伤害性信号,这就是为什么它们负责伤害性反射(例如,如果你触摸到热的东西,你会很快把手缩回来)以及疼痛的尖锐定位。相比之下,C 纤维的传导速度较慢(无髓鞘,直径小),因此会导致持续时间较长、钝痛、没有定位的疼痛。
脊髓中的次级神经元
[edit | edit source]
(基于 Hasudungan (2013)[3])
传入神经纤维在脊髓背角与次级神经元发生第一个突触接触。此外,非伤害性和伤害性传入纤维在该连接处与重要的兴奋性中间神经元网络和疼痛神经递质(包括 P 物质或谷氨酸)发生突触相互作用。这些在伤害性信号投射到中枢神经系统高级中枢之前对其进行调节。次级神经元沿着两条主要通路向上行进:脊髓丘脑束和脊髓网状束。这两条通路在进入水平的几个节段内交叉到脊髓的对侧。在脊髓丘脑束中,次级神经元直接上升到丘脑,而在脊髓网状束中,神经元在通向丘脑之前再次在网状结构中突触。网状结构位于脑干,参与广泛的活动,包括注意力和意识。因此,人们认为它会影响对疼痛的注意水平和情绪反应的变化。
从伤害感受到疼痛
[edit | edit source]只有当伤害性信号到达皮层时,才能体验到疼痛。因此,沿着脊髓向上行进的神经元最后一次在丘脑中突触。从那里,第三级神经元将伤害性信息引导到皮层的不同结构:体感皮层(SI 和 SII)主要参与疼痛的感官辨别,而前扣带皮层 (ACC) 和岛叶皮层 (IC) 与疼痛的情感成分相关。
在体感皮层中,伤害性信息和正常的躯体感觉信息汇聚在同一个皮层区域。因此,可以处理关于疼痛位置和强度的信息,形成局部疼痛感。这种身体的皮层表示在潘菲尔德小人中描述。
疼痛感知的调节
[edit | edit source]疼痛是一个动态现象,每个人都有不同的感知。其原因是,伤害性信号不仅传递到皮层,而且在中枢神经系统内的多个层次上受到调节。这种调节包括来自脑干、自主神经系统以及负责疼痛情绪成分 (ACC 和 IC) 和认知成分 (SI 和 SII) 的皮层结构的兴奋性和抑制性机制。
这里,将只讨论抑制性内源性调节机制。它们对于理解治疗疼痛的可能性至关重要。为了更好地理解它们的作用,应注意中枢神经系统中的三个调节水平(类似于 Marchand (2008)[1])
- 产生局部镇痛的脊髓机制,即对疼痛的麻木。
- 来自脑干的下降抑制机制,产生对疼痛的弥漫性抑制。
- 高级中枢效应,要么调节下降机制,要么通过重新解释伤害性信号来改变疼痛的感知。
脊髓机制:闸门控制理论
[edit | edit source]
闸门控制理论是由 Melzack 和 Wall 在 1965 年提出的[5]。它表明疼痛可以在第一个突触处被抑制,即在初级传入纤维和脊髓水平的次级神经元之间。当 C 纤维发出信号时,它们不仅将有害信号传递给次级神经元,而且还会阻碍抑制性中间神经元。这被解释为闸门关闭,只有有害信号被传递。另一方面,如果 Aβ 纤维发出信号,它们会兴奋抑制性神经元。因此,次级神经元的激活不限于有害信号,这被解释为闸门打开。根据 C 纤维和 Aβ 纤维之间相对的发射率,疼痛信号被阻断。
闸门控制理论的一个众所周知的例子是,当你撞到肘部后,当你摩擦它时,疼痛感会减轻。它的优点是不需要进行有害操作,也不需要药物,同时可以立即调节疼痛。但是,一旦激活 Aβ 纤维的高频刺激消失(即,当你停止摩擦肘部时),疼痛水平也不会再减轻。
下降抑制机制:内源性阿片类物质
[edit | edit source]很早就已经知道鸦片及其衍生物(如吗啡和海洛因)具有止痛作用。在 20 世纪 60 年代和 70 年代,发现了它们的受体,主要位于脑干的导水管周围灰质 (PAG) 和腹侧延髓 (RVM) 以及脊髓中。这意味着,神经系统会产生类似的化学物质来内源性地调节疼痛。血清素和去甲肾上腺素是下降抑制神经系统的主要递质。这些抑制性通路然后募集脊髓中的中间神经元,从而在身体其他部位产生止痛反应,这也称为反刺激。这种调节类型的例子不仅包括许多止痛药,还包括按摩、指压和针灸。在后两种情况下,内源性系统是由额外的疼痛触发的,这就是为什么它们通常只在尝试其他调节疼痛的选项后才使用。
高级中枢效应
[edit | edit source]
研究表明,认知操作(如分散注意力、催眠或预期)会影响个体的疼痛感知[6]。关于分散注意力,观察到与疼痛处理相关的皮层区域(如体感皮层或 ACC 的内侧扣带区域)的活动减少。这种减少是由于对疼痛的注意(这是一个高度显著的刺激)与有意识地将注意力集中到涉及信息处理的另一项活动(构成分散注意力)之间的竞争造成的[7]。
此外,研究还证实,对疼痛强度的暗示可以改变与疼痛感知相关的脑部活动。[8] 这些结果支持安慰剂效应可以调节内源性疼痛调节功能的观点。后来的研究表明,前扣带回前部(rACC)及其向杏仁核和导水管周围灰质(PAG)的投射的活动增加。这一观察结果表明,安慰剂效应起源于rACC。然而,它会通过PAG调节有害刺激传递神经元活动的能力来影响疼痛感知。杏仁核对该回路的影响来自其在刺激情绪解释中的作用。它将允许通过无意识的条件作用过程来调节疼痛,而不仅仅是通过源自rACC的意识预期[9]。
幻肢痛
[edit | edit source]历史
[edit | edit source]被称为幻肢痛和幻肢感觉的现象在16世纪就已经为人所知。法国军医安布鲁瓦·帕雷是第一个在1551年对幻肢痛和幻肢感觉进行医学记录的人。

“对于那些患者来说,在截肢手术很长时间以后,他们仍然说他们在截肢部位感到疼痛。他们对此强烈抱怨,这对于没有经历过这种情况的人来说是值得注意的,甚至令人难以置信”。[10]
1830年,苏格兰神经学家查尔斯·贝尔在《人体神经系统》中发表了对这种现象的描述。然而,直到1871年,美国军医西拉斯·韦尔·米切尔才引入了“幻肢痛”这个词。他首次对许多截肢者经历的术后“幽灵”感觉进行了现代描述。

“成千上万个幽灵肢体困扰着同样多的好士兵,不时折磨着他们,这几乎是一种悲剧,一种可怕的事情……当……肢体存在的强烈感觉使人做出一些努力时,这种努力的失败会突然提醒他自己的损失”。[10]
幻肢感觉和幻肢痛之间的差异
[edit | edit source]幻肢痛和幻肢感觉是密不可分的。但是,它们并不相同,因此必须将它们区分开来。
幻肢感觉包括本体感觉,如肢体长度、周长或姿势的感觉;运动感觉,如自发或有意运动;以及外部感觉,如刺痛、瘙痒或压迫感[11]。这些感觉可能出现在截肢后、先天性肢体缺失或肢体感觉消失后,例如脊髓损伤[10]。研究表明,90%至98%的患者都会经历幻肢感觉[12][13][14]。大约25%至40%的幻肢感觉患者会经历一种特殊现象,称为缩短,即感觉幻肢随着时间的推移逐渐缩短,直到它连接到残肢或进入残肢[14][15]。
幻肢痛是可变的,可以描述为灼痛、刺痛或跳痛等感觉[16]。此外,还会出现非常复杂的疼痛感觉,例如感觉幻肢扭曲或指甲深深地刺入幻肢手掌[11]。大多数人在截肢后会经历幻肢痛,患病率在55%到85%之间[17][10]。在许多情况下,残肢和幻肢都会疼痛,难以区分两者。
研究还表明,几乎所有经历幻肢感觉的截肢者都会遭受幻肢痛;反之则很少见[10]。
| 幻肢感觉 | 幻肢痛 | |
|---|---|---|
| 症状学 | 本体感觉和运动感觉。 | 灼痛、刺痛或跳痛等感觉。 |
| 起源 | 截肢、先天性肢体缺失或肢体敏感性消失。 | 截肢 |
| 共病症 | 主要与幻肢痛一起出现。 | 很少与幻肢感觉一起出现。 |
流行病学
[edit | edit source]在过去的几十年中,许多关于幻肢痛和幻肢感觉的临床研究已经开展,概述了患有该综合征的患者中的一些共同趋势。
幻肢痛的患病率已被证明与截肢水平有关:截肢水平越高,中度至重度幻肢痛的发生率就越高[10]。也有一些迹象表明,在计划对无痛肢体进行手术截肢的情况下,疼痛的发生率可能低于由于创伤性幻肢丧失或之前存在疼痛的幻肢而造成的疼痛[12]。此外,疼痛通常感觉在幻肢的最远端,如手部手指或腿部脚趾。据推测,这是因为肢体末端在体感皮层中具有更大的代表性[13][14]。有趣的是,下肢截肢者的幻肢痛患病率远高于上肢截肢者[10]。
在频率方面,幻肢痛在一些患者中持续存在,而在另一些患者中,它往往以疼痛发作的形式间歇出现[18]。然而,即使在这些情况下,在两次发作之间也可能存在持续性疼痛。疼痛发作可能持续几秒钟到几个小时不等。在极少数情况下,患者可能经历持续数天的发作[17]。

幻肢痛通常在截肢后最初几天到几周内开始,但它也可能在截肢多年后开始,由残肢手术引发[17]。这种疼痛可能会在截肢后持续很多年。然而,不同的临床研究对幻肢疼痛持续的时间存在分歧。例如,对因血管功能不全而失去肢体的老人患者的研究结果与对因受伤后创伤性截肢的年轻截肢者研究结果不同[10]。然而,几项研究报告了共同趋势:只有16%经历过幻肢痛的人不再遭受这种疼痛,而另有37%的人疼痛明显减轻,44%的人遭受着同样的疼痛,而3%的人疼痛随着时间的推移而加剧[19][17]。另一个共同的基准是,如果疼痛在截肢后六个月仍然持续存在,那么治疗起来就会非常困难[20]。
有趣的是,许多患者经常抱怨截肢前肢体存在的疼痛在幻肢中持续存在。这种疼痛的持续可能是感觉记忆的一种形式。[21]与这些发现相关的是,据报道,幻肢感觉在儿童中比成人中不常见。一种可能的解释是,在幼童中,身体形象还没有足够的时间巩固。事实上,根据一些研究,幻肢感觉的发生率随着儿童年龄的增长而急剧增加。[12]
根据一项对 139 名患者进行的研究[18],幻肢痛可以由[17]
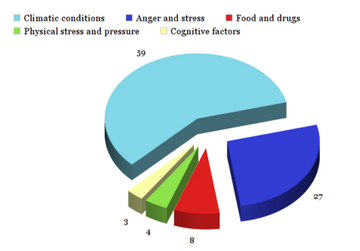
- 气候条件:59%。其中 55% 归因于天气,1% 归因于季节,3% 归因于环境温度。
- 愤怒和压力:27%
- 食物/药物:8%
- 身体压力:4%
- 认知因素:3%。认知因素的例子包括将注意力集中在幻肢上和观察损伤。
为什么这些因素会引发幻肢痛将在下一节中阐明。
幻肢痛的来源
[edit | edit source]根据幻肢痛被认为是一种多因素疼痛综合征的事实,目前关于幻肢痛病理生理学的理论通常被分为周围、中枢和心理成分。这三个领域之间有着密切的联系。
周围机制
[edit | edit source]截肢后,细胞分化发生,导致远端周围神经退化以及神经瘤的形成 - 神经组织中的生长或肿瘤。[22]

神经瘤由存活的近端神经节段再生形成,可以产生异常放电,导致疼痛持续存在。事实上,在一些研究中,发现与对侧肢体相比,残肢肌肉的活动过度。[23] [13]这种过度活动以细纤维束轻微抽搐甚至整个残肢痉挛的形式出现。
周围神经传导阻滞不能消除疼痛,以及即使通过药物治疗或手术消除周围神经的异位放电后疼痛仍然可以持续的事实证明,幻肢痛是一种复杂的机制,不仅仅是由于神经瘤的形成。[21]事实上,还有一些额外的周围机制参与了幻肢痛:血液循环影响和交感神经激活。
a) 血液循环影响
[edit | edit source]在低温下,我们的交感神经系统受到刺激,导致皮肤、手臂和腿部的血管收缩。[24]这反过来会导致残肢灌注不足,这会增加伤害感受神经纤维的活动,从而增强疼痛的感觉。这是由于缺血和神经元冷却。[18]这些血管机制是天气成为幻肢痛主要触发因素的原因之一。
此外,在一些研究中,已经确定了残肢中短暂的强烈的肌肉紧张增加与随后的幻肢痛发作之间的联系。[24]机械压力和强烈的肌肉收缩也可能具有灌注效应,这反过来会导致疼痛加重。此外,灌注效应也可能作为某些食物和药物(如咖啡)的后果出现,解释了它们引发疼痛的性质。
b) 交感神经激活
[edit | edit source]在神经瘤中,交感神经传出神经末梢可能与伤害感受传入神经缠绕在一起,直接相互作用并导致交感神经活动增加和幻肢痛加重。[25]
中枢神经因素
[edit | edit source]如前所述,幻肢痛并非仅仅由周围机制引起。幻肢感觉的复杂性也表明,这些感知涉及更高阶的神经结构。[11]
a) 神经矩阵理论
[edit | edit source]解释中枢神经系统中幻肢痛的主要理论是神经矩阵理论。神经矩阵包括皮层,尤其是初级体感皮层和后顶叶,丘脑和边缘系统。

该理论假设神经系统中身体的表征不断受到感觉输入的修改,从而创造出神经特征。在去除身体部位后,神经矩阵的持续存在会在幻肢上产生无痛感,而疼痛则是由于神经矩阵内部的异常重组造成的。更具体地说,神经矩阵在截肢后继续发送传出信号,而这些信号的改变可能是导致疼痛的原因。理论上,可以通过消除神经矩阵的传出信号,或通过电刺激产生正常的返回信号来减少疼痛。事实上,一些研究表明,幻肢痛可能与丘脑对截肢肢体的表征的神经活动和功能有关。这可以通过以下事实证明:腹侧尾侧丘脑的微刺激在幻肢中产生疼痛感。[21]
虽然神经矩阵假说可以用于描述疼痛的来源,但它不能解释为什么缓解幻肢感觉很少减轻幻肢痛,为什么感觉可以突然消失,以及为什么并非所有截肢者都会出现幻肢痛。[21]因此,必须考虑其他可能的解释。
b) 中枢过度反应
[edit | edit source]一些研究表明,在截肢和其他类型的神经损伤后,中枢神经系统可能出现过度兴奋状态。[23] [13]
皮质重组
[edit | edit source]除了过度反应,并且可能是其结果,在截肢后,身体的皮质表征发生变化。这些变化通常在去神经支配后观察到,并且在初级体感皮层中尤为明显。

在灵长类动物和人类中,多项研究发现,截肢后数月,初级体感皮层中与截肢部位相邻的身体部位的代表区域会扩大几毫米,几乎完全占据了截肢部位的原有区域。 [26] [27] [28] [29] 值得注意的是,这种重组发生的区域在截肢下肢患者中差异更大。这种皮层重组甚至可以在局部麻醉期间观察到为短暂的改变。 [30] [31] 以及由于某个身体部位的强化训练而发生相反的变化。 [32] 这也在运动皮层中发生,可能是由于体感皮层和运动皮层之间强烈的连接。 [33] [34] 直观地,人们可能会认为这种重排是有益的,因为原本未被利用的皮层区域可以用于身体的实际部位,从而消除身体方案中丢失的肢体,并减少幻肢痛。但这项重组的代价很大,并且观察到重组程度与幻肢痛强度之间存在正相关关系。 [29] [35] 这些结果让人们相信,皮层重组实际上是一种适应不良的可塑性,是幻肢痛的原因之一。 [36]
皮层重组是通过三种基本机制介导的
a) 皮层过程
[edit | edit source]对于短期重组,主要机制是揭示相邻区域之间现有潜在连接。 [31] 假设这种机制是由兴奋性和抑制性传入之间的平衡变化触发的。 [37] [30] 然而,对于长期重组过程,会形成新的神经连接。因此,在这种情况下,除了功能性变化外,还会发生结构性变化。 [18]
b) 脊髓过程
[edit | edit source]在严重或长时间的伤害性刺激的情况下,前面提到的中枢敏化也可能发生在脊髓背角神经元中。这会导致自发活动增加和对非伤害性刺激的反应性增加 [38] [39],从而使疼痛在伤害性刺激消失后很长时间内持续存在。
到目前为止,所有关于截肢引起脊髓变化的研究都来自动物实验。这些实验表明,来自残肢的传入纤维延伸到脊髓和脑干的去神经支配区域。 [40] [10]
对烧伤患者的研究也揭示了脊髓神经元在疼痛产生中的作用。这些研究表明,烧伤后,脊髓神经元放电率会增加,导致神经元过度兴奋。这种过度兴奋不受损伤部位局部麻醉阻滞的影响。这表明已经产生了敏化或“疼痛记忆”。应用于截肢患者,这表明在手术截肢之前和期间阻滞脊髓可能有助于减少或预防脊髓中的这种敏化过程。 [21]
完全脊髓损伤的人也可能经历幻肢痛,表明除了周围神经和脊髓过程外,中枢神经系统的变化也可能参与疼痛的产生。 [10]
c) 丘脑过程
[edit | edit source]除了深部脑刺激(揭示了丘脑对幻肢痛的贡献)外,关于丘脑在这种情况下所起的作用,人们知之甚少。动物实验中使用局部麻醉报告了丘脑中某些身体部位代表的短期可逆重组。 [41]
心理因素
[edit | edit source]正如流行病学部分所述,压力和愤怒也被认为是幻肢痛的诱发因素。事实上,在一项研究的 74% 受试者中,压力和幻肢痛之间存在一致且总体紧密的正相关关系。 [18] 这可能是因为心理压力和生理压力都具有伤害性作用,包括生理机制,例如交感神经激活、血管收缩和肌肉紧张,而这些都是诱发机制。许多患者还报告说,幻肢痛可以通过意识来增强甚至触发,反之,幻肢痛可以通过分散注意力来减轻。 [11] [12]
幻肢痛的治疗
[edit | edit source]幻肢痛仍然缺乏有效的治疗方法。一些使用的治疗方法包括:止痛药(效果有限)、神经安定剂、抗抑郁药、神经阻滞、神经系统刺激(特别是脊髓和残肢中的神经,但也包括深部脑刺激)、振动疗法和残肢按摩、热敷、生物反馈和针灸。在某些情况下,会进行手术切除缠绕神经的瘢痕组织。 [42] [43] 另一种流行的疗法是使用镜子,让患者通过观察剩余肢体的反射来“看到”幻肢。与其他疗法一样,这种方法并不完全有效,对许多患者无效。事实上,大约 40% 的人从镜面疗法中没有获益。 [44]
疼痛治疗
[edit | edit source]非甾体抗炎药 (NSAID)
[edit | edit source]NSAID 用于治疗轻度至中度疼痛,例如头痛、扭伤或牙痛。NSAID 具有抗炎作用,因此对于治疗关节炎和术后疼痛等损伤或疾病也十分有效。NSAID 通过发挥 COX-2 抑制剂的作用。它们直接靶向环氧合酶-2 (COX-2),这是一种产生前列腺素的酶,前列腺素负责炎症和疼痛。它们也被证明对减少癌症和癌前病变的发生以及抑制精神疾病(如抑郁症和精神分裂症)中的炎症性神经退行性病变途径具有积极作用。 [45] [46] 然而,它们具有严重的副作用。NSAID 会显着增加心脏病发作和中风的风险。
属于 NSAID 类别,抑制 COX-2 以及前列腺素的产生,包括一系列药物
布洛芬
[edit | edit source]
布洛芬属于 NSAID 类别。它通过抑制环氧合酶 COX-1 和 COX-2 来阻止前列腺素的产生。它用于治疗疼痛、发烧和炎症。它的半衰期在 1 到 3 小时之间。 [47]
萘普生
[edit | edit source]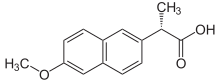
萘普生是一种非甾体抗炎药,用于治疗疼痛、发烧和炎症,其作用时间相对较长,为 8-12 小时。[48]

乙酰水杨酸是一种非甾体抗炎药,属于水杨酸盐类。它可以治疗疼痛、发烧和炎症,并抑制血小板的聚集。其作用机制与其他非甾体抗炎药类似。乙酰水杨酸用于治疗不同原因引起的發燒和疼痛。通常,它用于治疗急性疼痛,如头痛、牙痛、关节、肌腱或背部的疼痛,以及感冒引起的發燒和疼痛。它还可以每天小剂量使用,以预防血栓形成。[49]

扑热息痛也称为达菲®或必理痛®。它源于乙酰苯胺,乙酰苯胺是 1880 年推出的首批抗发烧药物之一。扑热息痛用于缓解疼痛和退烧。与非甾体抗炎药不同,它不治疗炎症,也不抑制血小板的聚集。然而,它也参与阻断前列腺素的合成。它的半衰期约为 2 到 3 小时,比较短。其作用持续约 4 到 6 小时。可能的应用领域包括:头痛、牙痛、肌肉和关节疼痛、手术后疼痛或发烧和流感引起的疼痛。[50]

美沙吡林是一种(非酸性)止痛药,属于吡唑酮类药物。它是一种前药,在体内转化为不同的活性代谢物。美沙吡林可用于治疗疼痛、发烧和痉挛。由于其解痉特性,它常用于治疗绞痛。其作用机制尚未完全了解。可能的药物靶标是环氧合酶和内源性大麻素受体。[51]
阿片类药物在疼痛管理中起着至关重要的作用,尤其是对于中度至重度疼痛。它们用于治疗急性疼痛,以及姑息治疗和退行性疾病的疼痛治疗。吗啡是典型的阿片类药物。阿片类药物与阿片类受体相互作用,阿片类受体是 G 蛋白偶联受体,主要存在于大脑和脊髓中,但也存在于胃肠系统和其他组织中。阿片类药物与阿片类受体结合,激活 G 蛋白,导致 cAMP 产生、Ca2+ 流入和 K+ 流出的抑制效应,从而导致细胞超极化和神经元兴奋性的降低。在脊髓中,阿片类药物抑制来自初级感觉神经元的 P 物质的释放,减少疼痛感觉传递到大脑。在脑干中,阿片类药物调节伤害性感觉的传递。[52]

抗抑郁药用于治疗神经性疼痛和纤维肌痛。止痛效果也出现在非抑郁症患者身上,因此它们的作用不仅仅是改善可能伴随慢性疼痛的抑郁状态。具有止痛效果的抗抑郁药的例子包括三环类抗抑郁药 (TCA) 和选择性血清素去甲肾上腺素再摄取抑制剂 (SNRI)。抗抑郁药没有伤害性效应,但会作用于蓝斑,并与去甲肾上腺素结合,去甲肾上腺素参与疼痛的内在控制。然而,确切的机制尚不清楚。[53]
抗癫痫药用于治疗神经性疼痛。抗癫痫药缓解神经性疼痛有几种不同的方式。例如,苯妥英和卡马西平等较老的抗癫痫药,主要用于治疗三叉神经痛,通过通过频率依赖性阻断钠通道来降低神经元兴奋性。[54]


深部脑刺激 (DBS) 自 1970 年代初就被用于治疗慢性疼痛。DBS 在治疗慢性疼痛方面显示出良好的效果,包括失败的背部手术综合征 (FBSS)、幻肢痛和周围神经性疼痛,与神经性疼痛相比,伤害性疼痛的反应率更高。它在头痛方面也显示出有希望的结果,其中丛集性头痛的成功率最高。[55] 然而,随着时间的推移,DBS 缓解疼痛的能力随着对它应用的耐受性增加而降低。这对于治疗慢性疼痛来说尤其重要。可能的解决方案是定期停用 DBS 以降低耐受性,或在闭环中使用自适应 DBS 系统。
开发第二种可能性至关重要的一个方面是识别用于调节刺激的有用生物标志物。有三种主要策略来实现这一目标。首先,监测不同大脑区域在疼痛缓解刺激过程中或之后的神经活动,可以帮助识别哪些区域在有效刺激期间活动更强或更弱。然后,DBS 系统可以尝试复制相同的活动以诱导疼痛缓解。其次,应用区域神经活动的频谱分析可以帮助预测信号的有效性。第三,同时记录不同大脑区域的神经活动,可以根据该时刻的功能性大脑连接调节刺激。[56]。
DBS 对疼痛产生影响的途径尚未完全了解。然而,一些试验有助于制定不同的假设。当 DBS 应用于腹侧后外侧 (VPL)、腹侧后内侧丘脑 (VPM)、脑室周围灰质 (PVG) 或导水管周围灰质 (PGA) 时,低频信号 (≤50 Hz) 会导致镇痛效果,而高频信号 (>70 Hz) 会引起痛觉过敏。因此,假设 DBS 的镇痛效果可能源于联合低频神经活动的增强或高频神经活动的破坏。[57]。
在一些州,大麻可以作为医疗用药。它通常作为其他药物无法使用时的慢性疼痛治疗手段。大麻的作用是通过大麻素受体 CB1 和 CB2 介导的。然而,由于对人体进行大麻测试的规定非常严格,缺乏科学证据。获得使用 THC 进行研究的许可几乎是不可能的。允许对大麻进行研究将有助于识别引起不良反应的化合物或化合物组合,并开发一种有效、有效和安全的全新药物。[58]
为了绕过这些限制,一些科学家正在研究一种替代方案:大脑中天然产生的类似大麻的化合物,称为内源性大麻素。它们以类似于大麻素的方式作用于神经元,并有助于调节疼痛、食欲和焦虑。当分子与 CB1 受体结合时,会导致疼痛缓解。研究还使用正向变构调节剂 (PAM) 进行,PAM 会增加信号分子 (在本例中为内源性大麻素) 找到其受体 (此处为 CB1 受体) 的可能性。这样,PAM 只能在内源性大麻素已经被释放的条件下增强内源性大麻素的信号传导。[59]
- ↑ a b c d Marchand, S. (2008), ‘The physiology of pain mechanisms: From the periphery to the brain’, Rheumatic Disease Clinics of North America 34(2), 285-309.
- ↑ ScoreUSMLE (2015), ‘Spinal pathways made super easy (part 1-2)’, Youtube 视频, (访问日期 2015 年 7 月 21 日).
- ↑ a b Hasudungan, A. (2013), ‘Nociceptors - an introduction to pain’ (解释了上行通路,非常容易理解),Youtube 视频,(访问日期 2015 年 7 月 21 日)。
- ↑ Patel, N. B. (2010), ‘Physiology of pain’, 摘自 Kopf 和 Patel(编)„Guide to Pain Management in Low-Resource Settings“,2010 年,国际疼痛研究协会。
- ↑ Melzack, R. & Wall, P. D. (1965), ‘Pain mechanisms: a new theory’, Science 150, 971--979。
- ↑ Apkarian, A. V., Bushnell, M. C., Treede, R. D. & Zubieta, J. K. (2005), ‘Human brain mechanisms for pain perception and regulation in health and disease’, European Journal of Pain 9(4), 463-484。
- ↑ Malcom H. and Johnson MA (2005). "How Does Distraction Work in the Management of Pain". Current Pain and Headache Reports. 9: 90–95.
- ↑ Goffaux, P., Redmond, W. J., Rainville, P. & Marchand, S. (2007), ‘Descending analgesia – when the spine echoes what the brain expects’, Pain 130(1-2), 137-143。
- ↑ U. Bingel, J. Lorenz, E. Schoell, C. Weiller, C. Büchel (2006). "Mechanisms of placebo analgesia: rACC recruitment of a subcortical antinociceptive network". Pain. 120: 8–15.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c d e f g h i j C. M. Kooijman, P. U. Dijkstra, J. H. B. Geertzen, A. Elzinga, and C. P. Van Der Schans, “Phantom pain and phantom sensations in upper limb amputees: An epidemiological study,” Pain, vol. 87, no. 1, pp. 33–41, 2000.
- ↑ a b c d P. Jensen, T.S. & Rasmussen, Phantom pain and other phenomena, Textbook o. Edinburgh: Churchill Livingstone, 1994.
- ↑ a b c d e V. S. Ramachandran and W. Hirstein, “The perception of phantom limbs. The D. O. Hebb lecture,” Brain, vol. 121, no. 9, pp. 1603–1630, 1998.
- ↑ a b c d B. Cronholm, Phantom limbs in amputees: a study of changes in the integration of centripetal impulses with special reference to referred sensations. Stockholm, 1951.
- ↑ a b c E. Frank, B. & Lorenzoni, “Phantomerleben und Phantomschmerz. Fortschritte der Neurologie und Psychiatrie,” vol. 60, pp. 74–85, 1992.
- ↑ L. Schmalzl, “‘Pulling telescoped phantoms out of the stump’: Manipulating the perceived position of phantom limbs using a full-body illusion,” Front. Hum. Neurosci., vol. 5, no. November, pp. 1–12, 2011
- ↑ K. Sherman, R.A., Katz, J., Marbach, J.J. & Heermann-Do, Locations, characteristics, and descriptions. New York: Plenum Press, 1997.
- ↑ a b c d e M. Döbler, K. & Zenz, “Stumpf- und Phantomschmerz,” in Lehrbuch der Schmerztherapie, Stuttgart: Wissenschaftliche Verlagsgesellschaft, 1993, pp. 377–384.
- ↑ a b c d e C. Winter-Barnstedt, “Phantomschmerz nach Extremitätenamputation : Diagnostik und Biofeedback-Behandlung,” Ruprecht-Karls-Universität Heidelberg, 2001.
- ↑ S. W. Wartan, W. Hamann, J. R. Wedley, and I. McColl, “Phantom pain and sensation among British veteran amputees.,” Br. J. Anaesth., vol. 78, pp. 652–659, 1997.
- ↑ C. Sherman, RA, Sherman, “Prevalence and characteristics of chronic phantom limb pain among American veterans: results of a trial survey,” Am. J. Phys. Med., vol. 62, no. 5, pp. 227–238, 1983.
- ↑ a b c d e R. G. Bittar, S. Otero, H. Carter, and T. Z. Aziz, “Deep brain stimulation for phantom limb pain.,” J. Clin. Neurosci., vol. 12, no. 4, pp. 399–404, 2005.
- ↑ “Neuroma,” 维基百科,2016 年。[在线]。可用: 神经瘤 [访问日期: 2016 年 6 月 5 日]。
- ↑ a b W. Larbig, P. Montoya, H. Flor, H. Bilow, S. Weller, and N. Birbaumer, “Evidence for a change in neural processing in phantom limb pain patients.,” Pain, vol. 67, no. 2–3, pp. 275–283, 1996.
- ↑ a b R. A. Sherman, V. D. Griffin, C. B. Evans, and A. S. Grana, “Temporal relationships between changes in phantom limb pain intensity and changes in surface electromyogram of the residual limb,” Int. J. Psychophysiol., vol. 13, no. 1, pp. 71–77, 1992.
- ↑ R. A. Sherman, J. G. Arena, C. J. Sherman, and J. L. Ernst, “The mystery of phantom pain: Growing evidence for psychophysiological mechanisms,” Biofeedback Self. Regul., vol. 14, no. 4, pp. 267–280, 1989
- ↑ M. M. Merzenich, R. J. Nelson, M. P. Stryker, M. S. Cynader, A. Schoppmann, and J. M. Zook, “Somatosensory cortical map changes following digit amputation in adult monkeys.,” J. Comp. Neurol., vol. 224, no. 4, pp. 591–605, 1984.
- ↑ T. P. Pons, E. G. Preston, A. K. Ommaya, H. K. Jon, E. Taub, and M. Mishkin, “Massive Cortical Reorganization After Sensory Deafferentation in Adult Macaques,” Science (80-. )., vol. 252, no. 5014, pp. 1857–1860, 1991.
- ↑ T. Elbert, H. Flor, N. Birbaumer, S. Knecht, S. Hampson, W. Larbig, and E. Taub, “Extensive reorganization of the somatosensory cortex in adult humans after nervous system injury.,” Neuroreport, vol. 5, no. 18, pp. 2593–2597, 1994.
- ↑ a b H. Flor, T. Elbert, S. Knecht, C. Wienbruch, C. Pantev, N. Birbaumer, W. Larbig, and E. Taub, “Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation.,” Nature, vol. 375, no. 6531, pp. 482–484, 1995.
- ↑ a b H. Buchner, C. Kauert, and I. Radermacher, “Short-term changes of finger representation at the somatosensory cortex in humans,” Neurosci. Lett., vol. 198, no. 1, pp. 57–59, 1995.
- ↑ a b P. M. Rossini, G. Martino, L. Narici, A. Pasquarelli, M. Peresson, V. Pizzella, F. Tecchio, G. Torrioli, and G. L. Romani, “Short-term brain ‘plasticity’ in humans: transient finger representation changes in sensory cortex somatotopy following ischemic anesthesia,” Brain Res., vol. 642, no. 1–2, pp. 169–177, 1994.
- ↑ W. M. Jenkins, M. M. Merzenich, M. T. Ochs, T. Allard, and E. Guic-Robles, “Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation,” J. Neurophysiol., vol. 63, no. 1, pp. 82–104, 1990.
- ↑ A. Karl, N. Birbaumer, W. Lutzenberger, L. G. Cohen, and H. Flor, “Reorganization of motor and somatosensory cortex in upper extremity amputees with phantom limb pain.,” J. Neurosci., vol. 21, no. 10, pp. 3609–18, 2001.
- ↑ R. Chen, B. Corwell, Z. Yaseen, M. Hallett, and L. G. Cohen, “Mechanisms of cortical reorganization in lower-limb amputees.,” J. Neurosci., vol. 18, no. 9, pp. 3443–50, 1998.
- ↑ H. Flor, T. Elbert, W. Mühlnickel, C. Pantev, C. Wienbruch, and E. Taub, “Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees,” Exp. Brain Res., vol. 119, no. 2, pp. 205–212, 1998.
- ↑ E. a Franz 和 V. S. Ramachandran,“截肢者双侧肢体耦合现象,”Nat. Neurosci.,第 1 卷,第 6 期,第 443–444 页,1998 年。
- ↑ M. Calford 和 R. Tweedale,“成年狐蝠切除手指后体感皮层的即刻和慢性变化,”Nature,第 332 卷,第 6163 期。第 446–448 页,1988 年。
- ↑ L. Arendt-Nielsen 和 S. Petersen-Felix,“风吹现象和神经可塑性:它们与临床疼痛之间存在相关性吗?”,Eur. J. Anaesthesiol. Suppl.,第 10 卷,第 1–7 页,1995 年。
- ↑ J. Li,D. A. Simone 和 A. A. Larson,“风吹现象导致中枢敏化的特征,”Pain,第 79 卷,第 1 期,第 75–82 页,1999 年。
- ↑ S. L. Florence 和 J. H. Kaas,“治疗性截肢猴子手部后,体感通路多个层次的重组,”J. Neurosci.,第 15 卷,第 12 期,第 8083–8095 页,1995 年。
- ↑ M. A. Nicolelis,R. C. Lin,D. J. Woodward 和 J. K. Chapin,“通过阻断上行皮肤信息,立即诱导丘脑网络时空变化,”Nature,第 361 卷,第 6412 期,第 533–6 页,1993 年。
- ↑ “幻肢,”维基百科,2016 年。[在线]。可获取:w: 幻肢 幻肢 [访问日期:2016 年 6 月 5 日]。
- ↑ “疼痛管理健康中心,”WebMD,2015 年。[在线]。可获取:幻肢痛| [访问日期:2016 年 5 月 5 日]。
- ↑ J. Foell,R. Bekrater-Bodmann,M. Diers 和 H. Flor,“镜面疗法治疗幻肢痛:大脑变化以及身体表征的作用,”Eur. J. Pain,第 1–11 页,2013 年。
- ↑ COX-2 抑制剂与癌症:问题与解答” 2004 年。美国国立癌症研究所。2004 年。 http://www.cancer.gov/cancertopics/factsheet/APCtrialCOX2QandA。
- ↑ Muller,Norbert。2010 年。“COX-2 抑制剂作为抗抑郁药和抗精神病药:临床证据”。《研究性药物现状》(伦敦,英国:2000 年)第 11 卷(第 1 期)。英国:31–42。
- ↑ “布洛芬”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=ibuprofen。
- ↑ “萘普生”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=metamizol。
- ↑ “乙酰水杨酸”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=Acetylsalicylsäure。
- ↑ “扑热息痛”。2018 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=paracetamol。
- ↑ “美沙酮”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=metamizol。
- ↑ Hemmings,H. C. 和 Egan,T. D.(2013 年)。阿片类激动剂和拮抗剂。麻醉药理学与生理学:基础与临床应用。费城,宾夕法尼亚州:Elsevier/Saunders。
- ↑ Obata,H.(2017 年)。抗抑郁药治疗神经性疼痛的镇痛机制。《国际分子科学杂志》,第 18 卷(第 11 期),第 2483 页。doi:10.3390/ijms18112483。
- ↑ Ryder,S. 和 Stannard,C. F.(2005 年)。慢性疼痛的治疗:抗抑郁药、抗癫痫药和抗心律失常药。《麻醉、重症监护和疼痛继续教育》,第 5 卷(第 1 期),第 18-21 页。doi:10.1093/bjaceaccp/mki003。
- ↑ Falowski,Steven M. 2015 年。“慢性疼痛的脑深部刺激”。《当前疼痛与头痛报告》,第 19 卷(第 7 期)。美国:27。doi:10.1007/s11916-015-0504-1。
- ↑ Shirvalkar,P.,Sellers,K. K.,Schmitgen,A.,Prosky,J.,Joseph,I.,Starr,P. A. 和 Chang,E. F.(2020 年)。“治疗慢性疼痛的脑深部刺激试验期”。《临床医学杂志》。9(第 10 期):3155。
{{cite journal}}:CS1 维护:作者列表的多个名称 (链接) - ↑ Alamri,A. 和 A.C. Pereira,E.(2022 年)。“治疗慢性疼痛的脑深部刺激”。《北美神经外科诊所》。33(第 3 期):311–321。
{{cite journal}}:CS1 维护:作者列表的多个名称 (链接) - ↑ Fields,Douglas。2014 年。“‘医疗大麻’的荒谬性”。BrainFacts.org。2014 年。 http://www.brainfacts.org/thinking-sensing-and-behaving/diet-and-lifestyle/2014/the-absurdity-ofmedical-marijuana。
- ↑ Burrell,Teal。2017 年。“揭示大麻素的治疗可能性”。BrainFacts.org。2017 年。 http://www.brainfacts.org/thinking-sensing-and-behaving/diet-and-lifestyle/2017/smoking-out-thetherapeutic-possibilities-of-cannabinoids-42017。


