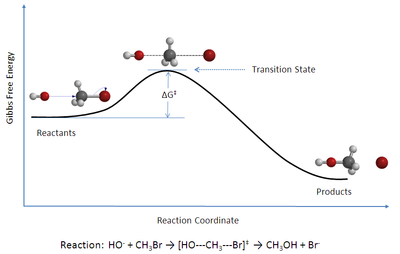
 图 1:溴甲烷与氢氧根阴离子双分子亲核取代 (SN2) 反应的反应坐标图
图 1:溴甲烷与氢氧根阴离子双分子亲核取代 (SN2) 反应的反应坐标图
化学动力学描述了物种浓度通过化学反应随时间的变化速率。
- 速率=
![{\displaystyle k[A]^{v_{a}}[B]^{v_{b}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04444b893cbcb8218edf488f91e98ab204278f02)
速率常数 k 取决于反应的化学物质和反应条件(即温度)。
使用速率理论,可以通过统计热力学估计基本气相化学反应的速率常数。艾林传统过渡态理论是最简单和使用最广泛的理论之一。
在艾林传统过渡态理论中,化学反应的速率常数可以用过渡态和反应物的配分函数来表示。 是反应的势垒高度。
是反应的势垒高度。

过渡态理论在其推导中依赖于三个关键假设。
- 反应物与过渡态结构处于不断的平衡状态。
- 粒子的能量服从玻尔兹曼分布。
- 一旦反应物变成过渡态,过渡态结构就不会塌回反应物。
假设一个反应,其中反应物 A 和 B 转换成过渡态 C
![{\displaystyle {\ce {A+B<=>{}[C]^{\ddagger }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6aae1d9631c9c68b5f13f1e359d1bf9475014d1d)
平衡常数 K‡ 可以用反应物和过渡态的浓度来表示。
![{\displaystyle K^{\ddagger }={\frac {\ce {[C]^{\ddagger }}}{\ce {[A][B]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb54ef9dc837eff8cc17cec2f0c692d1bc13b4ae)
这个反应作为平衡存在,因为我们假设并非每次碰撞都会导致过渡态的形成。用配分函数重写浓度,得到下面的方程。

艾林方程也可以用热力学参数来表示。标准自由能 ΔG‡ 可以用平衡常数来表示。


利用标准吉布斯能量方程,艾林方程可以写成

这里, 是活化焓,代表过渡态结构的焓或能量稳定性;它是断裂反应物键并形成过渡态所需的能量。类似于标准焓,负值代表更稳定的能量结构,反之亦然。
是活化焓,代表过渡态结构的焓或能量稳定性;它是断裂反应物键并形成过渡态所需的能量。类似于标准焓,负值代表更稳定的能量结构,反之亦然。  是活化熵,代表过渡态的熵或无序程度,是过渡态与反应物相比的可达状态数。同样,正熵代表更无序的系统,而负熵对应于更有序的系统。
是活化熵,代表过渡态的熵或无序程度,是过渡态与反应物相比的可达状态数。同样,正熵代表更无序的系统,而负熵对应于更有序的系统。
使用艾林方程的热力学表示可以预测反应可能采取的机理类型。缔合机理涉及一个分子与另一个分子键合形成过渡态,而解离机理涉及一个分子断裂形成过渡态。一般来说,当过渡态的熵低于反应物时,就会发生缔合机理,因此过渡态更加有序;这意味着熵的变化为负。其结果是熵降低,结构更加有序,可达状态更少。相反,当过渡态的熵为正,或相对于反应物而言过渡态的熵更高时,就会发生解离机理。因此,过渡态比初始反应物更无序。
TST 需要计算过渡态结构的配分函数。

过渡态的平动和转动配分函数与反应物物种中使用的形式相同。振动配分函数略有不同,因为对应于越过势垒的振动从该项中去除(它“变成” 项。因此,振动配分函数中少了一个项。对于非线性过渡态,将有
项。因此,振动配分函数中少了一个项。对于非线性过渡态,将有 项。对于线性过渡态,将有
项。对于线性过渡态,将有 项。
项。

使用该理论计算速率常数需要知道过渡态的所有结构和机械性质。这是一个挑战,因为很难使用光谱法测定过渡态的结构性质,而过渡态通常只存在 10-200 fs。相反,计算化学通常用于计算过渡态的性质。
计算 H + H2 在 300 K 时的速率常数。
H + H2 → H2 + H
为了计算速率常数,需要以下内容,对于反应物和过渡态
- 同位素的质量
- 振动频率 (qvib)
- 惯性矩 (qrot)
- 电子简并度
- 反应势垒高度
| 物种 |
振动 |
 (cm-1) (cm-1) |
| H2 |
H-H 伸缩 |
4401.1272
|
| H-H-H‡ |
H-H-H 弯曲(简并度为 2) |
875.62
|
| H-H-H‡ |
H-H-H 对称伸缩 |
2050.67
|
反应物的 R = 0.743 Å,过渡态的 R = 0.931 Å  ‡ = 38.61 kJ mol-1
‡ = 38.61 kJ mol-1
平动配分函数

对于 H2: 

对于 H-H-H:

旋转配分函数
对于 H2 : 


对于 H-H-H: 


振动配分函数
对于 H2:



速率常数 k




w:过渡态理论
Atkins, P., de Paula, J., 物理化学基础, 第 5 版;牛津大学出版社,2009 年。


![{\displaystyle k[A]^{v_{a}}[B]^{v_{b}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04444b893cbcb8218edf488f91e98ab204278f02)


![{\displaystyle {\ce {A+B<=>{}[C]^{\ddagger }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6aae1d9631c9c68b5f13f1e359d1bf9475014d1d)
![{\displaystyle K^{\ddagger }={\frac {\ce {[C]^{\ddagger }}}{\ce {[A][B]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb54ef9dc837eff8cc17cec2f0c692d1bc13b4ae)






























