A-level 化学/OCR (Salters)/配合物
配合物是一种化合物,其中中心金属原子周围环绕着配体,配体与之形成配位共价键。在化学理念第11.6节中讨论了配合物:d区:配合物的形成。
您可能想看看光谱页面,以提醒自己光是如何以及为什么与分子中的电子相互作用。您也可以看看原子轨道页面,以了解d轨道的形状。
简而言之,过渡金属配合物有颜色是因为它们中心的过渡金属原子具有被周围配体分裂的部分填充的d亚层。部分填充表示至少一个d轨道是半填充或空的,并且至少一个d轨道是半填充或满的,即d亚层包含1到9个电子。分裂表示在d亚层内,现在存在不同的能级,而在没有配体的情况下,构成d亚层的五个d轨道都具有相同的能量。
为了考试的目的,Salters A-Level 化学的学生不需要理解配体如何以及为什么导致d亚层分裂,只需要知道它发生了。继续在大学学习化学的学生将更详细地学习金属原子和离子与配体之间的相互作用,他们将在那里遇到晶体场理论(配体对d轨道的静电效应)和配位场理论(配体与金属原子和离子的共价键合)。

一个配合物需要配体才能有颜色。在没有配体的情况下,所有五个d轨道在能量上是相等的(简并在这里经常用到的一个词——它只是意味着具有相同的能量)。当存在配体时,一些d轨道会变得比以前具有更高的能量,而另一些则变得更低。发生这种情况是因为一些d轨道比其他d轨道更靠近配体,因此它们受到配体电子的排斥更多,因此具有更高的能量。

一个有颜色的配合物需要部分填充的d轨道。空的d轨道不能产生颜色,因为它们缺少电子。需要电子通过吸收可见光光子从低能量d轨道跃迁到高能量d轨道。Sc3+的配合物是无色的,因为Sc3+(电子构型:[Ar]3s23d0)具有空的d轨道。
在元素周期表中位于Ti之前的元素都是如此——它们都没有电子在它们的d轨道中。例如,K有d轨道,但它们是空的,因此,K的配合物不能吸收光子,从而将一个d电子从d轨道激发到一个更高的能级,因为K没有任何d电子。

如果一个配合物具有空的d壳层,就没有电子可以移动。如果一个配合物具有满的d壳层,在任何d轨道中都没有空位可供电子移动。Zn2+和Cu+(电子构型:[Ar]3s23d10)的配合物是无色的,因为Zn2+和Cu+的d轨道是满的。
我们上面注意到,在过渡金属原子或离子周围存在配体会使五个d轨道分裂成两组,一组比配体到达之前具有更高的能量,而另一组则具有更低的能量。化学理念第271页提供了简短而甜蜜的解释,非常适合复习和考试。本节试图提供更深入的解释。它比Salters 高级化学规范要求的更详细,但这可能是您想要了解的内容,如果您有兴趣。
配体具有孤对电子,它们用来与过渡金属原子或离子键合。这些配体电子的存在排斥了过渡金属在其d轨道中的电子。金属d电子无处可去以避免排斥,因此唯一的影响是它们的能量增加。
配体对五个 d 轨道的影响程度不同。将电子带到靠近配体的 d 轨道会使其能量大幅上升。占据远离配体空间的 d 轨道也会使其能量上升,但幅度较小。正如您可能想象的那样,配体的具体位置决定了它们会对哪些 d 轨道产生最大的影响。

在八面体配合物中,dz² 和 dx²−y² 轨道的能量升高最为显著。我们称 dz² 和 dx²−y² 轨道为 eg d 轨道。
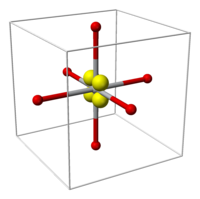
以下图片展示了 dz²(左)和 dx²−y²(右)轨道以及它们在八面体配合物中的位置。中心的过渡金属原子或离子为灰色,六个配体为红色,轨道为黄色。


让我们继续考虑八面体配合物。其余的 d 轨道,dxy、dxz 和 dyz,其能量上升幅度较小。我们称 dxy、dxz 和 dyz 轨道为 t2g d 轨道。
以下图片展示了这三个轨道在八面体配合物中相对于中心金属原子和配体的位置。将这些 t2g 轨道图片与上面的 eg 轨道图片进行比较。您可能会注意到,平均而言,t2g 轨道比 eg 轨道远离配体。这是造成分裂的原因。



在四面体配合物中,dxy、dxz 和 dyz 轨道的能量升高最为显著。我们称 dxy、dxz 和 dyz 轨道为 t2 d 轨道。
其余的 d 轨道,dz² 和 dx²−y²,其能量上升幅度较小。我们称 dz² 和 dx²−y² 轨道为 e d 轨道。
您应该了解 eg 和 t2g 的标记;它们是源自群论的数学结构。化学家后来借用了这些标记,因为它们指的是分子对称性,对于确定分子的行为、轨道分裂和性质非常有用。

![linear: diamminesilver(I), [Ag(NH3)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a6/Diamminesilver%28I%29-3D-balls.png/120px-Diamminesilver%28I%29-3D-balls.png)
![tetrahedral: tetrachloronickelate(II), [NiCl4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/Tetrachloronickelate%28II%29-3D-balls.png/120px-Tetrachloronickelate%28II%29-3D-balls.png)

![tetrahedral: tetrahydridoborate(III), [BH4]−](http://upload.wikimedia.org/wikipedia/commons/thumb/4/46/Borohydride-3D-balls.png/118px-Borohydride-3D-balls.png)
![tetrahedral: tetrahydroxozincate(II), [Zn(OH)4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c5/Tetrahydroxozincate%28II%29-3D-balls.png/120px-Tetrahydroxozincate%28II%29-3D-balls.png)
![square planar: tetraamminecopper(II), [Cu(NH3)4]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0d/Tetraamminecopper%28II%29-3D-balls.png/120px-Tetraamminecopper%28II%29-3D-balls.png)
![square planar: tetracyanonickelate(II), [Ni(CN)4]2−](http://upload.wikimedia.org/wikipedia/commons/thumb/f/ff/Tetracyanonickelate%28II%29-3D-balls.png/120px-Tetracyanonickelate%28II%29-3D-balls.png)

![octahedral: hexaaquacopper(II), [Cu(H2O)6]2+](http://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Hexaaquacopper%28II%29-3D-balls.png/102px-Hexaaquacopper%28II%29-3D-balls.png)
![octahedral: hexacyanoiron(III), [Fe(CN)6]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1a/Ferricyanide-3D-balls.png/103px-Ferricyanide-3D-balls.png)