生物化学/催化
<< 生物化学 | << 热力学 | 催化 | 代谢和能量 >>
催化是指由一种称为催化剂的物质加速化学反应速率的过程,催化剂本身在整个反应中保持不变。催化对于任何已知的生命形式都至关重要,因为它使化学反应比“自身”发生的速度快得多,有时快几百万倍。
一个常见的误解是催化“使反应发生”,即如果没有催化剂的存在,反应就不会进行。然而,催化剂不能使热力学上不利的反应进行。相反,它只能加速一个已经热力学上有利的反应。在没有催化剂的情况下,这种反应会进行,即使没有催化剂,尽管可能太慢而无法观察到或在给定的情况下有用。
催化剂通过提供反应物和产物之间能量较低的途径来加速化学反应。这通常涉及形成中间体,如果没有催化剂,该中间体就无法形成。这种中间体的形成和随后的反应通常具有比反应物直接反应生成产物所需的活化能垒低得多的活化能垒。
从工业的角度来看,催化是一个非常重要的过程,因为大多数工业上重要的化学品的生产都涉及催化。催化研究是应用科学中的一个主要领域,涉及化学和物理学的许多领域。
通常区分两种类型的催化。在均相催化中,反应物和催化剂处于同一相。例如,酸(H+离子供体)是许多水溶液反应中常见的催化剂。在这种情况下,反应物和催化剂都处于水相中。在多相催化中,催化剂与反应物和产物处于不同的相。通常,催化剂是固体,而反应物和产物是气体或液体。为了使反应发生,一种或多种反应物必须扩散到催化剂表面并吸附在催化剂表面。反应结束后,产物必须从表面解吸并扩散离开固体表面。通常,这种反应物和产物的从一相到另一相的传输在限制反应速率方面起着主导作用。了解这些传输现象是多相催化研究中的一个重要领域。
酶(来自希腊语,in ferment)是特殊的蛋白质分子,其功能是促进或加速细胞中的大多数化学反应。它们只是生物催化剂。大多数酶是蛋白质,尽管也有一些是称为核酶的催化 RNA 分子。许多化学反应发生在生物细胞内,但如果没有催化剂,它们中的大多数在试管中发生得太慢,无法在生物学上相关。
酶还可以用来将两个或多个反应耦合在一起,这样热力学上有利的反应就可以用来“驱动”热力学上不利的反应。最常见的例子之一是利用 ATP 去磷酸化来驱动一些本来无关的化学反应的酶。
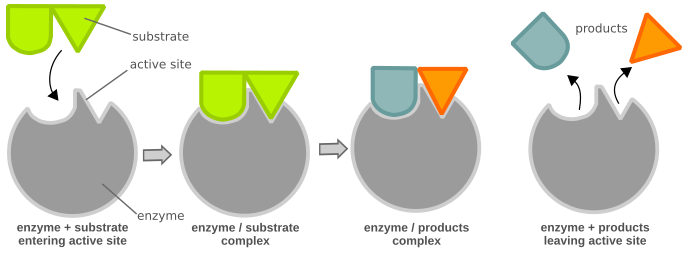
化学反应需要一定量的活化能才能发生。酶可以通过有利于或实现不同的反应路径来提高反应速度,这些路径具有较低的活化能(图 1),从而使反应更容易发生。酶是大型球状蛋白质,催化(加速)化学反应。它们对于细胞的功能至关重要。酶对它们催化的反应和参与反应的化学物质(底物)具有高度特异性。底物与其酶的配合就像钥匙与其锁的配合一样(图 2)。许多酶由几种一起作为一个单元起作用的蛋白质组成。酶的许多部分具有调节或结构目的。催化反应仅发生在酶的一个小部分称为活性位点,该位点由大约 2 到 20 个氨基酸组成。

底物(A 和 B)需要大量的能量(E1)才能达到中间状态A...B,然后反应形成最终产物(AB)。酶(E)创建一个微环境,使 A 和 B 更容易达到中间状态(A...E...B),从而降低所需的能量(E2)。因此,反应更有可能发生,从而提高反应速度。
酶每秒可以执行高达几百万次催化反应。为了确定酶促反应的最大速度,增加底物浓度,直到产物形成速率达到恒定(图 3)。这是酶的最大速度(Vmax)。在这种状态下,所有酶的活性位点都被底物饱和。这由 Leonor Michaelis 和 Maud Menten 在 1913 年提出。由于无法准确测量Vmax时的底物浓度,因此通过反应速率达到其最大值一半时的底物浓度来表征酶。这种底物浓度称为米氏常数(KM)。许多酶服从米氏动力学。
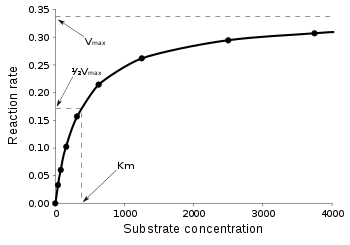
速度V表示每秒被酶催化的反应次数。随着底物浓度[S]的增加,酶渐近地接近其最大速度Vmax,但实际上永远不会达到它。因此,不能给出Vmax的[S]。相反,酶的特征值由底物浓度在其半最大速度(Vmax/2)时的底物浓度定义。这个 KM值也称为米氏常数。
几个因素可以影响酶的反应速度、催化活性以及特异性。除了从头合成(生产更多酶分子以提高催化速率)外,pH 或温度等性质可以使酶变性(改变其形状),使其不再发挥作用。通过酶的翻译后修饰(例如,磷酸化)或添加辅助因子(例如金属离子或有机分子(例如 NAD+、FAD、CoA 或维生素))可以实现更具体的调节,这些辅助因子与酶相互作用。别构酶由几个相互作用的亚基(蛋白质)组成,因此相互影响彼此的催化活性。酶也可以受到竞争性抑制剂(图 4)和非竞争性抑制剂和激活剂(图 5)的调节。抑制剂和激活剂通常用作药物,但它们也可能是毒药。

竞争性抑制剂与酶的配合与其实际底物一样好,有时甚至更好。抑制剂取代活性中心中的底物,但不能进行催化反应,从而抑制酶与底物分子的结合。一些抑制剂与酶形成共价键,使其永久失活(自杀性抑制剂)。就竞争性抑制剂的动力学而言,它会增加 Km,但不会改变 Vmax。

非竞争性抑制剂/激活剂(I)不与活性中心结合,而是与酶(E)的其他部分结合,这些部分可能距离底物(S)结合位点很远。通过改变酶(E)的构象(三维结构),它们会使酶(E)结合其底物(S)和催化所需反应的能力失效或启用。非竞争性抑制剂会降低 Vmax,但不会改变 Km。
非竞争性抑制剂只会与酶-底物复合物结合,形成酶-底物-抑制剂(ESI)复合物,并且无法通过额外的底物克服。由于 ESI 不反应,因此 Vmax 会有效降低。非竞争性抑制剂反过来会降低 Km,因为达到 ES 最大浓度一半所需的底物浓度较低。
几个酶可以按特定顺序协同工作,创建代谢途径(例如,柠檬酸循环,有氧生物细胞中的一系列酶促反应,在细胞呼吸中很重要)。在代谢途径中,一种酶将另一种酶的产物作为底物。在催化反应之后,产物然后被传递给另一种酶。这种途径的最终产物(s)通常是非竞争性抑制剂(图 5),用于该途径中的第一个酶之一(通常是第一个不可逆步骤,称为承诺步骤),从而调节该途径产生的最终产物量(图 6)。

- 基本的反馈抑制机制,其中产物(P)抑制承诺步骤(A⇀B)。
- 顺序反馈抑制。最终产物 P1 和 P2 抑制它们各自途径的第一个承诺步骤(C⇀D 或 C⇀F)。如果两种产物都大量存在,则来自 C 的所有途径都将被阻断。这会导致 C 的积累,进而抑制第一个共同的承诺步骤 A⇀B。
- 酶的多样性。每个最终产物都抑制第一个单独的承诺步骤和执行第一个共同的承诺步骤的酶之一。
- 协同反馈抑制。每个最终产物都抑制第一个单独的承诺步骤。它们一起抑制第一个共同的承诺步骤。
- 累积反馈抑制。每个最终产物都抑制第一个单独的承诺步骤。此外,每个最终产物部分地抑制第一个共同的承诺步骤。
酶对于生物体至关重要,即使我们体内大约 2,000 种酶中一种酶发生故障,也会导致严重或致命的疾病。人类中由酶功能障碍引起的疾病的一个例子是苯丙酮尿症 (PKU)。通常将必需氨基酸苯丙氨酸转化为酪氨酸的酶苯丙氨酸羟化酶不起作用,导致苯丙氨酸积聚,从而导致智力障碍。人体中的酶也会受到抑制剂的良好或不良影响。例如,阿司匹林抑制产生前列腺素(炎症信使)的酶,从而抑制疼痛。但并非所有酶都存在于生物体内。酶也被用于日常生活用品中,例如生物洗衣粉,在那里它们会加速化学反应(使您的衣服变干净)。
在上一节中,我们讨论了消化酶,包括人体产生的酶,如唾液淀粉酶,以及食物酶。它们的 primary role 是消化食物。另一类酶称为代谢酶。它们的作用是催化体内所有过程的化学反应,包括氧气的吸收。如果没有细胞色素氧化酶的作用,即使有充足的氧气,我们的细胞也会因缺氧而饿死。酶也是肌肉收缩和舒张所必需的。事实上,如果没有这两类酶(消化酶和代谢酶),生命将无法存在。消化酶作为生物催化剂,帮助分解碳水化合物、蛋白质和脂肪。另一方面,代谢酶作为细胞的重塑者。食物消化具有很高的优先级和对酶的需求;消化酶优先于代谢酶。代谢酶的任何缺乏都会导致过度工作,这会导致器官肿大以执行增加的工作量。结果是不健康的,可能会导致心脏或胰腺肿大。代谢酶的缺乏会对健康产生巨大的影响。随着年龄的增长,酶水平下降,人体效率下降。
按照惯例,酶的名称由其功能描述组成,以“-ase”结尾。例如,酒精脱氢酶和 DNA 聚合酶。激酶是转移磷酸基团的酶。国际生物化学与分子生物学联合会制定了酶的命名法,即 EC 编号;每种酶都由一个四位数字序列描述,前面加 “EC”。第一个数字根据酶的机制对酶进行广泛分类。
- EC 1 氧化还原酶:催化氧化/还原反应
- EC 2 转移酶:转移官能团(例如,甲基或磷酸基团)
- EC 3 水解酶:催化各种键的水解
- EC 4 裂解酶:通过除水解和氧化以外的其他方式裂解各种键
- EC 5 异构酶:催化单个分子内的异构化变化
- EC 6 连接酶:通过共价键连接两个分子
一些其他重要的酶包括:蛋白酶:在胃、胰液和肠液等高酸性环境中将蛋白质分解为氨基酸。作用于细菌、病毒和一些癌细胞。淀粉酶:将淀粉等复杂碳水化合物分解为更简单的糖(糊精和麦芽糖)。它存在于肠道、胰腺以及唾液腺中。脂肪酶:分解脂肪和一些脂溶性维生素(A、E、K 和 D)。有助于治疗心血管疾病。纤维素酶:分解存在于水果、谷物和蔬菜中的纤维素。它可以提高蔬菜和水果的营养价值。果胶酶:分解存在于柑橘类水果、胡萝卜、甜菜、番茄和苹果中的果胶。抗氧化剂:保护细胞免受自由基负面影响的损害。组织蛋白酶:分解动物蛋白。乳糖酶:分解存在于乳制品中的乳糖。乳糖酶的产生会随着年龄的增长而下降。转化酶:吸收蔗糖,如果没有正确消化,会导致消化压力。木瓜蛋白酶:分解蛋白质并帮助身体消化。菠萝蛋白酶:分解存在于植物和动物中的蛋白质。它可以帮助身体对抗癌症和治疗炎症。葡萄糖淀粉酶:将存在于所有谷物中的麦芽糖分解为两个葡萄糖分子。
