生物化学/代谢与能量
代谢(图 1)从广义上讲,是将食物转化为能量、细胞成分和废物的过程。
上图显示了代谢的不同部分
- 能量来源,这毕竟是太阳,其能量通过光合作用被收集
- 分解代谢,将食物分解成化学能量,这是在
- 合成代谢中所需要的,合成代谢利用化学能量,从小的环境分子构建复杂的细胞分子
分解代谢反应释放能量,因此是放能反应,而合成代谢反应消耗能量,因此是吸能反应.
由于食物化合物种类繁多,合成代谢中需要能量的生化反应也很多,因此将特定的合成代谢反应与分解代谢中的特定能量来源耦合效率会很低。相反,细胞使用一种中间化合物,一种通用的能量货币。这种中间体被称为高能磷酸盐。
但是,什么时候磷酸基团被称为“高能”,它与“低能”磷酸基团有何区别?一个关键因素是水解的 ΔG0'。水解通过添加水将磷酸基团从化合物中分离出来
O O R-OP-OH + H2O ⇌ R-OH + HO-P-OH O O
低能(或“无机”)磷酸基团(称为 Pi)的 ΔG0' 为 9-20 kJ mol-1,而高能磷酸基团(表示为 Ⓟ)的 ΔG0' 约为 30 kJ mol-1。
那么是什么让这个 Ⓟ 如此特殊呢?为了解释这一点,我们必须稍微介绍一下 pH 和 pKa 值。磷酸基团有 0 到 3 个OH基团。这使得 Ⓟ 可以存在于最多四种不同的形式(0、1、2 和 3 个OH基团,图 2),具体取决于周围溶液的 pH 值。pKa 值告诉我们 50% 的分子处于一种形式(例如,1 个OH基团)和另一种形式(例如,2 个OH基团)时的 pH 值。这由亨德森-哈塞尔巴尔赫方程表示

图 2:磷酸基团的四种可能形式。pKa2 代表细胞中的条件。
现在我们来说说 Ⓟ 和 PPi 之间的区别。ROⓅ 的酯键断裂比 PPi 键断裂释放的能量更多(图 3),因为
- 静电排斥 PPi 中的两个磷酸基团
- 共振稳定 两个 Pi 基团,与 PPi 相比(图 4)
共振稳定意味着两者OH和=O可以在磷酸盐周围“移动”。当然,这只是一个粗略的类比;它们实际上并没有移动,只是电子在磷酸原子周围“扩散”。这也用 ↔ 箭头而不是 ⇌ 来表示;这三种形式不存在,它们只是用来表示化学现实的一种方式。
如您在图 3 中看到的,PPi⇌2Pi 的 ΔG0' 值 ≪0,使反应强烈地有利于 2Pi。
在下图中,最终产物不应该有碳-碳双键,而应该有一个单键,顶部有 CH3。这是一个错误。水解 : ΔG0' = -61.9 kJ mol-1
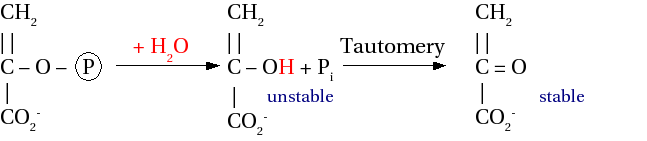
三磷酸腺苷含有一个低能磷酸键和两个高能磷酸键

低能 : ΔG0' = -14,2 kJ mol-1
高能 : ΔG0' = -30.5 kJ mol-1
- ATP 由 ADP(二磷酸腺苷)、Pi 和能量(来自食物)再生;在此过程中会释放 H2O。
- ATP 是细胞的短期能量“货币”。
- 细胞中的 ATP 浓度很低(ATP:2-8mM;ADP:0,2-0,8mM)。ATP 的生成量很高。
- ATP 通过偶联反应发挥其化学作用。
- 偶联反应始终是 Ⓟ 转移,而不是直接水解
基本上,任何由 ATP 驱动的反应都是可逆的,在此过程中,从 ADP 和 Pi 生成 ATP。然而,某些由 ATP 驱动的反应不应该被逆转;这些包括核苷酸和蛋白质合成。如果这些反应被逆转,生物体就会将其自身的 DNA 和蛋白质分解成能量,这是一种相当不幸的策略。对于不应该被逆转的反应,ATP 可以分解成 AMP(单磷酸腺苷)和 PPi,而 PPi 则转化为 2×Pi。该反应的 ΔG0' 为 -65,7 kJ mol-1,在体内条件下是完全不可逆的。
需要注意的是,AMP 不能直接转化回 ATP。相反,AMP 激酶酶从一个 ATP 和一个 AMP 分子生成两个 ADP 分子。然后对生成的 ADP 进行上述处理。
共价键的断裂需要大量的能量。一个 O2 分子分解成两个氧原子需要约 460 kJ mol-1 的能量。因此,在“活体”生物化学中,共价键实际上不会被破坏;如果一个键被破坏,另一个键就会被形成。这就是非共价键的作用,它们足够弱,可以很容易被破坏,并再次形成“键”。因此,许多生化功能都利用了所谓的弱/次级/非共价键。
弱键比共价键更容易形成和破坏。破坏这种弱键所需的典型能量范围为 4-30 kJ mol-1。因此,弱键的形成在能量上是有利的,但这些键也容易被动能(热能)(分子的正常运动)破坏。生化相互作用通常是暂时的(例如,底物在被处理后必须迅速离开酶),弱键的弱性对于这一点至关重要。此外,生化特异性(例如,酶-底物识别)是通过弱键实现的,利用了它们的两个主要性质。
- 由于单个弱键,嗯,很弱,因此它们中的几个必须在相同时间、大致相同的位置以特定的模式出现。
- 弱键的短程。
下面的链接演示了非共价力的类型:[1] 存在三种基本类型的弱键,以及第四种“伪键”。
离子键
[edit | edit source]离子键是永久带电基团之间的静电吸引力。离子键是无方向的。例如
- X-CO2- ..... H3+N-Y
- ~ 20 kJ mol-1
氢键
[edit | edit source]氢键也是由静电吸引力形成的。这些吸引力不是发生在永久带电基团之间,而是发生在由偶极矩暂时带电的原子之间,偶极矩是由基团内原子的不同电负性引起的。氢键比离子键更弱,它们具有很强的方向性,通常沿着一条直线。除了比离子键更弱之外,氢键也比类似的共价键更弱、更长。氢键是独一无二的,因为它们只存在于氢与氧 (O)、氮 (N) 或氟 (F) 键合时,但在生物化学中,最常见的氢键是
- X-OH ..... O-Y
- X-OH ..... N-Y
- X-NH ..... O-Y
- X-NH ..... N-Y
氢键的能量约为 12-29 kJ mol,而共价键的能量要高得多。例如,氧和氢之间的共价键约为 492 KJ mol-1。
氢键和水
[edit | edit source]水具有独特的性质;毕竟,它被选为通用溶剂。水的独特性质是由于所有含量的氧和氢原子之间的氢键作用。水中发生的氢键彼此之间相距约 2 埃。尽管氢键只有共价键强度的约 5%,但它们仍然使水具有较高的沸点和较高的表面张力。以下链接将带您了解水的结构及其氢键作用。
范德华力
[edit | edit source]范德华力是在电子密度诱导的偶极之间建立的。当两个原子的外层电子壳几乎(但不是完全)接触时,它们就会形成。原子之间的距离对于这些弱相互作用非常重要。如果原子相距太远,相互作用太弱而无法建立;如果原子彼此过于接近,它们的电子壳会相互排斥。范德华力是高度非特异性的;它们几乎可以在任何两个原子之间发生。它们的能量在 4-8 kJ mol-1 之间。
疏水相互作用
[edit | edit source]疏水力实际上不是键,因此此列表中有四项,但仍然只有三种键类型。在某种程度上,疏水力是对极性溶质(通常是水)包裹非极性分子的氢键的否定。对于像水这样的极性溶质来说,“浪费”一个可能的氢键将其暴露在非极性分子中在能量上是不利的。因此,水会以一种不向该分子指向任何氢键的方式排列在任何非极性分子周围。这导致与“自由”移动的水相比,更高的秩序,这导致熵水平降低,因此在能量上是不利的。如果溶质中存在多个非极性分子,则非极性分子聚集在一个地方是有利的,从而将它们周围的有序“壳”水减少到最小的表面积。此外,在蛋白质等大型分子中,分子的疏水(非极性)部分将倾向于转向内部,而极性部分将倾向于转向分子的表面。
参考文献
[edit | edit source]Cooke, Rosa-lee. 水的性质。第 10 讲。山区帝国社区学院。n.d. 网络。 http://water.me.vccs.edu/courses/env211/lesson10_print.htm
Kimball, John W.. 氢键。Kimball 生物学页面。2011 年 2 月 12 日。网络。 http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/H/Hbonds_water.gif
Lower, Stephen. 物质状态:水和氢键。普通化学虚拟教科书。2009 年。2010 年 8 月 26 日。网络。 http://www.chem1.com/acad/webtext/states/water.html
n.p. 共价键与非共价键。n.d. http://www.pearsonhighered.com/mathews/ch02/c02cv.htm
W. W. Norton & Company. 水中的氢键。网络。2012 年。 http://www.wwnorton.com/college/chemistry/gilbert2/tutorials/chapter_10/water_h_bond/
WyzAnt 家教。WyzAnt 家教。债券。2012 年。网络。 http://www.wyzant.com/Help/Science/Chemistry/Bonds/


![{\displaystyle {pH}={pK}_{a}+log{[base] \over [acid]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c76e01f52dd2a8970a93ded61f409e95ebe9726a)



