生物医学工程理论与实践/生物电现象
'另请参见 维基百科,电生理学.
电生理学是生物医学工程的一个分支,它涉及研究体内的电活动。电生理学包括研究电活动的产生及其对身体的影响。它涉及在不同系统中使用电极测量电压变化或电流流动,从单个离子通道蛋白到单个神经元(特别是动作电位)以及整个组织,如心脏。

我们的身体是电中性的,但我们的体细胞被一层由磷脂双层组成的膜包围,蛋白质嵌入其中。膜起着绝缘体和对离子运动的扩散屏障的作用。离子转运蛋白/泵蛋白将离子推过膜,以在膜两侧获得浓度梯度,而离子通道允许离子沿着这些浓度梯度穿过膜。离子泵和离子通道在电学上与膜中的一组电池和电阻相同。在膜内和膜外,一种电荷可能占主导地位。相反的电荷试图吸引,并且必须使用能量来将它们分开。相反,当相反的电荷聚集在一起时,会释放能量。因此,分离的电荷具有势能。
在电活性组织中,可以通过将电极插入两个点来测量电压,例如一个在细胞内部,另一个在细胞外部,它被称为电位差或电势差。电压是指驱动电流跨电阻的能力。从一个点到另一个点的电荷流动称为电流。在两点之间移动的电荷量取决于电压和电阻(阻碍电荷流动)。因此,电压的最简单定义由**欧姆定律**给出
其中 I 是流经导体的电流,单位为安培,V 是跨导体测量的电位差,单位为伏特,R 是导体的电阻,单位为**欧姆**。电流与电压成正比(电压越高,电流越大),与电阻成反比(电阻越大,电流越小)。
在体内,电流对应于离子穿过细胞膜的流动,任何电阻都由膜本身提供。各种离子通道出现在质膜中,并分为被动通道和主动通道
- 被动(泄漏)通道始终处于打开状态
- 主动(门控)通道由一个或多个蛋白质组成,这些蛋白质能够发生变化以打开或关闭
- 化学门控通道
- 电压依赖性通道
- 其他门控通道
离子沿着化学梯度(由于扩散)和沿着电梯度(向相反的电荷移动)移动;因此离子沿着电化学梯度流动。
在非兴奋性细胞中,以及在兴奋性细胞的基线状态下,膜电位具有相对稳定的值,称为静息电位。离子通道的打开和关闭会导致偏离静息电位。如果内部电压移动到更正的膜电位,这被称为**去极化**,如果内部电压变得更负,这被称为**超极化**。在兴奋性细胞中,足够大的去极化会导致动作电位,其中膜电位在短时间内(约 1 到 100 毫秒)迅速且明显地发生变化,通常使其极性反转。
膜电位变化(特别是如果由配体门控通道的激活引起)也被定义为以下两种情况之一
- **兴奋性**:膜去极化
- **抑制性**:膜超极化

膜转运是指颗粒(溶质)穿过或通过膜屏障的运动[1] 在细胞中,这些膜屏障由磷脂双层组成。磷脂会自动排列,使亲水(极性)头部最靠近细胞外和细胞内介质,而疏水(非极性)尾部像水中的肥皂原理一样排列在两个亲水头部基团之间。
膜转运取决于膜的渗透性、跨膜溶质浓度以及溶质的大小和电荷。 [1]溶质颗粒可以通过三种机制穿过膜:被动转运、协助转运和主动转运。其中一些转运机制需要能量输入和跨膜蛋白的使用,而其他机制则不接受次级分子。 [2]
被动运输依赖于浓度梯度、疏水性、溶质的大小和电荷。在被动运输中,小的非带电溶质颗粒通过膜扩散,直到膜的两侧达到浓度相似的平衡状态。 [3]
菲克第一定律可以用来描述分子跨膜的被动运输。
其中
- 是“扩散通量” [(物质量)每单位面积每单位时间],例如 .
- 是扩散系数或扩散率,其维度为 [长度2 时间−1],例如
- (对于理想混合物)是浓度,其维度为 [物质量每单位体积],例如
- 是位置 [长度],例如
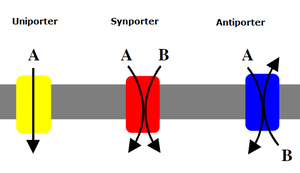
协助扩散是一种由嵌入细胞膜中的转运蛋白介导的被动运输。 [4]
主动运输是指粒子通过转运蛋白从低浓度到高浓度移动,以消耗代谢能量。 [4]
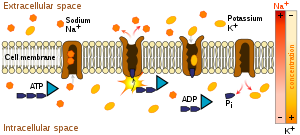
初级主动运输直接利用代谢能量将分子跨膜运输。大多数执行此类运输的酶是跨膜ATP酶。根据转运机制以及遗传和结构同源性,这些ATP依赖性离子泵可以分为四种类型:[5]
- P型ATP酶:钠钾泵、钙泵、质子泵
- F型ATP酶:线粒体ATP合酶、叶绿体ATP合酶
- V型ATP酶:液泡ATP酶
- ABC(ATP结合盒)转运蛋白:MDR、CFTR等。
P型、F型和V型只转运离子,而ABC超家族也转运小分子。
次级主动运输被称为耦合转运或协同转运,因为能量被用来将分子跨膜运输;然而,与初级主动运输相比,没有直接的ATP耦合;相反,通过将离子泵出细胞形成的电化学势能差被利用。 [6]
1960年8月,罗伯特·K·克莱恩在布拉格首次提出了他关于肠道葡萄糖吸收的协同转运机制。 [7] 协同转运体可以分为同向转运体和反向转运体,这取决于物质是朝着相同方向还是相反方向移动。
- 协同转运蛋白:两种分子通过膜向同一方向转运。
- 反向转运蛋白:两种离子或其他溶质通过膜向相反方向转运。

离子通道是形成孔隙的膜蛋白,其功能是建立静息膜电位,通过控制离子跨细胞膜的流动来塑造动作电位和其他电信号,控制分泌和上皮细胞中离子的流动,并调节细胞体积。[8] [9] 常见的离子通道实验室技术包括电压钳位技术和膜片钳技术。
离子通道不同于其他离子转运蛋白:[10]
- 离子通过通道的转运速率非常高(通常每秒 106 个离子或以上)。
- 离子通过通道沿其电化学梯度移动,该梯度是离子浓度和膜电位的函数,“下坡”移动,无需代谢能(例如三磷酸腺苷、主动转运机制、协同转运机制)。
离子通道位于超过 300 种细胞的质膜和许多细胞器中。它们通常被描述为狭窄、充满水的通道,只接受特定类型的离子。这种特性称为选择性通透性。离子通道是跨膜蛋白,由多个蛋白组装而成。这种“多亚基”组装通常会形成一个圆形排列,由相同或同源蛋白紧密排列在脂质双层膜平面上的一个充满水的孔周围。[11][12] 。
离子通道在内质网的膜中合成和插入。它们在高尔基体中被糖基化,并通过膜融合被转运并插入靶膜。它们受磷酸化、转运、泛素化、与其他信号蛋白和第二信使的可逆相互作用、蛋白水解切割和其他修饰的控制。离子通道与导致细胞快速变化的各种生物过程有关,例如肌肉收缩、上皮细胞的营养物质和离子转运、T 细胞活化和胰腺 β 细胞胰岛素释放。离子通道是寻找新药的常见目标。[13][14][15]
电压门控离子通道是蛋白质通道,它们可以响应细胞膜跨膜电位的变化而打开或关闭。它们在可兴奋的神经和肌肉组织中发挥重要作用,导致响应触发电压变化的快速协调去极化。它们通常由几个亚基蛋白组成,这些亚基蛋白根据其电化学梯度形成一个孔。

示例包括
- 神经和肌肉的钠和钾电压门控通道。
- 在突触前神经末梢中起神经递质释放作用的电压门控钙通道。
- 吞噬细胞在“呼吸爆发”期间的电压门控质子通道。
钠和钾电压门控通道中的过程如下
- 细胞内部的去极化会导致蛋白质通道移动,诱导构象变化,从而使离子能够通过通道流动(打开状态)。
- Na+ 离子大量涌入细胞(沿其浓度梯度)。
- 延迟整流器打开,Na+ V 门控通道失活。
- K+ 离子大量涌出细胞(沿其浓度梯度)。
- Na+/K+ 泵利用 ATP 恢复浓度梯度。

配体门控离子通道是蛋白质通道,它们会打开以接受离子(如 Na+、K+、Ca2+ 或 Cl-)通过膜,以响应配体[17]、神经递质等化学信使的结合。[18] 这些蛋白质通常至少包含两个结构域:一个跨膜结构域,包括离子孔,以及一个细胞外结构域,包括配体结合位点。[19]。LGIC 被分为三个超家族:半胱氨酸环通道、离子型谷氨酸通道和嘌呤受体通道。它们通常是五聚体,每个亚基包括构成跨膜结构域的 4 个跨膜螺旋,以及 β 折叠三明治型细胞外 N 末端配体结合结构域。[20] 半胱氨酸环通道与化学信使结合,例如乙酰胆碱(ACh)、甘氨酸(gly)、γ-氨基丁酸(GABA)或血清素(5-HT)。离子型谷氨酸受体(gluR)是同源亚基的四聚体,形成一个与电压门控超家族非常相似的中心孔,但在膜中的拓扑方向相反。嘌呤受体通道(P2XR)被细胞外核苷酸(如 ATP)打开。
一般来说,G 蛋白门控离子通道是位于细胞质膜中的特定离子通道,这些通道被相关蛋白直接激活。G 蛋白也称为鸟苷酸结合蛋白,是三个亚基的异三聚体:α-、β- 和 γ- 亚基。α-亚基 (Gα) 通常将 G 蛋白结合到 G 蛋白偶联受体。这种受体蛋白有一个大的细胞外结合结构域,它会结合其各自的配体,例如神经递质和激素。一旦配体与其受体结合,就会发生构象变化。G 蛋白中的这种构象变化导致 Gα 结合 GTP。这使得 G 蛋白发生另一种构象变化,导致 βγ-复合体 (Gβγ) 与 Gα 分离。[21] 此时,Gα 和 Gβγ 都处于活跃状态,可以继续信号转导途径。G 蛋白门控离子通道主要存在于中枢神经系统神经元和心房肌细胞中,并影响钾 (K+)、钙 (Ca2+)、钠 (Na+) 和氯 (Cl-) 跨质膜的流动。[22]

离子等带电粒子在半透膜附近有时不能均匀分布在膜的两侧。[23] 通常,这是因为不同的带电物质无法穿过膜,从而产生不均匀的电荷。[24] 例如,血浆中的大阴离子蛋白不能渗透到毛细血管壁。由于小阳离子被吸引,但没有与蛋白质结合,因此小阴离子将比小阳离子更容易地穿过毛细血管壁远离阴离子蛋白。
能斯特方程用于计算带电荷为 z 的离子跨膜的电位。该电位使用细胞内外离子的浓度来确定。
对于一价阳离子,z= 1

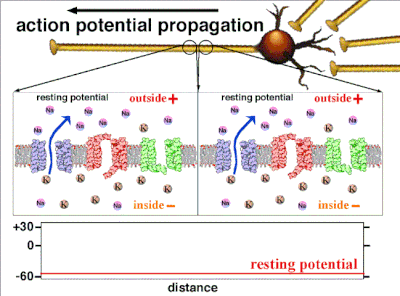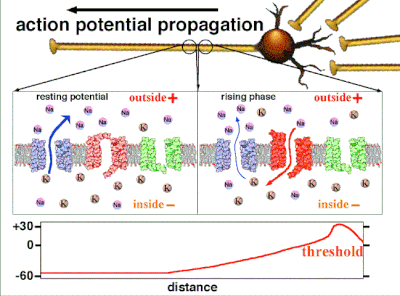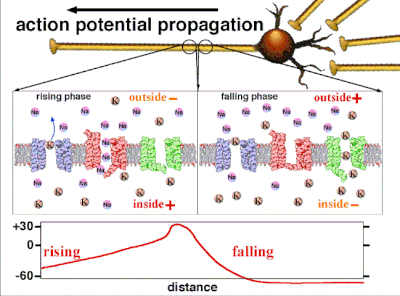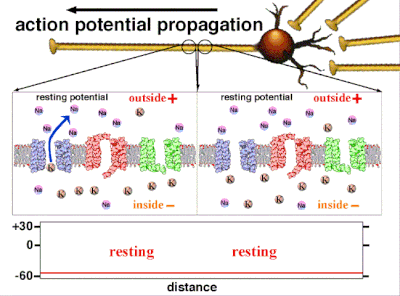
细胞内存在的不参与电活动的负电荷,就是静息电位。[25] 由于钾离子也是平衡电位最负的离子,通常静息电位不会比钾离子平衡电位更负。所有细胞,包括神经元,都有静息电位。但在神经元和肌肉纤维中,静息电位非常重要,因为所有电活动都是从这个静息电位变化而来的。静息电位可以用戈德曼-霍奇金-卡茨电压方程来计算,该方程使用离子的浓度来计算平衡电位,包括每个离子种类的相对通透性或电导。
戈德曼-霍奇金-卡茨电压方程适用于 一价正离子种和 负离子
如果我们考虑将两个 溶液隔开的膜,则会导致以下结果
- = 膜电位(以伏特表示,相当于每库仑的焦耳)
- = 该离子的渗透性(以米每秒表示)
- = 该离子的细胞外浓度(以摩尔每立方米表示,与其他SI单位相匹配)
- = 该离子的细胞内浓度(以摩尔每立方米表示)
- = 理想气体常数(每开尔文每摩尔的焦耳)
- = 开尔文温度
- = 法拉第常数(每摩尔的库仑)
梯度电位
[edit | edit source]梯度电位是膜电位变化,是由配体门控离子通道蛋白个体作用的总和引起的,并且随着时间和空间而减小。它们通常不涉及电压门控钠和钾通道。[26]

梯度电位主要有三种类型
- 感受器电位是感觉感受器的跨膜电位差。[27] 它们是由转导过程(将能量刺激转化为电势)产生的。它们可能是由机械门控通道或配体门控通道的打开引起的。
- 突触后电位是神经元化学突触的突触后末端的膜电位变化。突触后电位是梯度电位,不应与动作电位混淆,尽管它们会引发或抑制动作电位[28]。它们是由配体门控通道的激活引起的。去极化称为兴奋性突触后电位(EPSP)。超极化称为抑制性突触后电位(IPSP)。突触后电位的离子基础被认为是神经传递。
- 终板电位是运动终板的化学诱导的电位变化,运动终板是肌肉细胞膜的一部分,位于神经肌肉接头处神经纤维末端的对面。[29]。它们是由配体门控通道的激活引起的。
动作电位
[edit | edit source]
在生理学中,动作电位是指兴奋细胞(如神经细胞(神经元)、肌肉细胞、内分泌细胞等)膜电位在短时间内(约千分之一秒)的逆转。[30]。在神经元中,动作电位发生在神经元将信息从胞体传送到轴突时。在其他类型的细胞中,它们激活细胞内过程。例如,在肌肉细胞中,动作电位产生所有运动所需的收缩。在胰腺的β细胞中,它们诱导胰岛素的释放。[31]神经元中的动作电位也被称为“神经冲动”或“尖峰”,神经元产生的动作电位的时间序列被称为“尖峰序列”。一个发射动作电位的“神经元”通常被称为“放电”[32]。
动作电位是由嵌入细胞质膜中的特定电压门控离子通道产生的。[33] 当膜电位接近细胞的静息电位时,这些通道是关闭的,但神经递质或感觉受体细胞对细胞的刺激会部分打开膜中通道形状的蛋白质分子。钠离子扩散到细胞中,使该部分膜的极化方向更靠近负极。如果这种局部电位达到称为阈电位的临界状态(约为 -60 mV),则钠通道将完全打开。钠离子迅速涌入细胞,使细胞迅速去极化,形成约 +55 mV 的动作电位。动作电位的下降阶段是由于钠通道关闭和钾通道打开,钾通道使细胞以钾离子形式释放的电荷量大约等于细胞离开的阶段。因此,蛋白质转运分子将钠离子泵出细胞,并将钾离子泵入细胞。这恢复了原始的离子浓度,膜准备迎接新的动作电位。
生物磁学
[edit | edit source]生物磁学是生物体产生的磁场现象;它是生物电磁学的子集。它研究生物组织中出现的电、电磁和磁现象。[34]。
麦克斯韦方程
[edit | edit source]麦克斯韦方程描述了电荷和电流如何产生电场和磁场。因此,当存在生物电场时,也总是存在生物磁场,反之亦然(麦克斯韦,1865)。
| 名称 | 微分方程 | 积分形式 |
|---|---|---|
| 高斯电定律 | ||
| 高斯磁定律 (磁单极子的不存在) |
||
| 法拉第电磁感应定律 (麦克斯韦-法拉第方程) |
||
| 安培定律 (麦克斯韦修正) |
其中
- 是电场(伏特每米)。
- 是磁场强度(安培每米)。
- 是电位移场(库仑每平方米)。
- 是磁通密度,也称为磁感应强度(特斯拉,或韦伯每平方米)。
- 是自由电荷密度。它不包括材料中束缚的偶极电荷。(库仑每立方米)。
- 是自由电流密度。它不包括材料中束缚的极化或磁化电流。(安培每平方米)。
- 是表面积A的微分向量元素,具有非常小的幅度和垂直于表面S的方向(平方米)。
- 是由表面S包围的体积V的微分元素(立方米)。
- 是路径长度的微分向量元素,该元素与包围表面c的轮廓C相切(米)。
- 是上面定义的线元素的瞬时速度(用于移动电路)(米每秒)。
- 是散度算子(SI 单位:每米 1),
- 是旋度算子(SI 单位:每米 1)。
表. 场的测量[34]
| 生物电 | 生物电磁学(生物磁学) | 生物磁学 |
|---|---|---|
| 神经细胞 | ||
| 脑电图 (EEG) | 脑磁图 (MEG) | |
| 神经电图 (ENG) | 神经磁图 (MNG) | |
| 视网膜电图 (ERG) | 视网膜磁图 (MRG) | |
| 肌肉细胞 | ||
| 心电图 (ECG) | 心磁图 (MCG) | |
| 肌电图 (EMG) | 肌磁图 (MMG) | |
| 其他组织 | ||
| 眼电图 (EOG) | 眼磁图 (MOG) | |
| 眼震电图 (ENG) | 眼震磁图 (MNG) | |
| 肺磁图 | ||
| 肝磁图 |
体积导体模型是心磁图 (MCG)、心电图 (ECG)、脑电图 (EEG) 和脑磁图 (MEG) 中源分析的基础。生物电磁学中的体积传导,可以定义为电场或磁场从电初级电流源通过生物组织向测量传感器传输。体积导体是指连续的导电介质。大脑、脑膜、颅骨和头皮构成了一个体积导体,通过该导体可以测量离子流动产生的电流。

例如,在心电图 (ECG) 中,可以在体表放置电极并测量心脏电位,因为身体充当心脏电流的导体。在静息极化状态下,正极和负极电极之间不存在电位差(即等电位 - 平坦的红线)。在心室内部,当组织的左侧发生去极化(表示 SA 节的放电)时,去极化波开始在心室中扩散。在此期间,某些部分在外部暂时保持为正(极化),而某些部分为负(去极化);因此,电荷分离会在两个电极之间产生电位差。当去极化波向正电极移动时,按照惯例,会记录正电压(向上偏转)。当一半的部分去极化时,电压达到其最大正值。一旦整个心室质量去极化(所有细胞在外部为负),就不再存在电位差,电压与极化状态相同。当复极化发生时,首先从左侧开始(SA 节区域),然后穿过心室,心室表面将再次出现正负电荷,但这一次,负电荷将最靠近正电极。复极化波横扫心室,远离负电极并朝向正电极,按照惯例,会导致负电压(心室向上偏转,根据部分不同)。最后,当所有细胞都复极化时,测量的电压差将再次与初始阶段相同,直到出现另一波去极化。

人体被认为是一个电阻性的、分段均匀的和线性的体积导体。大多数组织是各向同性的。然而,肌肉是强各向异性的,脑组织也是各向异性的。
各种组织的电阻率
| 组织 | 电阻率 () | 参考 |
|---|---|---|
| 膀胱 | 4.41 | Matthew Christensen,2010[35] |
| 血液 | 1.6 | Geddes 和 Sadler,1973[36] |
| 骨骼 | 12400 | Matthew Christensen,2010[35] |
| 骨骼 | 25 | Geddes 和 Sadler,1973[36] |
| 骨骼(纵向) | 177 | Rush 和 Driscoll,1969[37] |
| 骨骼(周向) | 15 | Saha 和 Williams,1992[37] |
| 大脑(灰质) | 2.2 | Rush 和 Driscoll,1969[37] |
| 大脑(白质) | 6.8 | Barber 和 Brown,1984[38] |
| 大脑(平均) | 5.8 | Barber 和 Brown,1984[38] |
| 乳房 | 3.39 | Matthew Christensen,2010[35] |
| 脂肪 | 21.7 | Rush、Abildskov 和 McFee,1963[39] |
| 心脏 | 1.75 | Matthew Christensen,2010[35] |
| 肾脏 | 2.11 | Matthew Christensen,2010[35] |
| 肝脏 | 3.42 | Matthew Christensen,2010[35] |
| 肺部 | 1.57 | Matthew Christensen,2010[35] |
| 心肌(纵向) | 2.5 | Rush、Abildskov 和 McFee,1963 [39] |
| 心肌(横向) | 5.6 | Rush、Abildskov 和 McFee,1963 [39] |
| 骨骼肌(纵向) | 1.9 | Epstein 和 Foster,1982[40] |
| 骨骼肌(横向) | 13.2 | Epstein 和 Foster,1982[40] |
主要类型的电极是
- 简单的固体导体,例如导电圆盘和针头(单针或阵列,通常除针尖外都绝缘),
- 印刷电路板上的导电图案,除针尖外也绝缘,以及
- 充满电解质的空心管,例如充满氯化钾溶液或其他电解质溶液的玻璃吸管,用于细胞外或细胞内记录。
主要样品制备包括
- 活生物体,
- 切除组织(急性或培养),
- 从切除组织中分离的细胞(急性或培养),
- 人工培养的细胞或组织,或
- 上述混合物。

光学电生理技术的发明是为了克服经典技术的局限性。在经典技术中,只能在一定体积的组织内大约一个点观察电活动。经典技术需要对分布式现象进行单点化。人们对生物电活动的时空分布的兴趣促使人们开发了能够响应其电或化学环境而发出光的分子。例如,电压敏感染料和荧光蛋白。
通过灌注、注射或基因表达方式施用一种或多种此类化合物,可以观察和记录电活动分布。根据光学仪器和计算机软件的发展,三维分子水平的实验成为可能。
通过电压钳位技术,可以了解动作电位在轴突上传播时随电压和时间变化的机制。实验者将细胞电位“钳位”在选定的值上。换句话说,就是测量在任何给定的电压下,有多少离子电流穿过细胞膜。这很重要,因为神经元膜上的许多离子通道是电压门控离子通道,只有当膜电压在一定范围内时才会打开。从这些实验中获得的数据通过动作电位的数学重建得到了验证。 [41]


膜片钳技术是电压钳位技术的一种专门版本。膜片钳微电极是一种开口端直径相对较大(直径约为一微米)、表面抛光而不是尖锐的微电极。 [42] [43]
该膜片微电极压在细胞表面,并通过微电极施加轻微的吸力,将一小块细胞膜(“膜片”)吸入其尖端。吸力使微电极与细胞膜形成一个紧密的密封,电阻达到几十吉欧姆。这种结构被称为“细胞连接”模式,对于研究膜片中离子通道的活动非常有用。
有多种膜片钳结构,用于不同的实验观察。如果施加更大的吸力,电极尖端的少量膜片可能会被移除,使电极密封到细胞的其余部分。这种“全细胞”模式提供了非常稳定的细胞内记录。缺点是,由于细胞的细胞内液与记录电极内的溶液混合,因此一些细胞内液成分可能会被稀释。
“穿孔膜片”技术试图将这些问题降到最低。它不是使用吸力,而是使用膜片上的小孔,并加入少量抗真菌或抗生素药物,如两性霉素 B、制霉菌素或短杆菌肽。当抗生素分子扩散到膜片中时,它们会在膜上形成小孔,使离子能够自由地穿过这些孔。问题是,它需要很长时间才能让抗生素扩散到细胞中。而且电阻可能更高,膜片可能会被抗生素破坏。
这项技术是由埃尔温·内尔和伯特·萨克曼开发的,他们获得了 1991 年的诺贝尔奖。[44]
直到 20 世纪 70 年代后期,使用两个微电极来控制神经和肌肉细胞中的电压已成为测量膜电流的一种成熟方法。但是,双电极电压钳位技术在两个应用领域遇到了局限性。首先,当第二个电极穿透小细胞时,会导致损伤。其次,在体内制备中,细胞通常是看不见的。如果电压钳位用单个电极实现,这两个问题都可以解决。[45]
单电极电压钳位是一种特殊的电路钳位装置,其中单个微电极用于测量膜电压,并传递控制电压水平所需的电流。快速的电子开关将微电极的连接在这两种功能之间进行切换。
自 1990 年以来,平面膜片钳系统开始在研究实验室和公司中取代人工膜片钳。 [46]在传统的膜片钳技术中,膜片微电极使用显微操作器在光学控制下移动到细胞上。微电极与细胞之间的相对运动应避免,以保持细胞-微电极连接的完整性。在平面膜片结构中,细胞通过吸力放置 - 细胞和孔之间的相对运动可以在密封后排除。不需要防振台。芯片通常由硅、玻璃、PDMS、聚酰亚胺制成。自动化膜片钳系统通常更复杂,也更昂贵,但具有并行和免手动操作的优势,包括在短时间内获得大量数据。
- ↑ a b Reginald H. Garrett;Charles M. Grisham (2008). Biochemistry. Boston: Brooks Cole; 4th Ed. ISBN 10- 0495109355.
{{cite book}}: Check|isbn=value: length (help)CS1 maint: multiple names: authors list (link) - ↑ Stein, W. D. (1967). 细胞膜分子运动. 纽约: 学术出版社.
{{cite book}}: 检查日期值:|year=(帮助) - ↑ Mathews C. K.; Van Holde, K.E; Ahern, K.G (2003). 生物化学 (第 3 版). ISBN 84-7829-053-2.
- ↑ a b Cusslera, E.; Arisa, R.; Bhown, A. (1989). "关于促进扩散的限制". 膜科学杂志. 2–3: 149–164.
{{cite journal}}: 忽略文本“DOI:10.1016/S0376-7388(00)85094-2” (帮助)CS1 maint: 多个名称:作者列表 (链接) 无效的<ref>标记;名称“tm4”定义了多次,但内容不同 - ↑ Guyton, Arthur C.; Hall, John E. (2006). "医学生理学教科书", Elsevier.
- ↑ Physiologyweb,讲义笔记
- ↑ Crane, Robert K.; Miller, D.; Bihler, I. (1961). "肠道糖类运输可能机制的限制". 在 Kleinzeller, A.; Kotyk, A. (ed.). 膜转运和代谢。1960 年 8 月 22 日至 27 日在布拉格举行的研讨会论文集. 布拉格: 捷克科学院. pp. 439–449.
{{cite book}}: CS1 maint: 多个名称:编辑列表 (链接) - ↑ 维基百科,离子通道
- ↑ Hille, Bertil (2001) [1984]. 可兴奋膜的离子通道 (第 3 版). 马萨诸塞州桑德兰: Sinauer Associates, Inc. p. 5. ISBN 0-87893-321-2.
- ↑ Hille, Bertil (1984). 可兴奋膜的离子通道.
- ↑ Purves, (2001). "第 4 章:通道和转运蛋白". 在 Dale Purves, George J. Augustine, David Fitzpatrick, Lawrence. C. Katz, Anthony-Samuel LaMantia, James O. McNamara, S. Mark Williams, 编辑 (ed.). 神经科学 (第 2 版). Sinauer Associates Inc. ISBN 0-87893-741-2.
{{cite book}}:|editor=有通用名称 (帮助)CS1 maint: 多余的标点符号 (链接) CS1 maint: 多个名称:编辑列表 (链接) - ↑ Hille B, Catterall, WA (1999). "第 6 章:电兴奋性和离子通道". 在 George J Siegel, Bernard W Agranoff, R. W Albers, Stephen K Fisher 和 Michael D Uhler (ed.). 神经化学基础:分子、细胞和医学方面. 费城: Lippincott-Raven. ISBN 0-397-51820-X.
{{cite book}}: CS1 maint: 多个名称:作者列表 (链接) - ↑ Camerino DC, Tricarico D, Desaphy JF (2007 年 4 月). "离子通道药理学". 神经治疗学. 4 (2): 184–98. doi:10.1016/j.nurt.2007.01.013. PMID 17395128.
{{cite journal}}: CS1 maint: 多个名称:作者列表 (链接) - ↑ Verkman AS, Galietta LJ (2009 年 2 月). "氯离子通道作为药物靶点". Nat Rev Drug Discov. 8 (2): 153–71. doi:10.1038/nrd2780. PMC 3601949. PMID 19153558.
- ↑ Camerino DC, Desaphy JF, Tricarico D, Pierno S, Liantonio A (2008). "离子通道疾病的治疗方法". Adv. Genet. 遗传学进展. 64: 81–145. doi:10.1016/S0065-2660(08)00804-3. ISBN 978-0-12-374621-4. PMID 19161833.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Yu FH, Catterall WA (2003). "电压门控钠通道家族概述". Genome Biol. 4 (3): 207. doi:10.1186/gb-2003-4-3-207. PMC 153452. PMID 12620097.
- ↑ Template:DorlandsDict
- ↑ Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). 神经科学。 第 4 版. Sinauer Associates. pp. 156–7. ISBN 978-0-87893-697-7.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Hille B (2001) 可兴奋膜的离子通道,第 3 版。 Sinauer Associates,桑德兰,马萨诸塞州。
- ↑ Cascio M (2004). "甘氨酸受体和相关烟碱类受体的结构和功能". J. Biol. Chem. 279 (19): 19383–6. doi:10.1074/jbc.R300035200. PMID 15023997.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2007). 生物化学 (第 6 版). 舊金山: W.H. Freeman. ISBN 0-7167-8724-5.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Koyrakh L, Luján R, Colón J, Karschin C, Kurachi Y, Karschin A, Wickman K (2005 年 12 月). "神经元 G 蛋白门控钾通道的分子和细胞多样性". J. Neurosci. 25 (49): 11468–78. doi:10.1523/JNEUROSCI.3484-05.2005. PMID 16339040.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://www.cartage.org.lb/en/themes/Reference/dictionary/Biologie/G/13.html,于 2006 年 8 月 28 日检索
- ↑ 吉布斯-唐南平衡...,D.C. Mikulecky,于 2006 年 8 月 28 日检索
- ↑ 一个 示例 用于证明 K+ 对静息电位重要性的电生理实验。 静息电位对 K+ 胞外浓度的依赖性如 Dale Purves、George J. Augustine、David Fitzpatrick、Lawrence C. Katz、Anthony-Samuel LaMantia、James O. McNamara、S. Mark Williams 在其第二版 神经科学 的图 2.6 中所示。 桑德兰 (马萨诸塞州):Sinauer Associates, Inc.;2001。
- ↑ Hille 2001,pp. 169–200. “第 6 章。 快速化学突触的配体门控通道。”
- ↑ Hille,Bertil (2001). “第 8 章。 感官转导和可兴奋细胞。”. 可兴奋膜的离子通道 (第 3 版). 桑德兰,马萨诸塞州:Sinauer. pp. 237–268. ISBN 0-87893-321-2.
{{cite book}}: 无效|ref=harv(帮助) - ↑ 维基百科,突触后电位
- ↑ 不列颠百科全书,终板电位 (EPP)
- ↑ 不列颠百科全书,动作电位
- ↑ MacDonald PE, Rorsman P (2006 年 2 月). "胰腺 β 细胞的振荡、细胞间耦合和胰岛素分泌". PLoS Biol. 4 (2): e49. doi:10.1371/journal.pbio.0040049. PMC 1363709. PMID 16464129.
- ↑ 维基百科,动作电位
- ↑ Barnett MW, Larkman PM (2007 年 6 月). "动作电位". Pract Neurol. 7 (3): 192–7. PMID 17515599.
- ↑ a b 生物电磁学 - 生物电场和生物磁场的原理和应用,牛津大学出版社,纽约,1995 年。
- ↑ a b c d e f g 马修·克里斯滕森,WO2010126827 A2,2010 年 11 月 4 日
- ↑ a b Geddes LA, Baker LE (1967):生物材料的比电阻 - 生物医学工程和生理学家数据汇编。Med. Biol. Eng. 5: 271-93
- ↑ a b c Rush S, Driscoll DA (1969):脑电图电极灵敏度 - 相互性的应用。IEEE Trans. Biomed. Eng. BME-16:(1) 15-22. 无效的
<ref>标签;名称“Rush”在不同内容中定义多次 - ↑ a b Barber DC, Brown BH (1984):应用电位层析成像。J. Phys. E.: Sci. Instrum. 17: 723-33.
- ↑ a b c Rush S, Abildskov JA, McFee R (1963):人体组织在低频下的电阻率。循环 22:(1) 40-50.
- ↑ a b Epstein BR, Foster KR (1983):各向异性作为骨骼肌的介电特性。Med. & Biol. Eng. & Comput. 21:(1) 51-5.
- ↑ Cole K.S. (1955) 离子、电位和神经冲动。在 Shedlovsky, T (编辑) 生物学和医学中的电化学。纽约,Wiley。第 121-140 页
- ↑ Hamill OP, Marty A, Neher E, Sakmann B, Sigworth FJ. (1981). "改进的膜片钳技术,用于从细胞和无细胞膜片中进行高分辨率电流记录". Pflügers Archiv European Journal of Physiology. 391 (2): 85–100. doi:10.1007/BF00656997. PMID 6270629.
{{cite journal}}: CS1 maint: 多个名称:作者列表 (link) - ↑ Tanzi S, Østergaard PF, Matteucci M, Christiansen TL, Cech J, Marie R, Taboryski RJ (2012). "使用多级干法蚀刻、电镀和模塑工艺制造组合尺度纳米流体和微流体聚合物系统". Journal of Micromechanics and Microengineering. 22 (11): 115008. Bibcode:2012JMiMi..22k5008T. doi:10.1088/0960-1317/22/11/115008.
{{cite journal}}: CS1 maint: 多个名称:作者列表 (link) - ↑ 1991 年诺贝尔生理学或医学奖
- ↑ 神经元电生理学和生物物理学实验室技术指南 (1993)
- ↑ http://www.nanion.de/pdf/PlanarPatchClamping.pdf












![{\displaystyle E={\frac {RT}{zF}}\ln {\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}=2.303{\frac {RT}{zF}}\log _{10}{\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d6f087a94da0f33a7735fa18ca8408bbca442cf)
![{\displaystyle E=-60mV\ln {\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bac658923af68e11720fa4ba0e6edafc93898bcb)


![{\displaystyle E_{m}={\frac {RT}{F}}\ln {\left({\frac {\sum _{i}^{N}P_{M_{i}^{+}}[M_{i}^{+}]_{\mathrm {out} }+\sum _{j}^{M}P_{A_{j}^{-}}[A_{j}^{-}]_{\mathrm {in} }}{\sum _{i}^{N}P_{M_{i}^{+}}[M_{i}^{+}]_{\mathrm {in} }+\sum _{j}^{M}P_{A_{j}^{-}}[A_{j}^{-}]_{\mathrm {out} }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4168067dcf31b41af9beddcc7e9a3beba72aab8c)

![{\displaystyle E_{m,\mathrm {K} _{x}\mathrm {Na} _{1-x}\mathrm {Cl} }={\frac {RT}{F}}\ln {\left({\frac {P_{Na^{+}}[Na^{+}]_{\mathrm {out} }+P_{K^{+}}[K^{+}]_{\mathrm {out} }+P_{Cl^{-}}[Cl^{-}]_{\mathrm {in} }}{P_{Na^{+}}[Na^{+}]_{\mathrm {in} }+P_{K^{+}}[K^{+}]_{\mathrm {in} }+P_{Cl^{-}}[Cl^{-}]_{\mathrm {out} }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2504511122b4215bf6fa6aef42441b3da96cec09)


![{\displaystyle [ion]_{\mathrm {out} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5d2e7fe4863a9c797f60607f91baeab4391607b)
![{\displaystyle [ion]_{\mathrm {in} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23ebffa4ae9cdb7523b8a4dd8e1752a6380b22e3)