高中化学/电离能
当我们研究元素周期表中的趋势时,不能仅仅停留在原子大小上。在本节中,我们将开始理解一个重要的概念,即电离能,并认识它在元素周期表中的趋势。
- 定义电离能。
- 描述元素周期表中电离能存在的趋势。
- 描述元素失去一个电子时存在的离子尺寸趋势。
锂的电子构型为1s22s1。锂在其最外层能级上有一个电子。为了去除这个电子,必须向系统中添加能量。请看下面的方程式
通过添加能量,可以通过失去一个电子从锂原子形成锂离子。这种能量被称为电离能。电离能是从气态原子或离子中去除最松散结合的电子所需的能量。“气相”是指定的,因为在液体或固体中,会涉及其他能量。电离能的一般方程式如下。
电离能的值越高,去除该电子就越困难。当我们查看第二周期元素的电离能时,我们可以看到一个趋势。表10.7总结了第二周期元素的电子构型和电离能。
| 元素 | 电子构型 | 第一电离能IE1 |
|---|---|---|
| 锂 (Li) | [He]2s1 | 520 kJ/mol |
| 铍 (Be) | [He]2s2 | 899 kJ/mol |
| 硼 (B) | [He]2s22p1 | 801 kJ/mol |
| 碳 (C) | [He]2s22p2 | 1086 kJ/mol |
| 氮 (N) | [He]2s22p3 | 1400 kJ/mol |
| 氧 (O) | [He]2s22p4 | 1314 kJ/mol |
| 氟 (F) | [He]2s22p5 | 1680 kJ/mol |
当我们仔细观察表10.7中提供的数据时,我们可以看到,当我们从左到右穿过周期时,一般来说,电离能会增加。在周期的开始,对于碱金属和碱土金属,失去一个或两个电子可以让这些原子变成离子。
随着我们沿着周期表横向移动,原子变得更小,导致原子核对价电子的吸引力更大。因此,电子更难以去除。
在同一族元素中也可以观察到类似的趋势。表 10.8 显示了第一族(碱金属)中一些元素的电子构型和第一电离能(IE1)。
| 元素 | 电子构型 | 第一电离能IE1 |
|---|---|---|
| 锂 (Li) | [He]2s1 | 520 kJ/mol |
| 钠 (Na) | [Ne]3s1 | 495.5 kJ/mol |
| 钾 (K) | [Ar]4s1 | 418.7 kJ/mol |
比较锂到钾的电子构型,我们知道要被移除的电子离原子核更远。我们知道这一点是因为n值更大,这意味着容纳价电子的能级更大。因此,更容易去除最松散结合的电子,因为原子更大,屏蔽效应更强,这意味着原子核对钾的外层电子 4s1 的控制力更小。
因此,钾的IE1(418.7 kJ/mol)小于锂的IE1(520 kJ/mol)。
如果要从原子中移除第二个电子,则一般方程式如下:
由于在移除第二个电子时正负电荷不平衡,因此第二次电离所需的能量(IE2)将大于第一次电离所需的能量(IE1)。简单来说,IE1 < IE2 < IE3 < IE4。
因此,如果我们查看元素周期表中的电离能趋势,并将其添加到原子尺寸存在的趋势中,我们可以在元素周期表图表上显示以下内容。

但是为什么电离能沿周期表横向移动时增加,沿周期表纵向移动时减少呢?这与两个因素有关。一个因素是原子尺寸减小。第二个因素是有效核电荷增加。**有效核电荷**是指特定原子内特定电子所感受到的电荷。请记住,核电荷用于描述为什么原子尺寸沿周期表横向移动时减小。当我们再次查看表 10.7 中的数据时,我们可以看到有效核电荷如何沿周期表横向移动时增加。表 10.9 显示了第二周期元素的有效核电荷以及电离能。
| 元素 | 电子 构型 |
质子 数目 |
内层 电子 |
数目 有效 |
核电荷 电离 |
|---|---|---|---|---|---|
| 锂 (Li) | [He]2s1 | 3 | 2 | 1 | 520 kJ/mol |
| 铍 (Be) | [He]2s2 | 4 | 2 | 2 | 899 kJ/mol |
| 硼 (B) | [He]2s22p1 | 5 | 2 | 3 | 801 kJ/mol |
| 碳 (C) | [He]2s22p2 | 6 | 2 | 4 | 1086 kJ/mol |
| 氮 (N) | [He]2s22p3 | 7 | 2 | 5 | 1400 kJ/mol |
| 氧 (O) | [He]2s22p4 | 8 | 2 | 6 | 1314 kJ/mol |
| 氟 (F) | [He]2s22p5 | 9 | 2 | 7 | 1680 kJ/mol |
屏蔽核电荷的电子是内层电子,或者在第二周期的情况下,是 1s2 电子。有效核电荷是原子核中总电荷(质子数)与屏蔽电子数之间的差值。请注意,随着有效核电荷的增加,电离能也随之增加。总的来说,电离能的一般趋势如下所示。
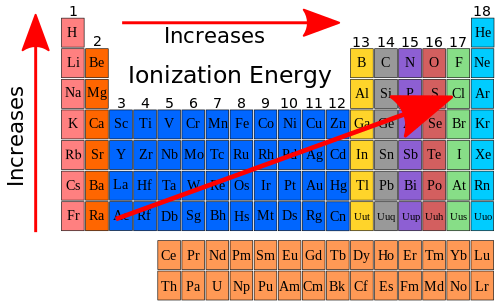
|
示例问题 氯的有效核电荷是多少?你预测它的电离能会高于还是低于氟? 解答: 氯的电子构型为 [Ne]3s23p5 有效核电荷为 7,与氟相同。仅凭这一点很难预测电离能。然而,氯的原子尺寸大于氟,因为现在有三个能级(氯位于第三周期)。现在我们可以说,氯的电离能应该低于氟,因为电子更容易从远离原子核的能级上剥离。(事实上,氯的电离能为 1251 kJ/mol)。 |
电离能趋势中存在一些异常现象。在一个周期内,电离能可能会受到电子构型的两种方式的影响。当我们观察第三周期时,我们可以看到从3s亚层到3p亚层时观察到一个异常现象。下表显示了第三周期主族元素的电子构型以及这些元素的第一电离能。
|
在表中我们看到,当我们将镁与铝进行比较时,第一IE降低而不是像我们预期的那样增加。那么为什么会这样呢?镁的最外层电子位于s亚层。铝原子最外层电子位于3p亚层。由于p电子的能量略高于s电子,因此从铝中去除该电子所需的能量略少。另一个轻微的因素是3s2中的电子屏蔽了3p1中的电子。这两个因素导致Al的IE1小于Mg的IE1。
当我们查看下表时,我们可以看到氮的电离能似乎有些异常。
|
虽然氮有一个电子占据第二亚层中三个p轨道的每一个,但氧有两个轨道只被一个电子占据,而一个轨道包含一对电子。这些2p电子所经历的更大的电子-电子斥力使得去除其中一个电子所需的能量更少。因此,氧的IE1小于氮。
- 电离能是从气态原子或离子中去除最松散结合的电子所需的能量。电离能通常沿周期递增,沿族递减。有效核电荷是价电子感受到的原子核电荷。
- 有效核电荷和原子尺寸有助于解释电离能的趋势。沿族向下,原子尺寸变大,电子更容易被去除,因此电离能降低。沿周期向右,有效核电荷增加,因此电子更难被去除,电离能增加。一旦一个电子被去除,第二个电子可以被去除,但IE1 < IE2。如果去除第三个电子,则IE1 < IE2 < IE3,依此类推。
- 定义电离能并展示一个电离方程式的例子。
- 绘制元素周期表的视觉表示,描述电离能的趋势。
- 下列哪种元素的电离能最大?
- (a) Na
- (b) Al
- (c) H
- (d) He
- 下列哪种元素的电离能最小?
- (a) K
- (b) P
- (c) S
- (d) Ca
- 将下列元素按电离能递增的顺序排列:Na、O、Ca、Ne、K。
- 将下列元素按电离能递减的顺序排列:N、Si、S、Mg、He。
- 使用实验数据,发现某元素的第一电离能为600 kJ/mol。发现形成的离子的第二电离能为1,800 kJ/mol。发现形成的离子的第三电离能为2,700 kJ/mol。发现形成的离子的第四电离能为11,600 kJ/mol。最后,发现第五电离能为15,000 kJ/mol。写出本题中表示的数据的反应。该元素属于哪一族?解释。
- 利用电子构型和您对电离能的理解,您预测哪种元素的第二电离能更高:Na还是Mg?
- 比较钙 (Ca) 和镁 (Mg) 的第一电离能 (IE1),
- (a) Ca 的IE1较高,因为它的半径较小。
- (b) Mg 的IE1较高,因为它的半径较小。
- (c) Ca 的IE1较高,因为它的外层亚层已满。
- (d) Mg 的IE1较高,因为它的外层亚层已满。
- (e) 它们的IE1相同,因为它们具有相同数量的价电子。
- 比较铍 (Be) 和硼 (B) 的第一电离能 (IE1)
- (a) Be 的IE1较高,因为它的半径较小。
- (b) B 的IE1较高,因为它的半径较小。
- (c) Be 的IE1较高,因为它的s亚层已满。
- (d) B 的IE1较高,因为它的s亚层已满。
- (e) 它们的IE1相同,因为B比Be多一个电子。
- 有效核电荷
- 原子或离子对最外层电子(价电子)的电荷。
- 电离能
- 从气态原子或离子中去除一个电子所需的能量:能量 + J → J+ + e−(第一电离能)。
此材料改编自可在此处找到的原始 CK-12 书籍。此作品根据知识共享署名-相同方式共享 3.0 美国许可发布









![{\displaystyle [{\text{He}}]+2s^{1}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ef0c3bd08060b641f187157e1f50ebddedd4525)
![{\displaystyle [{\text{He}}]+e^{-}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eea03da7708e973f2218af8fc0a9c7f23c226b03)
![{\displaystyle [{\text{Ne}}]+3s^{2}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/79706974a36cef696a78dc6c3ef8d64d4b2cd90b)
![{\displaystyle [{\text{Ne}}]+2e^{-}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/25977b668258576b378bb0118a84e86ccf5fbb84)







