地质学家历史地质学/化学

在本文中,我们将了解一些学习本教材或任何其他地质学入门教材所需的化学知识。
当然,化学是一个庞大而复杂的学科,本文不可能对其进行详细介绍。我省略了所有不必要的信息,以及可能被化学家认为是必不可少的信息;为了简化起见,我随意牺牲了准确性,这在本书的主体部分是不可接受的。为了全面准确地了解化学,读者需要阅读专门的化学书籍;本附录的目标是确保当本文中引入化学术语、符号和概念时,读者不会觉得这些内容完全是外语。我没有做更多尝试。
其他一些不太基础的化学信息将在本教科书的各个条目中根据相关性进行介绍。
一个原子由质子、中子和电子组成。质子带+1的电荷,中子不带电,电子带-1的电荷。原子中的质子数量等于电子数量,因此整个原子不带电。原子中质子的数量被称为原子序数,根据原子序数对原子进行分类,形成元素:例如,钠元素包含所有原子序数为11的原子。
原子中的质子和中子聚集在一起,位于原子中心的原子核中。电子形成一个围绕原子核的云层。质子或中子的质量大约是电子的1836倍。这意味着原子的质量几乎完全由它所含质子和中子的总和决定;这被称为原子的原子量。
电子不会像苍蝇围绕果酱罐那样随机地在原子核周围嗡嗡作响。相反,它们根据量子电动力学定律排列在原子核周围。读者可以在化学教科书中找到这些定律的讨论;将量子理论引入地质学入门教材,是对还原论解释的过度延伸。
相反,我们必须满足于在量子力学被发现之前人们所接受的那种解释,这种解释至今仍被中学生所接受;这对我们的目的已经足够了。
根据这种方案,电子以电子层的形式排列在原子核周围。最内层的电子层可以容纳两个电子,第二层可以容纳八个电子,第三层可以容纳八个电子,第四层可以容纳十八个电子,以此类推,遵循一个我们不得不留待解释的模式,因为我们不会讨论量子理论。电子从里到外依次排列在这些电子层中,因此最内层的电子层必须填满电子,才能有电子进入第二层;第二层必须填满电子,才能有电子进入第三层;以此类推。
我们可以用比喻的方式说,当原子所有含有电子的电子层中,最外层的电子层都填满了电子时,原子就“最快乐”。
这意味着原子可以通过分享它们最外层电子层中的电子来形成互惠互利的关系;这被称为共价键。例如,考虑右侧的图,它显示了两个氧原子之间形成共价键的情况,其中原子核用红色表示,电子用绿色表示。每个单独的原子在最外层电子层中都有六个电子,但通过共享电子,它们在最外层电子层中各有八个电子。以这种方式结合在一起的两个原子形成一个分子:在这种情况下,分子为O2(这种化学符号将在下面解释)。
或者,原子可以形成离子键,其中一个原子直接将一个或多个电子传递给另一个原子,而不是共享电子。例如,一个钠原子有 11 个电子,它更愿意失去一个电子,剩下 8 个电子,这些电子就成了它的最外层电子层;而一个氯原子有 17 个电子,它更愿意在最外层电子层中添加一个电子,使其填满。如果钠原子将它不需要的电子传递给氯原子,那么它们都会满足。
这样一来,钠原子就带有一个+1的电荷,因为它比电子多一个质子,而氯原子比质子多一个电子,因此带有一个-1的电荷。
元素的缩写
每个元素都用一个大写字母表示(例如,H 代表氢,K 代表钾,W 代表钨),或用一个大写字母后跟一个小写字母表示(例如,Cl 代表氯,Hg 代表汞,Na 代表钠)。
化学式
我们可以使用这些缩写来描述分子的组成:例如,上面描述的钠和氯的组合可以写成 NaCl。(按照惯例,Na 写在前面,因为钠带正电荷。)
当一个分子中某一元素的原子数超过一个时,用元素符号右侧的下标数字表示。例如,一个水分子包含两个氢(H)原子和一个氧(O)原子,写成 H2O;一个甲烷分子包含一个碳(C)原子和四个氢(H)原子,写成 CH4。
化学反应
我们可以用化学式和一些额外的符号来表示化学反应,其中分子形成、分解和重新组合。例如,我们可以写成
- Na + Cl → NaCl
表示箭头左侧的钠和氯将结合起来,生成箭头右侧的 NaCl。
注意,箭头两侧的元素相同,数量也相同;在化学反应中,原子既不会被创造,也不会被破坏,只有它们之间关系的性质发生了改变。
在描述化学反应时,另一个惯例是在原子或分子名称前使用正常大小的数字,表示参与反应的原子或分子数量。例如,我们可以写成
- 2HCl + Mg → MgCl2 + H2
这里,正常大小的数字 2 表示左侧有两个 HCl 分子。注意,2 指的是它右侧的整个公式 HCl,而不是它右侧的 H。
为什么我们不直接写成 H2Cl2 而不是 2HCl?因为 H2Cl2 不是一个分子;我们有两个 HCl 分子,符号反映了这一点。另一方面,我们写右侧的 H2 而不是 2H,因为 H2 是一个分子,写成 2H 会不准确。
离子
如果一个原子或一个原子集合体失去了一个电子,就像在形成离子键时那样,那么它就会带正电荷,被称为带正电荷的离子。我们可以用一个加号表示这一点,加号写成元素符号右侧的上标。如果它获得了一个电子,它就会带负电荷,被称为负离子;我们可以用一个减号表示这一点,减号写成元素符号右侧的上标。
因此,例如,如果我们愿意,我们可以将钠和氯的组合写成 Na+Cl-。
如果一个离子失去了或获得了不止一个电子,那么我们可以用一个数字表示这一点,数字写成电荷符号前面的数字:例如,我们可以写成 Ca2+,表示一个失去最外层电子层中两个电子的钙原子,因此带有一个+2的电荷。
指示电离不是必须的。例如,没有一个化学家会真正地费心去写 Na+Cl-,因为任何化学家都知道,为了形成一个分子,钠和氯必须以这种方式电离。但是,这种符号作为一种可选的表示方法还是很有用的。
化学名称
还有一些惯例,可以为分子取一些合理的发音的名称:例如,一个化学家看到公式 CaSO4 就会知道它叫做硫酸钙。对于我们的目的来说,没有必要解释这个系统的细节:在本教科书的各条目中,我只是在化学式旁边给出了化学名称。
如果两种元素在最外层电子层中的情况相似,那么在化学上,它们的行为会非常相似。例如,钠和钾在最外层电子层中都只有一个电子。这意味着,就像一个钠原子可以与一个氯原子结合形成 NaCl 一样,一个钾原子也可以与一个氯原子结合形成 KCl。
类似地,氟 (F) 与氯处于相同状态:它们的外层电子壳层都缺失一个电子。这意味着氟会像氯一样与钠或钾结合,分别形成 NaF 或 KF。
有关元素的信息可以通过将元素排列在元素周期表中来总结,如下所示。
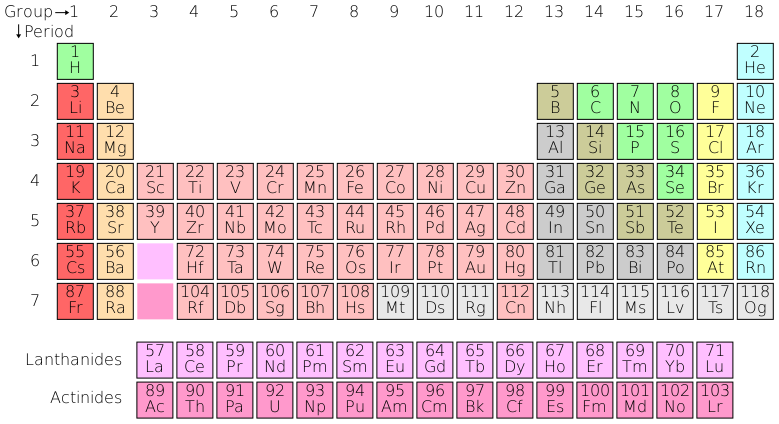
同一列中的元素被称为属于同一族,它们的外层电子壳层结构相似。例如,最左侧一列中的元素在外层电子壳层中只有一个电子,它们渴望放弃这个电子;而最右侧一列中的元素外层电子壳层都已填满,因此不会形成化学键,因为它们已经非常稳定。
元素周期表中总结的事实对于我们理解地质学各个方面至关重要;例如,在我们讨论古气候学时,我们将利用镁和锶可以代替钙这一事实;在讨论 U-Pb 年代测定法时,重要的是要知道铀可以在公式 ZrSiO4 中代替锆,但铅却不能。
读者会注意到,通过查看元素周期表,在最后一个例子中,铀 (U) 并不完全位于与锆 (Zr) 相同的列中。然而,由于量子理论无法解释的原因,表格中粉红色元素之间存在更大的相互替代灵活性:因此铀可以替代锆,但例如钙不能替代钠,尽管它们在表格中的位置比铀与锆更接近。
如果一种物质(溶质)与另一种物质(溶剂)混合,以至于溶质获得了溶剂的相态(即固态、液态或气态,以及如果是固态则包括其晶体结构),则称该物质溶解在另一种物质中。
例如,比较一下当我们在水中加入不溶于水的物质(例如沙子)和溶于水的物质(例如食盐(NaCl))时会发生什么。沙子仍然保持固态;我们所做的只是将固体与液体混合。此外,它不会均匀地分布在水中,而是会沉到底部,因为它的密度大于水;如果它的密度小于水,它就会漂浮在上面。
相反,盐会溶解在水中,因此我们得到的不是固态(盐)在液态(水)中,而仅仅是液态,即咸水;并且盐会迅速地均匀地分布在整个水中,而不是沉到底部。
盐 (NaCl) 是一个由离子键结合的分子,正如我们上面提到的。然而,溶解在水中时,离子键也被溶解,因为带正电的钠被水中氧原子的负电荷吸引,而氯原子被氢原子的正电荷吸引。描述溶解的盐为 NaCl 不准确,更准确的描述是 Na+ + Cl-;这是离子符号有用的一个场合。
由于原子的化学行为是由其电子间的相互作用决定的,因此决定原子化学性质的关键参数是其原子序数;它告诉我们原子有多少个电子,而电子的数量决定了它们在电子壳层中的排列方式。这就是为什么对化学家来说,将原子根据其原子序数分类成元素是正确的方式。
但是,我们可以对原子进行更精细的区分:两个具有相同电子数量(因此具有相同质子数量)的原子可以具有不同的中子数量,因此具有不同的原子量。例如,我们可以区分铀-235(具有 143 个中子、92 个质子、92 个电子,原子量为 235)和铀-238(具有 146 个中子、92 个质子、92 个电子,原子量为 238)。
用于表示同位素的符号是在元素符号的左侧写上原子量作为上标:例如,铀-235 将写成 235U。(一些文本还将原子序数作为元素符号左侧的下标;在这本教科书中,我没有遵循这种惯例。)
因为同一元素的两种不同同位素仍然是同一元素,具有相同的电子排列,因此它们具有相同的化学性质。因此,正如同一族中的元素可以相互替代一样,同一元素的两种同位素在化学上可以相互替换。这一事实对地质学家特别有用,因为如果没有它,许多放射性年代测定法将无法实现。
在这一点上,通常会解释核衰变和放射性;然而,这本教科书在关于绝对年代测定的章节中有一篇专门讨论这个主题的文章。历史地质学/放射性衰变
