有机化学/芳香族
在理解不饱和化合物或共轭体系的用途后,我们希望探索芳香族化合物的独特结构,包括为什么苯不应该被称为 1,3,5-环己三烯,因为它比典型的三烯更稳定,并且似乎不反应。最初被称为“芳香族”是因为它的香味,芳香性现在指的是被认为是芳香族的化合物的稳定性,而不仅仅是苯。任何具有 4n+2 个 π 电子的环状化合物都是芳香族的。芳香族化合物的稳定性来自于所有成键轨道都被填满并且能量较低。
19 世纪初,设备、技术和通信方面的进步使化学家发现了新的化学化合物并对其进行了实验。在他们的研究过程中,他们偶然发现了一种不同类型的稳定化合物,其分子式为 C6H6。由于无法想象这种化合物可能是什么样子,科学家们发明了各种碳碳键模型——其中许多模型并不完全稳定——以便将他们观察到的结果与他们期望的 C6H6 化合物的样子相匹配。
苯(这是赋予芳香族化合物 C6H6 的名称)可能是当今使用最广泛、工业上最重要的芳香族化合物。它是由迈克尔·法拉第于 1825 年发现的,大约 25 年后,它开始从煤焦油(以及后来从其他天然来源)中商业化生产。苯的结构出现在 19 世纪 60 年代,是几位化学家贡献的结果,最著名的是凯库勒的贡献。Kekulé。
当时的科学家没有认识到电子能够离域,因此所有碳原子都可以平等地共享相同的 π 键电子构型。Huckel 是第一个将新的量子力学理论应用于明确分离 σ 和 π 电子的化学家。他继续发展了苯的 π 电子键合理论,这是第一个解释芳香性电子起源的理论。
苯是一个六个碳原子组成的六边形环,每个碳原子通过一个 p 轨道连接在一起。它的化学式为 C6H6,其结构是一个六边形碳环,共享对称键,所有六个氢原子从碳环向外突出,但与环位于同一平面上。p 轨道系统包含 6 个电子,其中一种电子分布方式会产生以下结构
但是,苯的另一种共振形式是可能的,其中第一个结构的单键被双键取代,双键被单键取代。这两种共振形式在苯中占主导地位。(其他形式,例如一个结构,其 π 键连接相对碳原子,是可能的,但可以忽略不计。)因此,苯中每个键的长度和强度在实验上被证明是相等的,并且每个键都被认为大约是“1.5”键,而不是单独的单键或双键。
电子密度在碳原子之间共享,实际上既不是单键也不是双键,而是在六个碳原子中的每一个之间形成一种“一又二分之一”键。苯在环结构形成的平面上下都具有负电荷密度。尽管苯非常稳定,并且不倾向于与大多数物质发生能量反应,但亲电化合物可能会被这种局部电子密度吸引,并且这些物质可能会与芳香苯环形成键。
可以使用电子离域环在一张图中显示苯的两种主要共振形式
苯是一种无色、易燃的液体,具有甜味香气和致癌作用。苯的芳香性质使其在许多方面与其他烯烃截然不同。
- 主条目: 芳香族反应
与烯烃不同,苯等芳香族化合物发生取代反应而不是加成反应。苯最常见的反应是亲电芳香取代 (EAS),尽管在少数特殊情况下,取代苯可以发生亲核芳香取代。
在体内,苯被代谢,苯暴露可能对健康产生相当严重的影响。吸入高浓度的苯会导致死亡,而较低浓度(但仍然很高)的苯会导致嗜睡、头晕、心率加快、头痛、震颤、意识混乱和昏迷。食用或饮用含有高浓度苯的食物会导致呕吐、胃部刺激、头晕、嗜睡、抽搐、心率加快,甚至死亡。
长期(长期)暴露于苯的主要影响是血液。苯会损伤骨髓,导致红细胞减少,从而导致贫血。它还会导致过度出血并抑制免疫系统,增加感染的风险。一些吸入高浓度苯数月的女性出现了月经不规则和卵巢萎缩。目前尚不清楚苯暴露是否会影响孕妇的胎儿发育或男性的生育能力,但动物研究表明,当怀孕的动物吸入苯时,会导致出生体重低、骨骼形成延迟和骨髓损伤。
美国卫生与公众服务部 (DHHS) 还将苯归类为人类致癌物。长期暴露于空气中高浓度苯会导致白血病,这是一种可能致命的血细胞生成器官癌症。特别是急性髓系白血病 (AML) 可能由苯引起。
有机化学中的芳香性并不指分子是否会触发嗅觉器官的感官反应(是否“有气味”,而是指环状分子中电子键的排列。许多具有强烈气味的分子(例如二原子氯 Cl2)在结构上不是芳香族——气味与化学芳香性几乎没有关系。然而,许多最早发现的芳香族化合物具有明显宜人的气味。这一性质导致了这类化合物的“芳香族”一词,因此,由于离域电子而具有增强稳定性的性质被称为“芳香性”。
芳香性是指一个共轭环状体系(体系中含有不饱和键,孤对电子或空轨道)所表现出的稳定性比仅靠共轭效应所产生的稳定性更强的化学性质。它也可以被视为环状离域和共振的体现。
通常认为这是因为电子可以自由地在原子环状排列中循环,这些原子交替地以单键和双键的形式相互连接。这些键可以被视为单键和双键的混合体,环中每一个键都与其他键相同。这种常见的芳香环模型是由凯库勒提出的。苯的模型由两种共振形式组成,对应于双键和单键的位置互换。苯比理论上的环己三烯更稳定,环己三烯是一个理论上的分子。
按照惯例,双箭头表示两种结构只是假设的,因为它们都不能说是对实际化合物的准确描述。实际分子最好用最可能结构的混合体(平均值)来表示,这些混合体被称为共振形式。碳-碳双键的长度比碳-碳单键短,但芳香族化合物在几何上是完美的(即,不偏斜),因为所有碳-碳键的长度都相同。芳香族分子内部原子的实际距离介于单键和双键的距离之间。
比路易斯结构图更好的表示方法是环状π键(阿姆斯特朗的内环),其中电子密度均匀分布在环上方的π键和环下方的π键中。这种模型更准确地表示了芳香族分子总体结构内的电子密度位置。单键是由电子位于碳原子核之间“直线”位置形成的σ(σ)键。双键由一个“直线”σ键和另一个非线性排列的键组成——π键。π键是由原子p轨道的重叠形成的,这些原子p轨道同时位于由“直线”σ键形成的环的平面上方和下方。
由于π轨道不在原子的平面上,因此它们可以自由地相互作用,从而变得离域化。这意味着每个电子不是与特定碳原子相连,而是可以与芳香环中的所有碳原子共享。因此,没有足够的电子在所有碳原子上形成双键,但“额外”的电子平等地加强了环的所有键。
芳香族化合物包含一组具有特定特征的共价键合原子
- 该分子必须是环状的
- 离域化的共轭π体系,最常见的是交替的单键和双键的排列(如果分子的几何结构允许,有时可以包括三键)
- 共平面结构,所有参与原子都在同一平面上
- π离域电子的数量是偶数,但不是4的倍数。(这被称为休克尔(4n+2)Π规则,其中n= 0,1,2,3等。π电子的允许数量包括2, 6, 10, 14等)
- 在有机反应中表现出特殊的反应性,例如亲电芳香取代反应和亲核芳香取代反应
虽然苯是芳香族的(6个电子,来自3个双键),但环丁二烯不是,因为π离域电子的数量是4,它不满足任何n整数的值。然而,环丁二烯化物(2−)离子是芳香族的(6个电子)。芳香体系中的原子可以有其他不属于体系的电子,因此在4n + 2规则中被忽略。在呋喃中,氧原子是sp2杂化的。一个孤对电子在π体系中,另一个在环的平面上(类似于其他位置的C-H键)。有6个π电子,所以呋喃是芳香族的。
与类似的非芳香族分子相比,芳香族分子通常表现出增强的化学稳定性。芳香族分子中的循环(即离域的)π电子会产生显著的局部磁场,这些磁场可以通过核磁共振技术检测。核磁共振实验表明,芳香环上的质子比脂肪族碳上的质子发生明显更强的去屏蔽效应。含有4nπ电子的平面单环分子称为反芳香族,通常是不稳定的。能够形成反芳香族的分子倾向于改变其电子或构象结构以避免这种情况,从而仅仅变得是非芳香族的。
芳香族分子能够以所谓的π-π堆积方式相互作用:π体系形成两个平行的环,以“面对面”的方式重叠。芳香族分子也能够以“边缘对面”的方式相互作用:一个分子环原子上取代基的轻微正电荷被另一个分子芳香体系的轻微负电荷吸引。
苯是一个非常重要的基本结构,在有机化学的大多数方面都用于分析和合成。苯环本身并不是分子中最有趣或最有用的特征;哪些取代基以及它们在环上的位置可以被认为是苯化学中最关键的方面。
根据取代基的类型,原子或原子团可以使苯环变得更具反应性或更不具反应性。如果原子或基团使环变得更具反应性,则称为活化;如果使环变得更不具反应性,则称为失活。
通常,活化和失活的术语是指属于亲电芳香取代反应(EAS)类别的反应。这些是芳香环最常见的反应形式。然而,芳香环可以进行其他类型的反应,在亲核芳香取代反应的情况下,环上取代基的活化和失活性质会反转。在EAS中,羟基是强活化基团,但在亲核芳香取代反应中,羟基是强失活基团。但由于EAS是芳香环最常见的反应,因此在讨论活化和失活时,通常是在EAS的术语中进行的。
除了活化或失活之外,苯环上的所有基团和/或取代原子都是定位的。原子或基团可能会鼓励额外的原子或基团添加到与定位基团相连的碳相关的其他特定碳上,或者不添加到这些特定碳上。这个概念将在下一章中进一步讨论,但在记忆下面的基团时,同时记忆它们是O(邻位)、M(间位)还是P(对位)定位的会很有帮助。
然而,另一个极大地影响方向的因素是空间位阻。例如,如果在环上有一个叔丁基取代基,尽管它是邻位/对位定位基团,但叔丁基基团会很大程度地阻挡邻位,因此几乎所有产物都是对位产物。
活化取代基使苯变得略微更具反应性,或者变得非常更具反应性,具体取决于基团或原子。通常,如果主要杂原子(氮或氧)直接连接到碳环,那么结果可能是活化。这只是一个经验法则,存在许多例外,因此最好记住下面列出的基团,而不是依赖于快速而粗糙的经验法则。
| 基团 | 强度 | 定位 |
| -NH2, -NHR, -NRR | 非常强 | 邻位/对位 |
| -OH, -O- | 非常强 | 邻位/对位 |
| -NHCOCH3, -NHCOR | 强 | 邻位/对位 |
| -OCH3, -OR | 强 | 邻位/对位 |
| -CH3, -C2H5, -R | 弱 | 邻位/对位 |
| -C6H5 | 非常弱 | 邻位/对位 |
失活基团是一种连接到苯分子上的官能团,它从苯环中去除电子密度,使得亲电芳香取代反应比单独在苯上进行的反应速度更慢,难度更大。如上所述,失活基团还可以决定取代发生的部位(相对于它们本身)在苯环上的位置,因此每个失活基团及其指向特征列在下面。
| 基团 | 强度 | 定位 |
| -NR3+ | 非常强 | 间位 |
| -NO2 | 非常强 | 间位 |
| -CF3, CCl3 | 非常强 | 间位 |
| -CN | 强 | 间位 |
| -SO3H | 强 | 间位 |
| -CO2H, -CO2R | 强 | 间位 |
| -COH, -COR | 强 | 间位 |
| -F | 弱 | 邻位/对位 |
| -Cl | 弱 | 邻位/对位 |
| -Br | 弱 | 邻位/对位 |
活化与失活以及邻/对位与间位指向
[edit | edit source]那么,为什么有些取代基是活化或失活的?为什么有些是间位指向,而另一些是邻/对位指向?从上面的表格来看,它们之间似乎存在一定的关系。
取代基对环的影响主要有两个方面,影响了这些特征
- 共振效应
- 诱导效应
共振效应
[edit | edit source]让我们先看一下共振效应。共振效应是指取代基向环提供电子或无法向环提供电子并增强其共振稳定性的能力。为了理解这一点,我们首先要了解亲电芳香取代反应的机理。我们将在下一节中详细讨论EAS,但这里需要了解一些基础知识。

如上图所示,亲电试剂受到环中pi电子的攻击。同一个碳原子现在与之前与它相连的氢原子和亲电试剂都形成了键。这反过来在相邻的碳原子上产生一个碳正离子,使得环失去芳香性。但芳香环喜欢保持芳香性。之前与亲电试剂相连的亲核试剂现在攻击氢原子,从环中将其抽象出来,并使pi键重新形成,使环恢复其芳香性。
正如我们在其他一些反应中所见,当碳正离子作为中间体产生时,该碳正离子的稳定性对反应至关重要。亲电芳香取代反应也是如此。
那么,取代基对环的影响是什么呢?
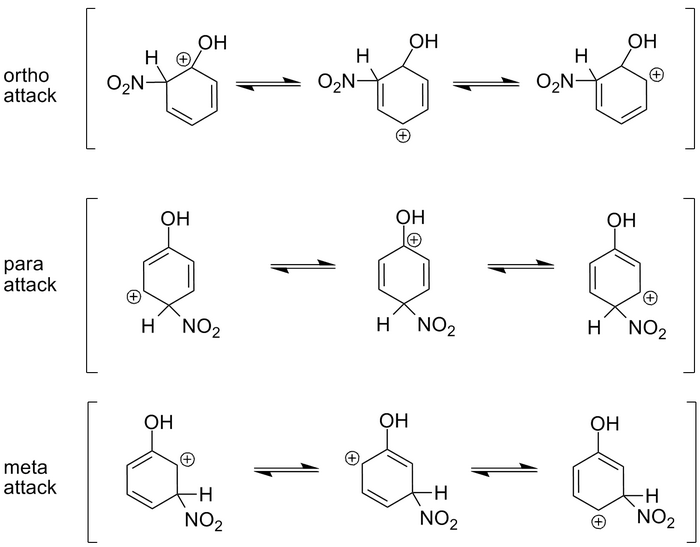
让我们看一下上面的情况。在这种情况下,我们有苯酚,一个带有连接的-OH(羟基)基团的苯环。当我们在硫酸中用硝酸对环进行硝化(我们在下一节中会讨论的反应)时,一个硝基会连接到苯环上。
硝基有三个可能的连接位置:邻位、间位或对位。为了理解碳正离子的稳定性,我们需要观察特定攻击的共振结构,并了解结果是什么。
邻位攻击的第一个共振结构导致带有羟基的碳原子带上正电荷。这恰好是邻位攻击三个共振结构中最稳定的结构,因为氧原子中的两个负电子对有助于稳定碳原子上的正电荷。另外两个共振形式将正电荷留在与氢原子相连的碳原子上。氢原子无法稳定电荷,因此这些形式不太稳定。
在对位攻击的情况下,请注意,第二个共振形式也使带有羟基的碳原子带上正电荷。这提供了稳定性,就像在邻位攻击的情况下一样,因此中间共振形式非常稳定。
最后,在间位攻击的情况下,所有共振形式都导致带有氢原子的碳原子带上正电荷。这些都不稳定,因此,带有羟基连接的间位攻击只占产物的很小一部分。
因此,氧原子中的电子对有助于稳定邻位和对位攻击。
诱导效应
[edit | edit source]现在让我们看一下失活取代基的诱导效应。假设我们没有羟基,而是用羰基代替羟基连接到环上。当羰基连接时,环与一个碳原子相连,该碳原子又与一个氧原子形成双键,双键氧原子会吸引电子,这种诱导效应会传递到环上,强烈地失活其pi键性质,并在碳原子上产生一个正偶极。观察共振结构,这个碳原子已经带有一定的正性,现在又增加了正电荷的共振,在邻位和对位攻击的情况下。正加正等于更正,因此更不稳定。没有负电荷或负电子对来稳定这个正电荷。
因此,在这种情况下,整个环不仅活性降低,而且邻位和对位攻击导致碳正离子共振形式更不稳定。因此,间位是优选的位置,但总体反应活性低于纯苯。
卤素的例外
[edit | edit source]请注意,在活化与失活取代基的列表中,活化取代基都是邻/对位指向。在失活取代基中,除了卤素之外,其余都是间位指向。为什么卤素是例外?
因为卤素比碳更具电负性,它们在连接的碳原子上诱导一个正偶极,在其自身原子(诱导效应)上诱导一个负偶极,根据之前关于活化/失活取代基的逻辑,卤素会使环失活。然而,卤素在外层电子壳层中也具有孤对电子,可以与环共享,允许由于间位攻击共振形式很差而导致邻/对位攻击占优势的共振结构。本质上,尽管卤素在一定程度上使环失活,但由于孤对电子的可用性,它们提供了主要的共振贡献者。共振结构通常优于诱导效应。
取代基的详细影响
[edit | edit source]我们已经讨论了一些关于取代基影响的概论,甚至讨论了一些关于特定取代基的具体内容,但让我们更仔细地看一下取代基,并尝试了解是什么使它们活化或失活的细节。
-NH2、-NHR 和 -NRR 都是强活化基团。尽管氮原子比碳原子更具电负性,但它共享一对电子的能力远远超过其吸电子效应。
-OH 和 -O- 类似,它比氮原子更具电负性,但它有两对电子可以共享,这也远远超过其吸电子效应。
-NHCOCH3 和 -NHCOR 也是强活化基团,但双键氧原子的诱导效应会使氮原子更具吸电子性,因此它们不像上面提到的其他-N取代基那样活化。
-OCH3 和 -OR 也仍然是强活化基团,但程度较低,因为电子密度在氧原子的两侧都被共享。
-CH3 和 -R 通常会提供一些电子密度共享,但远不如一对电子。因此,它们的影响只会被微弱地感受到。
对于失活基团,我们有
-NO2 或硝基和 -NR3+。硝基由于其共振结构而具有很强的失活性。硝基有两种共振形式:O=N+-O- 和 O--N+=O。这两种形式都在氮原子上留下一个完整的正电荷,使其完全无法帮助稳定正碳正离子中间体。-NR3+ 也是如此。
-CF3 和 -CCl3 都有 3 个卤素的诱导电负性效应,但没有电子可以与环共享,因此它们也是强失活基团。
-CN 在碳原子和氮原子之间有一个三键,共振形式为碳原子和氮原子之间有一个双键,碳原子带上正电荷,这意味着氮原子的电负性和共振形式中带正电荷的碳原子之间的作用会使碳正离子不稳定,并且不向环提供电子。
-SO3、-COR、-CO2R - 这些都具有电负性氧原子,使碳原子带上正偏电荷,并且不提供电子以稳定环。
-F、-Cl、-Br 的作用类似。它们具有电负性,使环失活,但它们可以共享电子,在一定程度上弥补了这一点,允许邻/对位指向。但要更好地理解它们的影响,你需要从它们在元素周期表上的位置来看。氟是最具电负性的元素,而且它很小,因此与它连接的碳原子非常接近。这使得它的电磁影响具有更强的失活特性。氯的电负性较低,但它也较大,因此与碳原子之间的距离更远,使其难以共享电子。依此类推。
多取代苯
[edit | edit source]未取代的苯在自然界或实验室中很少见,你会发现在你的研究中,苯环最常作为其他更复杂分子的组成部分。为了使苯在大多数情况下发生反应,它会根据连接的官能团而增加或减少一些功能。尽管最简单的情况是处理只有一个官能团的苯,但了解连接到同一个苯环上的多个官能团之间的相互作用和竞争也至关重要。
当苯环上存在多个取代基时,基团之间的空间关系变得重要,这就是为什么设计了 **邻位 (ortho)**、**间位 (meta)** 和 **对位 (para)** 芳烃取代模式。例如,甲酚分子存在三种异构体,因为甲基和羟基可以相邻放置 (邻位),相隔一个位置 (间位) 或相隔两个位置 (对位)。每个基团连接的位置通常取决于它们连接的顺序,因为先前连接的基团的活化/失活和指向活性会影响后续基团的连接位置。
当环上有多个官能团时,这些基团的影响会叠加,需要考虑它们总体的效应。通常情况下,这些效应是累加的。例如,甲苯(甲基苯)是弱活化剂。但对硝基甲苯同时具有甲基和硝基。甲基是弱活化剂,而硝基则是强失活剂,因此总体而言,该基团是高度失活的。然而,在指向方面,这两个取代基都指向同一个位置。甲基是邻/对位指向。硝基占据了对位,所以现在甲基只想要邻位指向。硝基是间位指向。硝基的间位也与甲基的邻位一致,所以这个效果会叠加,并且后续的取代基几乎全部会位于甲基的邻位。
如果两个官能团在指向方面不一致,则活化性更强的基团控制指向方向。也就是说,如果你是间硝基甲苯,你的大多数产物会倾向于在甲苯的邻/对位,而不是在硝基的间位,尽管硝基对整体活化有更强的影响。
当苯环上连接有多个取代基时,必须明确声明所有未直接连接到碳原子 1 的基团的位置。这可以通过列出基团连接的碳原子编号,然后用连字符和基团名称来实现。苯环的碳原子应根据先前确定的优先级进行编号,即溴的优先级高于硝基,硝基的优先级又高于醇或烷烃基团。基团的名称应按字母顺序排列,例如“2-甲基-5-硝基苯甲醛”。
