有机化学/芳香反应
与含有多个共轭双键的典型化合物相比,芳烃的反应性缺乏是值得注意的。例如,1,3,5-己三烯比己烷、己烯或任何己二烯的反应性都强得多。苯的反应性远低于这些化合物中的任何一种。在稀释的H2SO4水溶液存在下,任何烯烃都将很容易地转化为醇,但苯却呈惰性。类似地,烯烃很容易与卤素和卤化氢发生加成反应生成卤代烷烃,而卤素与苯发生取代反应,且仅在催化剂存在下进行。KMnO4或重铬酸溶液(通常为CrO3或K2Cr2O7)裂解烯烃的双键,生成酮或羧酸,但与苯完全不反应。然而,由于芳香化合物的稳定性,涉及这些化合物的反应具有极高的活化能,因为进入过渡态必然需要破坏芳香体系,导致芳香稳定能的暂时损失。苯及其衍生物通常通过亲电芳香取代反应而不是像非芳香化合物那样通过加成和消除反应进行反应。
Birch还原反应[1]是指芳香化合物在液氨中用钠还原的反应。它归因于化学家Arthur Birch。反应产物为1,4-环己二烯。金属也可以是锂或钾,氢原子由乙醇或叔丁醇等醇提供。

Birch还原反应的第一步是芳香环的一电子还原生成自由基阴离子。钠被氧化为钠离子Na+。该中间体能够二聚生成二阴离子。在醇存在下,第二个中间体是自由基,它吸收另一个电子形成碳负离子。该碳负离子从醇中夺取一个质子形成环己二烯。
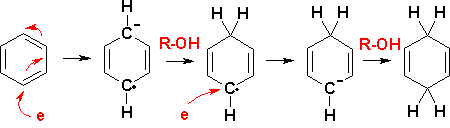
在卤代烷存在下,碳负离子还可以参与亲核取代反应,形成碳-碳键。在取代芳烃中,吸电子取代基(如羧酸)稳定碳负离子,并生成取代最少的烯烃。对于供电子取代基,则发生相反的效果。非共轭的1,4-加成产物比共轭的1,3-二烯更受青睐,这可以用最小运动原理来解释。也存在更易于处理的实验性碱金属替代品,例如M-SG还原剂。
由于苯是非极性的,它不能通过尿液排出,并且会留在体内直到被氧化。苯本身对健康没有危害,但为了排出体外,它会在肝脏中被细胞色素P-450氧化。这会产生苯氧化物,这是一种高度致畸和致癌的化合物。苯已被甲苯取代作为工业溶剂,因为甲苯可以被氧化为苯甲酸,苯甲酸对健康基本无害,并且很快就会排出体外。最近,苏打水中苯甲酸分解成苯和二氧化碳的问题也成为一个问题。
亲核取代反应是有机化学中的一种取代反应,其中亲核试剂取代了良好的离去基团,例如芳香环上的卤素。为了理解这种类型的反应,必须认识哪些化学基团是良好的离去基团,哪些不是。
离去基团可能最简单地被描述为从有机分子上脱落的原子或分子。官能团离开的能力称为不稳定性。离去基团影响整个分子的内在反应性,但仅在它们真正离开之前才会影响。
给定离去基团的共轭酸的pKa越低,该离去基团实际离开的能力就越强。这是因为这些基团可以很容易地稳定任何正在形成的负电荷,并且如果没有稳定,离去基团实际上会变成亲核试剂,导致反应在连接和分离形式之间毫无意义地循环。(这解释了为什么强碱几乎总是差的离去基团。)
在室温水中,不稳定性的顺序为
- 不稳定性较低
- 胺/酰胺 (NH2-)
- 烷氧基/醇负离子 (RO-)
- 羟基/氢氧根 (HO-)
- 羧酸根 (RCOO-)
- 氟/氟离子 (F-)
- 水 (H2O)
- 氯/氯离子 (Cl-)
- 溴/溴离子 (Br-)
- 碘/碘离子 (I-)
- 叠氮根 (N3-)
- 硫氰酸根 (SCN-)
- 硝基/亚硝酸根 (NO2)
- 氰基/氰离子 (CN-)
- 不稳定性较高
离去基团越好,亲核反应发生的速率就越快。这可以通过卤代烷之间的动力学比较来证明,其中溴化物比氯化物更快地解离,但碘化物比其他两者更快地解离。这是因为在发生亲核取代反应时,必须在某个时刻断开卤素与其最近的碳之间的键。例如,由于碘的相对较大的尺寸和相对较多的可电离电子,碘和碳之间的键比碳和氯之间的键更容易极化。水是比氢氧根更好的离去基团这一事实还具有重要的结果,即氢氧根离开的反应速率会因酸的存在而急剧增加,因为氢氧根会被质子化为水,而水是一种弱得多的亲核试剂。
芳香体系中通常会遇到三种亲核取代机理,即SNAr(加成-消除)机理、苯炔机理和自由基SRN1机理。其中最重要的机理是SNAr机理,其中吸电子基团激活环对亲核进攻,例如,如果硝基官能团位于卤代离去基团的邻位或对位。在有机化学入门课程的背景下,通常没有必要详细讨论这些类型。
亲电试剂是电子不足的粒子。因此,它们很可能与具有过量电子的物质发生反应。芳香族化合物在其离域的π轨道形式下具有更高的电子密度。
首先,亲电试剂与芳香环的离域轨道相互作用,形成π-络合物。
在这个阶段没有形成化学键。对于某些反应,已经发现了作为中间态的π-络合物形成的证据,但并非所有反应都有,因为π-络合物中的化学相互作用非常弱。
在π-络合物形成后,在电子受体存在下,会形成另一种络合物——σ-络合物。它是一种阳离子物种,一种缺乏芳香族性质的中间体,但其四个π电子在环上离域,这在一定程度上稳定了阳离子,有时允许其分离。一个例子是间三甲苯氟硼酸盐,它在低温下稳定,并通过间三甲苯(1,3,5-三甲基苯)与氟硼酸(BF3/HF)反应制备;该盐的阳离子是质子化的间三甲苯。σ-络合物也称为惠兰中间体。
在下一阶段,σ-络合物分解,释放氢阳离子并形成取代产物。

苯的另一个重要反应是卤化物的亲电取代,一种特定的亲电芳香取代类型。这些反应对于向芳香体系中添加取代基非常有用。反应速率随着卤素的亲电性而增加:因此,以这种方式进行的氟化反应太快且放热,不切实际,而碘则需要最剧烈的条件。在四种可能的卤化反应中,氯化和溴化在实验室中最常进行。卤代苯用于杀虫剂,以及其他产品的先驱。许多COX-2抑制剂含有卤代苯亚基。
一些高度活化的芳香族化合物,如苯酚和苯胺,反应性足够强,可以在没有催化剂的情况下进行卤化,但对于典型的苯衍生物(以及苯本身),在室温下没有催化剂的情况下,反应极其缓慢。通常,路易斯酸用作催化剂,它们通过帮助极化卤素-卤素键来发挥作用,从而降低一个卤素原子周围的电子密度,使其更具亲电性。最常用的催化剂是Fe或Al,或它们各自的氯化物和溴化物(+3氧化态)。如果三溴化铁和三氯化铁被任何存在的湿气(包括大气水蒸气)水解,它们就会失去催化活性。因此,它们是原位通过向溴或氯中加入铁屑来生成的。碘化反应在不同的条件下进行:通常使用高碘酸作为催化剂。在这些条件下,形成I+离子,它具有足够的亲电性来攻击环。碘化也可以通过重氮反应来完成。氟化最常使用这种技术进行,因为使用氟气既不方便,而且经常会使有机化合物断裂。
芳香族化合物的卤化与加成到烯烃或烷烃的自由基卤化不同,后者不需要路易斯酸催化剂。芳烃离子的形成导致芳香性的暂时丧失,总的结果是反应的活化能高于脂肪族化合物的卤化反应。
由于苯酚的解离,苯酚的卤化在极性溶剂中更快,因为苯氧基(-O-)基团比羟基本身具有更强的活化作用。
芳香磺化是一种有机反应,其中芳烃上的氢原子被磺酸官能团取代,该反应为亲电芳香取代。
这种反应的亲电试剂是三氧化硫(SO3),它可以从发烟硫酸(也称为发烟硫酸)中释放出来,本质上是溶解了三氧化硫气体的硫酸。
与芳香硝化和其他亲电芳香取代反应相比,芳香磺化是可逆的。磺化在强酸性条件下进行,脱磺化可以在加热和少量酸存在下发生。这也意味着可以在高温下实现热力学控制而不是动力学控制。因此,预计导向效应在确定高温磺化产物异构体比例方面不会发挥关键作用。
芳香族磺酸可以作为染料和许多药物制备的中间体。苯胺的磺化产生对氨基苯磺酸或磺胺酸,这是一种具有异常高熔点的两性离子化合物。这种化合物及其相关化合物的酰胺形成一大类磺胺类药物(一种抗生素)。
总反应:ArH + SO3 → ArSO3H
芳香族有机化合物的硝化通过亲电取代机理发生,该机理涉及富电子苯环被硝酰(硝基)离子攻击。苯通常通过在50°C下用浓硫酸和浓硝酸的混合物回流进行硝化。硫酸会再生,因此充当催化剂。
选择性始终是硝化反应中的一个挑战。芴酮硝化具有选择性,并且通过稍微调整反应条件即可得到三硝基化合物或四硝基化合物。另一个三硝化的例子可以在间苯三酚的合成中找到。其他硝化试剂包括硝酰四氟硼酸盐,它是一种真正的硝酰盐。该化合物可以由氢氟酸、硝酸和三氟化硼制备。芳香族硝基化合物是苯胺的重要中间体;后者可以通过还原剂的作用很容易地制备。
总反应:ArH + HNO3 → ArNO2 + H2O

傅-克反应,由法国生物碱化学家查尔斯·弗里德尔和他的美国合伙人詹姆斯·克莱夫茨于1877年发现,是路易斯酸催化的芳香族化合物的烷基化或酰基化。它们在实验室中用于形成芳香核与侧链之间的碳-碳键非常有用。
傅-克烷基化是芳香族化合物中亲电取代的一个例子。亲电试剂是在烷基卤化物与路易斯酸反应中形成的。路易斯酸使烷基卤化物分子极化,导致其烃部分带正电荷,从而变得更具亲电性。
CH3—Cl + AlCl3 → CH3+ + AlCl4−
或
CH3Cl + AlCl3 → CH3δ+Cl+Al−Cl3
(碳原子略微过量的正电荷,因为电负性氯原子将电子密度吸引到自身。氯原子带正电荷,因为它与铝原子形成了次级键。实际上,Cl原子失去了一个电子,而Al原子获得了一个电子。因此,Al原子带负电荷。)
极化的亲电试剂分子随后试图饱和其电子缺陷,并与富含π电子的芳香族化合物形成π络合物。形成π络合物不会导致芳香性的丧失。然而,在反应的下一阶段即σ络合物中,芳香性会消失。σ络合物中的正电荷均匀分布在苯环上。
C6H6 + CH3+ → C6H6+Br → C6H5Br + H+
σ络合物C6H6+Br可以分离(在低温下稳定),而π络合物则不能。
- 钝化官能团,如硝基(-NO2),通常会阻止反应以任何可观的速率发生,因此可以使用硝基苯等溶剂进行傅克烷基化反应。
- 伯和仲碳正离子比叔碳正离子稳定性差得多,因此当试图将伯和仲烷基引入环上时,通常会发生重排。因此,使用正丁基氯进行傅克烷基化会生成正丁基碳正离子,该碳正离子重排为叔丁基碳正离子,后者稳定性高得多,产物完全是叔丁基衍生物。在某些情况下,可以通过使用较弱的路易斯酸来避免这种情况。
- 傅克反应不能用于烷基化对酸敏感的化合物,包括许多杂环化合物。
- 限制傅克烷基化反应使用的另一个因素是多烷基化。由于烷基具有活化作用,取代的芳香族化合物比原始化合物更容易发生烷基化,因此尝试将苯甲基化以得到甲苯通常会得到大量的二甲苯和均三甲苯。通常的解决方法是先酰化(参见以下部分),然后将羰基还原为烷基。

傅克酰化反应与傅克烷基化反应一样,是亲电取代反应的经典例子。
与路易斯酸反应,酸的酸酐和酰氯会变得高度极化,并经常形成酰基正离子。
RCOCl + AlCl3 → RC+O + AlCl4-
酰化反应的机理与烷基化反应非常相似。
C6H6 + RC+O → C6H6—CO—R + H+
然后形成的酮与三氯化铝形成络合物,降低了其催化活性。
C6H6—CO—R + AlCl3 → C6H6—C+(R)—O—Al−Cl3
因此,酰化反应所需的催化剂量远大于烷基化反应。
- 虽然由于酰基正离子提供的共振稳定作用,碳正离子没有发生异构化,但某些碳正离子可能会失去CO,然后发生烷基化而不是酰化。例如,尝试将新戊酰基添加到芳香环上会导致碳正离子失去CO,然后形成叔丁基衍生物。
- 某些怕酸的芳香族化合物,如许多杂环化合物,不能在路易斯酸和酸酐的存在下存在。
- 甲酰氯不稳定,不能用于通过傅克酰化反应将甲酰基引入环中。相反,通常使用加特曼-科赫反应。
例如,傅克酰化反应用于由苯和邻苯二甲酸酐合成蒽醌。
在实验室合成中,在烷基化困难或不可能的情况下,通常使用傅克酰化反应代替烷基化反应,例如单取代烷基苯的合成。
- 邻茴香酸还原成2-庚基-2-己烯酮在《有机合成》中钝化间位版本文章
- 萘还原成1,4,5,8-四氢萘(异四氢萘)在《有机合成》中 文章。
- 邻二甲苯还原成1,2-二甲基-1,4-环己二烯在《有机合成》中 文章
- 苯甲酸还原成2,5-环己二烯-1-羧酸在《有机合成》中 文章
- ↑ * A. J. Birch, J. Chem. Soc. 1944, 430。


