生物化学原理/脂类生物合成
| 此页面已 导入 并需要去维基化. 书籍应该谨慎使用维基链接,并且只用于引用对理解内容至关重要的技术或深奥术语。大多数如果不是全部维基链接都应该被删除。请在页面去维基化后删除{{dewikify}}。 |
在动物中,当膳食碳水化合物供应过剩时,过量的碳水化合物会转化为三酰甘油。这包括从乙酰辅酶 A 合成脂肪酸,以及在三酰甘油的生产中酯化脂肪酸,这是一个称为脂肪生成的過程。脂肪酸由脂肪酸合成酶聚合然后还原乙酰辅酶 A 单位制成。脂肪酸中的酰基链通过添加乙酰基,将其还原为醇,将其脱水为烯烃基团,然后再次将其还原为烷烃基团的反应循环延长。脂肪酸生物合成的酶分为两组,在动物和真菌中,所有这些脂肪酸合成酶反应都由单个多功能蛋白进行,而在植物质体和细菌中,不同的酶执行途径中的每个步骤。脂肪酸随后可以转化为三酰甘油,这些三酰甘油包装在脂蛋白中,并从肝脏分泌。
不饱和脂肪酸的合成涉及一个脱饱和反应,其中在脂肪酰基链中引入一个双键。例如,在人类中,硬脂酰辅酶 A 去饱和酶 1 对硬脂酸的脱饱和会产生油酸。双不饱和脂肪酸亚油酸以及三不饱和 α-亚麻酸不能在哺乳动物组织中合成,因此是必需脂肪酸,必须从饮食中获取。三酰甘油合成在内质网中通过代谢途径进行,其中脂肪酰辅酶 A 中的酰基被转移到甘油 3 磷酸和二酰甘油的羟基上。
萜类和类异戊二烯,包括类胡萝卜素,是由来自活性前体异戊烯基焦磷酸和二甲基烯丙基焦磷酸的异戊二烯单元的组装和修饰制成的。这些前体可以通过不同的方式制备。在动物和古菌中,甲羟戊酸途径从乙酰辅酶 A 生产这些化合物,而在植物和细菌中,非甲羟戊酸途径使用丙酮酸和甘油醛 3 磷酸作为底物。一个使用这些活化的异戊二烯供体的重要反应是类固醇生物合成。在这里,异戊二烯单元连接在一起形成角鲨烯,然后折叠并形成一组环以形成羊毛甾醇。羊毛甾醇随后可以转化为其他类固醇,例如胆固醇和麦角甾醇[1]。
| 此页面可能需要通过引用可靠的出版物来 验证事实。 您可以通过添加对可靠出版物的引用或 更正 被引用为事实的陈述来提供帮助。 |
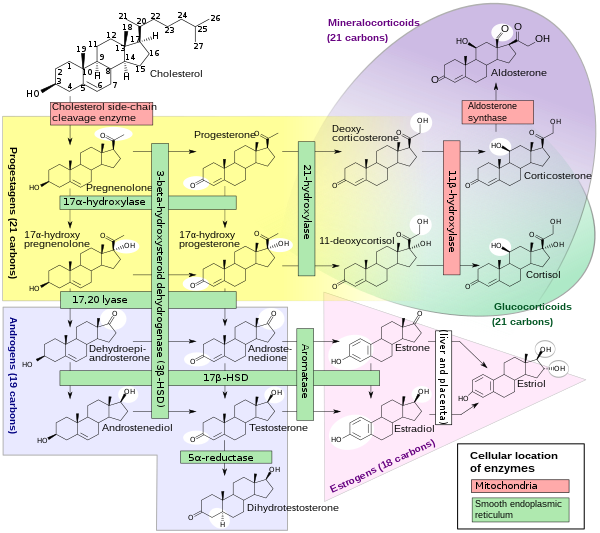
类固醇生物合成是一种合成代谢途径,它从简单的前体产生类固醇。这条途径在动物中的进行方式与许多其他生物不同,使这条途径成为抗生素和其他抗感染药物的常见目标。此外,人类的类固醇代谢是降胆固醇药物(如他汀类药物)的目标。它始于人类的甲羟戊酸途径,以乙酰辅酶 A 为构件,形成 DMAPP 和 IPP。在接下来的步骤中,DMAPP 和 IPP 形成羊毛甾醇,这是第一个类固醇。进一步的修饰属于随后的类固醇生成。类固醇生成是类固醇从胆固醇中生成并转化为其他类固醇的生物过程。类固醇生成的途径在不同的物种之间有所不同,但人类类固醇生成的途径如图所示。类固醇生成的产物包括:雄激素睾酮雌激素和孕酮皮质类固醇皮质醇醛固酮
睾酮生物合成 就像其他类固醇激素一样,睾酮衍生自胆固醇(见右图)。生物合成的第一步涉及 CYP11A 对胆固醇侧链的氧化裂解,CYP11A 是一种线粒体细胞色素 P450 氧化酶,损失了六个碳原子,形成了孕烯醇酮。在下一步中,CYP17A 酶在内质网中去除了另外两个碳原子,产生了各种 C19 类固醇。此外,3-羟基被 3-β-HSD 氧化,产生雄烯二酮。在最后一步和限速步骤中,雄烯二酮的 C-17 酮基被 17-β 羟基类固醇脱氢酶还原,生成睾酮。男性睾丸产生最多的睾酮(>95%)。它也以少得多的量在女性卵巢的卵泡膜细胞中合成,在胎盘中合成,以及在男女两性的肾上腺皮质网状带中合成。在睾丸中,睾酮由睾丸间质细胞产生。男性生殖腺还包含支持细胞,支持细胞需要睾酮才能进行精子生成。像大多数激素一样,睾酮通过血液供应给靶组织,在那里睾酮的大部分与特异性血浆蛋白结合,即性激素结合球蛋白 (SHBG)[2]。
合成代谢类固醇及其滥用 合成代谢类固醇 (AAS) 首次分离、鉴定和合成于 1930 年代,现在在医学中作为治疗药物用于刺激骨骼生长和食欲、诱导男性青春期以及治疗癌症和艾滋病等慢性消耗性疾病。合成代谢类固醇还会增加肌肉质量和力量,因此在运动和健美中被用来增强力量或体格。已知副作用包括胆固醇水平的危害变化(低密度脂蛋白升高,高密度脂蛋白降低)、痤疮、高血压、肝脏损伤。其中一些副作用可以通过补充药物来缓解。体育界 AAS 使用始于 1954 年 10 月,美国运动员的医生约翰·齐格勒与美国举重队一起前往维也纳。在那里,他遇到了一个俄罗斯物理学家,在“喝了几杯酒”后,反复问道:“你们给孩子们吃什么?”当齐格勒反问这个问题时,俄罗斯人说他自己的运动员正在服用睾酮。回到美国后,齐格勒尝试对自己的身体、美国教练鲍勃·霍夫曼以及两名举重运动员吉姆·帕克和亚兹·库扎拉进行了低剂量睾酮治疗。所有这些人都比任何训练计划所能产生的体重和力量增加得更多,但也有副作用。齐格勒寻找一种没有副作用的药物,并找到了合成代谢类固醇甲基睾丸酮(大力补,DBOL),该药物由西巴公司于 1958 年在美国制造。结果令人印象深刻——如此令人印象深刻,以至于举重运动员开始服用越来越多的药物。类固醇传播到其他需要体重的运动项目中。美国圣地亚哥闪电队的退役跑卫保罗·洛伊在 1970 年对加州立法委员会药物滥用小组说:“我们必须在午餐时间服用它们[类固醇]。他[官员]会把它们放在一个碟子上,给我们开处方,如果不服用,他就会暗示可能会被罚款。”奥运会统计数据显示,从 1956 年到 1972 年,推铅球运动员的体重增加了 14%,而障碍赛跑运动员的体重增加了 7.6%。金牌五项全能运动员玛丽·彼得斯说:“美国的一个医学研究小组试图对类固醇对举重运动员和投掷运动员的影响进行广泛的研究,但发现没有服用类固醇的人太少了,他们无法建立任何有价值的比较。”1984 年,杰伊·西尔维斯特,前四届奥运会选手和 1972 年铁饼银牌得主,当时在美国杨百翰大学体育系任职,对当年奥运会的参赛选手进行了询问。他发现类固醇使用范围从每天 10 毫克到 100 毫克不等[3]。
在比赛中使用违禁类固醇的著名案例是加拿大运动员本·约翰逊在 1988 年夏季奥运会上 100 米短跑中的胜利。随后,他在尿液中被检测出斯坦诺佐醇,因此未能通过药检。他后来承认使用过这种类固醇,以及雄烯二醇、环丙酸睾酮、呋喃唑酮和人生长激素等。因此,约翰逊被剥夺了金牌,也失去了打破世界纪录的认可。卡尔·刘易斯随后被提升一位,获得了奥运会金牌。刘易斯也跑出了当时的世界纪录,因此被认定为新的纪录保持者,然而,在 2003 年,美国奥委会(USOC)从 1991 年到 2000 年的禁药控制管理主管韦德·埃克斯姆博士向《体育画报》提供了一些文件,这些文件揭示了大约 100 名美国运动员未能通过药检,本应被禁止参加奥运会,但他们却被允许参赛。这些运动员中就包括卡尔·刘易斯。刘易斯随后打破沉默,回应了他受益于禁药掩盖的指控,承认自己曾被检测出违禁物质阳性,但声称他只是“数百名”被美国奥委会隐瞒,从而得以逃脱禁赛的美国运动员之一。刘易斯现在已经承认,他在 1988 年美国奥运会选拔赛中三次检测出违禁物质阳性,根据当时的国际规则,他应该被禁止参加两个月后的汉城奥运会。
前运动员和官员纷纷谴责美国奥委会的掩盖行为。“我经历了那么多年。我知道这件事在发生,但作为一名运动员,你无能为力。你必须相信管理机构会履行他们的职责。很明显,他们没有做到,”前美国短跑运动员、1984 年奥运会冠军埃夫林·阿什福德说。
皮质醇的生物合成
皮质醇是由胆固醇合成的。合成发生在肾上腺皮质的束状带。(皮质醇的名字来源于皮质。)虽然肾上腺皮质也产生醛固酮(在球状带)和一些性激素(在网状带),但皮质醇是其主要分泌物。肾上腺髓质位于皮质下方,主要分泌肾上腺素和去甲肾上腺素,这两种儿茶酚胺在交感神经刺激下分泌。肾上腺中皮质醇的合成是由垂体前叶的促肾上腺皮质激素(ACTH)刺激的;ACTH 的产生反过来又受到下丘脑分泌的促肾上腺皮质激素释放激素(CRH)的刺激。ACTH 通过调节 STAR(类固醇生成急性调节)蛋白,增加内线粒体膜中胆固醇的浓度。它还刺激皮质醇合成中主要的限速步骤,在这个步骤中,胆固醇被转化为孕烯醇酮,并由细胞色素 P450SCC(侧链裂解酶)催化。
胆固醇合成
[edit | edit source]所有动物细胞都会合成胆固醇,合成速率因细胞类型和器官功能而异。大约 20-25% 的每日总胆固醇合成发生在肝脏;其他合成速率较高的部位包括肠道、肾上腺和生殖器官。体内合成从一个乙酰辅酶 A 分子和一个乙酰乙酰辅酶 A 分子开始,它们脱水形成 3-羟基-3-甲基戊二酰辅酶 A (HMG-CoA)。然后,该分子在酶 HMG-CoA 还原酶的作用下被还原为甲羟戊酸。这一步骤是胆固醇合成中受调节的、限速的和不可逆的步骤,也是他汀类药物(HMG-CoA 还原酶竞争性抑制剂)的作用位点。然后甲羟戊酸在三个需要 ATP 的反应中被转化为 3-异戊烯基焦磷酸。该分子被脱羧为异戊烯基焦磷酸,它是各种生物反应的关键代谢物。三个异戊烯基焦磷酸分子通过香叶基转移酶的作用,缩合成法呢基焦磷酸。然后,两个法呢基焦磷酸分子通过内质网中角鲨烯合酶的作用缩合成角鲨烯。氧化角鲨烯环化酶随后将角鲨烯环化为羊毛固醇。最后,羊毛固醇被转化为胆固醇。康拉德·布洛赫和费奥多尔·莱宁因其在胆固醇和脂肪酸代谢机制和调节方面的发现而共同获得了 1964 年诺贝尔生理学或医学奖[4]。
胆固醇的生物合成受现有胆固醇水平的直接调节,尽管所涉及的稳态机制只是部分被理解。从食物中摄入更多的胆固醇会导致内源性合成净减少,而从食物中摄入的胆固醇较少则会产生相反的效果。主要的调节机制是内质网中蛋白质 SREBP(固醇调节元件结合蛋白 1 和 2)感知细胞内胆固醇。在存在胆固醇的情况下,SREBP 与另外两个蛋白质结合:SCAP(SREBP 裂解激活蛋白)和 Insig1。当胆固醇水平下降时,Insig-1 会从 SREBP-SCAP 复合体中分离出来,允许该复合体迁移到高尔基体,在那里 SREBP 被 S1P 和 S2P(位点 1 和 2 蛋白酶)裂解,这两种酶在胆固醇水平低时由 SCAP 激活。然后,裂解的 SREBP 迁移到细胞核,作为转录因子与 SRE(固醇调节元件)结合,从而刺激许多基因的转录。其中包括低密度脂蛋白 (LDL) 受体和 HMG-CoA 还原酶。前者从血液中清除循环的 LDL,而后者会导致胆固醇内源性合成的增加。迈克尔·S·布朗博士和约瑟夫·L·戈德斯坦博士在 1970 年代阐明了这一信号通路的大部分内容。1985 年,他们因其研究成果获得了诺贝尔生理学或医学奖。他们随后的研究表明,SREBP 通路如何调节许多基因的表达,这些基因控制着脂质的形成和代谢以及身体燃料的分配。当胆固醇水平高时,胆固醇合成也可以被关闭。HMG CoA 还原酶既包含胞质结构域(负责其催化功能),也包含膜结构域。膜结构域的功能是感知其降解的信号。胆固醇(和其他固醇)浓度的增加会导致该结构域寡聚化状态的改变,使其更容易被蛋白酶体破坏。该酶的活性也可以被 AMP 激活蛋白激酶的磷酸化降低。由于这种激酶被 AMP 激活,而 AMP 是在 ATP 水解时产生的,因此当 ATP 水平低时,胆固醇合成就会停止[5]。
类异戊二烯或萜类化合物的生物合成
[edit | edit source]
有两种代谢途径可以产生萜类化合物
甲羟戊酸途径 许多生物体通过 HMG-CoA 还原酶途径合成萜类化合物,该途径也产生胆固醇。反应发生在胞质溶胶中。该途径是在 1950 年代被发现的。
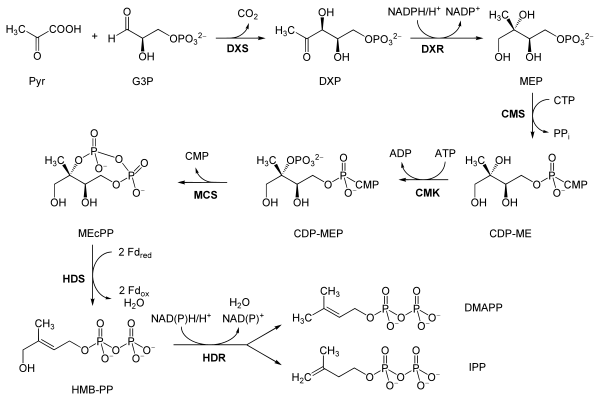
MEP/DOXP 途径 2-C-甲基-D-赤藓醇 4-磷酸/1-脱氧-D-木糖醇 5-磷酸途径 (MEP/DOXP 途径),也称为 [非甲羟戊酸途径] 或甲羟戊酸独立途径,发生在植物和顶复门原生动物的质体中,以及许多细菌中。它是在 1980 年代后期被发现的。丙酮酸和甘油醛 3-磷酸在 DOXP 合酶 (Dxs) 的作用下转化为 1-脱氧-D-木糖醇 5-磷酸,在 DOXP 还原酶 (Dxr, IspC) 的作用下转化为 2-C-甲基-D-赤藓醇 4-磷酸 (MEP)。随后发生的三个反应步骤,由 4-二磷酸胞苷-2-C-甲基-D-赤藓醇合酶 (YgbP, IspD)、4-二磷酸胞苷-2-C-甲基-D-赤藓醇激酶 (YchB, IspE) 和 2-C-甲基-D-赤藓醇 2,4-环二磷酸合酶 (YgbB, IspF) 催化,介导 2-C-甲基-D-赤藓醇 2,4-环焦磷酸 (MEcPP) 的形成。最后,MEcPP 在 HMB-PP 合酶 (GcpE, IspG) 的作用下被转化为 (E)-4-羟基-3-甲基-丁-2-烯基焦磷酸 (HMB-PP),HMB-PP 在 HMB-PP 还原酶 (LytB, IspH) 的作用下被转化为异戊烯基焦磷酸 (IPP) 和二甲基烯丙基焦磷酸 (DMAPP)。IPP 和 DMAPP 是两种途径的最终产物,是异戊二烯、单萜类化合物 (10-碳)、二萜类化合物 (20-碳)、类胡萝卜素 (40-碳)、叶绿素和质体醌-9 (45-碳) 的前体。所有高级萜类化合物的合成都是通过形成香叶基焦磷酸 (GPP)、法呢基焦磷酸 (FPP) 和香叶基香叶基焦磷酸 (GGPP) 进行的。虽然 MVA 和 MEP 两种途径在大多数生物体中是相互排斥的,但据报道它们之间存在相互作用,存在于植物和少数细菌物种中。
| 生物体 | 途径 |
|---|---|
| 细菌 | MVA 或 MEP |
| 古细菌 | MVA |
| 绿 藻类 | MEP |
| 植物 | MVA 和 MEP |
| 动物 | MVA |
| 真菌 | MVA |
经典的 [甲羟戊酸途径或 HMG-CoA 还原酶 途径是所有高等真核生物和许多细菌中存在的重要细胞代谢途径。它对于产生 IPP 和 DMAPP 至关重要,它们是生物合成各种分子的基础,这些分子用于各种不同的过程中,例如蛋白质 预酰化、细胞膜 维持、激素、蛋白质锚定 和 N-糖基化。
与经典的甲羟戊酸途径异戊二烯生物合成不同,植物和如疟疾寄生虫的顶复门原生动物能够通过另一种途径,即非甲羟戊酸途径,在它们的质体中产生异戊二烯(萜类)。[6] 此外,大多数包括重要病原体如结核分枝杆菌的细菌通过非甲羟戊酸途径合成IPP和DMAPP。
{{cite journal}}: CS1 maint: uses authors parameter (link) 请注意,该来源使用的酶名称和缩写既不全面也不标准(参见Eisenreich W, Bacher A, Arigoni D, Rohdich F (2004). "Biosynthesis of Isoprenoids Via the Non-mevalonate Pathway". Cell. Mol. Life Sci. 61 (12): 1401–26. doi:10.1007/s00018-004-3381-z. PMID 15197467. Retrieved March 23, 2017.{{cite journal}}: CS1 maint: multiple names: authors list (link));因此,图像内容必须与三个相关门/界中任何一个途径的标准酶名称和缩写相协调。有关说明,请参阅英文维基百科的“非甲羟戊酸途径”文章。二十碳烷类生物合成
[edit | edit source]有两类酶催化脂肪酸氧合生成二十碳烷类
二十碳烷类不会储存在细胞内,而是按需合成。它们来源于构成细胞膜和核膜的脂肪酸。
二十碳烷类生物合成始于细胞被机械损伤、细胞因子、生长因子或其他刺激激活。(刺激甚至可能是来自邻近细胞的二十碳烷类;这些途径很复杂。)这会触发磷脂酶在细胞膜上的释放。磷脂酶会移动到核膜。在那里,磷脂酶催化磷脂(通过A2)或二酰基甘油(通过磷脂酶C)的酯水解。这会释放一个20碳必需脂肪酸。这种水解似乎是二十碳烷类形成的限速步骤。
脂肪酸可能会被几种磷脂酶中的任何一种释放。其中,IV型胞质磷脂酶A2(cPLA2)是关键角色,因为缺乏cPLA2的细胞通常没有二十碳烷类合成。磷脂酶cPLA2专门针对在SN2位置包含AA、EPA或GPLA的磷脂。有趣的是,cPLA2也可能释放成为血小板活化因子的溶血磷脂。[7]
过氧化和活性氧物质
[edit | edit source]接下来,游离脂肪酸通过多种途径之一被氧合;请参见途径表。二十碳烷类途径(通过脂氧合酶或COX)会添加分子氧(O2)。尽管脂肪酸是对称的,但由此产生的二十碳烷类是手性的;氧化过程具有很高的立体专一性。
脂类的氧化对细胞有害,尤其是在靠近细胞核时。存在着防止意外氧化的复杂机制。COX、脂氧合酶和磷脂酶受到严格控制——至少有八种蛋白质被激活以协调白三烯的生成。其中许多存在于多个亚型中。[8]
通过COX或脂氧合酶的氧化会释放活性氧物质(ROS),而二十碳烷类生成中的初始产物本身就是高反应性的过氧化物。LTA4可以与组织DNA形成加合物。脂氧合酶的其他反应会导致细胞损伤;鼠属模型将15-脂氧合酶与动脉粥样硬化的发病机制联系起来。[9][10] 二十碳烷类生成中的氧化被分隔开;这限制了过氧化物的损伤。二十碳烷类生物合成酶(例如谷胱甘肽-S-转移酶、环氧化物水解酶和载体蛋白)属于家族,其功能主要与细胞解毒有关。这表明二十碳烷类信号传导可能起源于ROS的解毒。
细胞必须从在其细胞核附近生成脂类氢过氧化物中获得一些益处。PG和LT可能在那里发出信号或调节DNA转录;LTB4是过氧化物酶体增殖物激活受体α的配体。(参见PPAR的示意图。)

|
|

| |
| 前列腺素E1。5元环是该类的特征。 | 血栓烷A2。氧 已经移入环中。 |
白三烯B4。请注意3个共轭双键。 | |

|

| ||
| 前列环素I2。第二个环将其与前列腺素类区分开来。 | 白三烯E4,一种半胱氨酰白三烯的例子。 | ||

环氧合酶 (COX) 通过两步过程催化游离必需脂肪酸转化为前列腺素。第一步,两个O2分子作为两个过氧化物键添加,并在脂肪酸链的中间附近形成一个五元碳环。这形成了短寿命、不稳定的中间体前列腺素G(PGG)。其中一个过氧化物键脱落一个氧原子,形成PGH。(参见环氧合酶中的图表和更多细节)。所有其他前列腺素都源自PGH(作为PGH1、PGH2或PGH3)。
图1显示了PGH2(来自花生四烯酸)是如何转化的

三类前列腺素在分子中心具有不同的环。它们的结构不同。PGH化合物(所有其他化合物的母体)具有一个五元环,由两个氧原子桥接(一个过氧化物)。衍生的前列腺素包含一个单一的、不饱和的五元环。在血栓烷中,环变成一个包含一个氧原子的六元环。
细菌和病毒感染中PGE2的产生似乎是由某些细胞因子(例如白介素-1)刺激的。[7]
白三烯是在细胞中由花生四烯酸通过5-脂氧合酶合成的。催化机制涉及在花生四烯酸骨架的特定位置插入一个氧基。脂氧合酶途径在白细胞中是活跃的,包括肥大细胞、嗜酸性粒细胞、中性粒细胞、单核细胞和嗜碱性粒细胞。当这些细胞被激活时,花生四烯酸从细胞膜磷脂中释放出来,由磷脂酶A2释放,并由5-脂氧合酶激活蛋白(FLAP)提供给5-脂氧合酶。5-脂氧合酶(5-LO)利用FLAP将花生四烯酸转化为5-羟过氧化二十碳四烯酸(5-HPETE),5-HPETE自发还原为5-羟二十碳四烯酸(5-HETE)。酶5-LO再次作用于5-HETE,将其转化为白三烯A4(LTA4),一种不稳定的环氧化合物。在具有LTA4水解酶的细胞中,例如中性粒细胞和单核细胞,LTA4被转化为二羟基酸白三烯LTB4,它是一种强大的中性粒细胞趋化剂,作用于这些细胞质膜上的BLT1和BLT2受体。在表达LTC4合成酶的细胞中,例如肥大细胞和嗜酸性粒细胞,LTA4与三肽谷胱甘肽结合,形成第一个半胱氨酰白三烯LTC4。在细胞外,LTC4可以通过普遍存在的酶依次转化为LTD4和LTE4,它们保留生物活性。半胱氨酰白三烯作用于靶细胞上的细胞表面受体CysLT1和CysLT2,导致支气管和血管平滑肌收缩,增加小血管的通透性,增强气道和肠道的粘液分泌,并招募白细胞到炎症部位。LTB4和半胱氨酰白三烯(LTC4、LTD4、LTE4)都在局部组织中部分降解,最终在肝脏中成为无活性的代谢物。
环氧合酶(COX)
COX将花生四烯酸(AA,一个ω-6 PUFA)转化为前列腺素H2(PGH2),它是系列-2前列腺素的前体。该酶包含两个活性位点:具有过氧化物酶活性的血红素,负责将PGG2还原为PGH2,以及环氧合酶位点,花生四烯酸在该位点被转化为氢过氧化内过氧化物前列腺素G2(PGG2)。反应通过过氧化物酶活性位点产生的酪氨酸自由基从花生四烯酸中夺取H原子进行。然后两个O2分子与花生四烯酸自由基反应,生成PGG2。目前,已知三种COX同工酶:COX-1、COX-2和COX-3。COX-3是COX-1的剪接变体,保留了内含子1,并具有移码突变;因此有些人更喜欢使用COX-1b或COX-1变体(COX-1v)这个名字。[3] 不同的组织表达不同水平的COX-1和COX-2。尽管这两种酶在基本作用上相同,但选择性抑制在副作用方面会产生差异。COX-1被认为是组成型酶,存在于大多数哺乳动物细胞中。另一方面,COX-2在大多数正常组织中是无法检测到的。它是一种诱导型酶,在激活的巨噬细胞和其他炎症部位的细胞中变得丰富。最近,研究表明它在各种癌症中被上调,并在肿瘤发生中发挥核心作用。COX-1和-2(也称为PGHS-1和-2)也会氧化另外两种必需脂肪酸——DGLA(ω-6)和EPA(ω-3)——生成系列-1和系列-3前列腺素,这些前列腺素的炎症性比系列-2弱。DGLA和EPA是COX途径中AA的竞争性抑制剂。这种抑制是膳食来源的DGLA和EPA(例如,琉璃苣油、鱼油)减少炎症的主要作用方式。使用合成代谢类固醇现在被所有主要体育组织禁止,包括ATP、WTA、ITF、国际奥委会、国际足联、欧洲足联、所有主要职业高尔夫巡回赛、国家曲棍球联盟、美国职业棒球大联盟、美国国家篮球协会、欧洲田径协会、WWE和NFL。然而,药物检测可能存在巨大的差异,在某些情况下,并没有得到执行。
胆汁酸是主要存在于哺乳动物胆汁中的类固醇酸。胆汁盐是胆汁酸与阳离子(通常是钠)结合形成的。在人类中,牛磺胆酸和甘氨胆酸(胆酸的衍生物)的盐类约占所有胆汁盐的百分之八十。两种主要的胆汁酸是胆酸和鹅去氧胆酸。胆汁酸、甘氨酸和牛磺酸结合物以及7-α-脱羟基衍生物(脱氧胆酸和石胆酸)都存在于人类肠道胆汁中。胆汁酸分泌量的增加表现为胆汁流量的增加。胆汁酸的主要功能是促进胆汁酸的形成,促进胆汁酸的形成,促进膳食脂肪的加工。
胆汁酸是在肝脏中通过细胞色素P450介导的胆固醇氧化生成的。它们与牛磺酸或氨基酸甘氨酸结合,或与硫酸或葡萄糖醛酸结合,然后储存在胆囊中,胆囊通过去除水来浓缩盐类。在人类中,限速步骤是在类固醇核的7位添加一个羟基,由酶胆固醇7α-羟化酶催化。进食后,胆囊中的内容物分泌到肠道中,在那里,胆汁酸起乳化膳食脂肪的作用。胆汁酸还有其他功能,包括从体内消除胆固醇,驱动胆汁流动以消除肝脏中的分解代谢物,乳化肠道中的脂类和脂溶性维生素以形成可以被乳糜管系统运输的胶束,以及帮助减少小肠和胆道中发现的细菌菌群。
胆汁酸指的是质子化(-COOH)形式。胆汁盐指的是去质子化或离子化(-COO-)形式。结合胆汁酸在乳化脂肪方面更有效,因为在肠道pH下,它们的离子化程度比未结合胆汁酸更高。[11]
胆汁酸的合成是除人类以外大多数物种中胆固醇代谢的主要途径。人体每天产生约800毫克的胆固醇,其中约一半用于胆汁酸合成。总共约20-30克胆汁酸每天分泌到肠道中。约90%的排泄胆汁酸被主动运输在回肠中重新吸收,并循环利用,称为肠肝循环,将胆汁盐从肠道系统转移回肝脏和胆囊。这使得每天的合成率很低,但对消化系统的高分泌率。胆汁还用于将脂肪球分解成微小的液滴。屠宰动物的胆汁可以用于制皂。
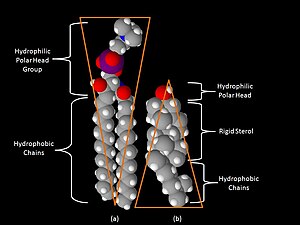
磷脂 磷脂和糖脂由两条长的非极性 (疏水) 烃链 连接到一个 亲水 头部基团。
磷脂的头部是 磷酸化 的,它们由以下任一种组成:
- 甘油(因此该类脂类被称为磷酸甘油酯)。
- 鞘氨醇(只有一个成员 - 鞘磷脂)。
糖脂 糖脂的头部包含一个 鞘氨醇,其上连接着 一个或多个糖单元。疏水链属于以下任一种:
脂肪酸 磷脂和糖脂中的脂肪酸通常含有偶数个 碳 原子,通常在 14 到 24 之间。16 碳和 18 碳 FA 是最常见的。FA 可以是饱和的或不饱和的,双键 的构型几乎总是顺式。FA 链的长度和 不饱和度 对膜的 流动性 有着深远的影响。
磷酸甘油酯 在磷酸甘油酯中,甘油的 C-1 和 C-2 位的羟基酯化为 FA 的羧基。C-3 羟基酯化为磷酸。所得化合物称为 磷脂酸,是最简单的 磷酸甘油酸。膜中只有少量磷脂酸。然而,它是其他磷酸甘油酯 生物合成 中的关键中间体。
鞘氨醇 鞘氨醇是一种氨基醇,含有长 不饱和 烃链。在鞘磷脂和糖脂中,鞘氨醇的氨基通过一个 酰胺 键连接到 FA。在鞘磷脂中,鞘氨醇的伯 羟基 酯化为磷酰 胆碱。在糖脂中,糖成分连接到该基团。最简单的糖脂是 脑苷脂,其中只有一个糖残基,可以是 Glc 或 Gal。更复杂的糖脂,如 神经节苷脂,包含多达七个糖残基的支链。
-
鞘氨醇 - IUPAC 名称:(2S,3R)-2-氨基十八碳-4-烯-1,3-二醇
鞘氨醇由棕榈酰辅酶 A 和丝氨酸通过缩合反应合成,该反应需要生成 脱氢鞘氨醇。
-
鞘氨醇由棕榈酰辅酶 A 和丝氨酸通过缩合反应合成,该反应需要生成脱氢鞘氨醇
脱氢鞘氨醇随后被 NADPH 还原为 二氢鞘氨醇(鞘氨胺),最后被 FAD 氧化为鞘氨醇。
没有从 鞘氨胺 到鞘氨醇的直接合成途径;它必须先被酰化成 二氢神经酰胺,然后脱氢成神经酰胺。鞘氨醇是通过溶酶体中鞘脂的降解形成的。
胆固醇
胆固醇 天然存在于 真核生物 细胞膜 中,它在那里通过 甲羟戊酸 经 萜类 的角鲨烯环化作用生物合成。它优先与 鞘脂(见图)相关联,在真核细胞膜的富胆固醇 脂筏 区域中。[12] 藿烷类在原核生物中发挥着类似的功能。
细胞膜需要高水平 - 通常整个膜中平均 20% 的胆固醇分子,在脂筏区域局部增加至 50% 的胆固醇(-% 是分子比率)[13] 脂筏 的形成促进了外周和 跨膜蛋白 的聚集,包括 SNARE 和 VAMP 蛋白的停靠。[14]
古细菌膜
[edit | edit source]
古细菌膜是由与其他生命形式中的分子截然不同的分子组成的,这表明古细菌与细菌和真核生物的关系仅是遥远的。[15] 在所有生物体中,细胞膜 由称为 磷脂 的分子组成。这些分子同时具有溶于水的 极性 部分(磷酸“头部”),和不溶于水的“油腻”非极性部分(脂尾)。这些不同的部分通过 甘油 部分连接在一起。在水中,磷脂会聚集在一起,头部朝向水,尾部背离水。细胞膜中的主要结构是这些磷脂的双层,称为 脂双层[16]。
这些磷脂在以下四个方面不同寻常
- 细菌和真核生物的膜主要由甘油-酯 脂类 组成,而古细菌的膜由甘油-醚脂类 组成。[17] 不同之处在于连接脂类与甘油部分的键类型;两种类型在右侧图中以黄色显示。在酯脂类中,这是一个 酯键,而在醚脂类中,这是一个 醚键。醚键比酯键在化学上更稳定。这种稳定性可能有助于古细菌在极端温度和非常 酸性 或 碱性 的环境中存活。[18] 细菌和真核生物确实包含一些醚脂类,但与古细菌不同,这些脂类不是其膜的主要部分。
- 立体化学 甘油部分与其他生物体中发现的相反。甘油部分可以存在两种形式,它们是彼此的镜像,称为右手和左手形式;在化学中,它们被称为对映异构体。就像右手不能轻松地戴进左手的皮手套一样,右手甘油分子通常不能被适应左手形式的 酶 使用或制造。这表明古细菌使用与细菌和真核生物完全不同的酶来合成磷脂。这些酶在生命历史的早期发展,表明早期与其他两个域分离。[15]
- 古细菌的脂类尾部在化学上与其他生物不同。古细菌的脂类以异戊二烯侧链为基础,是具有多个侧支的长链,有时甚至有环丙烷或环己烷环。[19] 这与其他生物膜中发现的脂肪酸形成对比,脂肪酸具有没有支链或环的直链。尽管异戊二烯在许多生物的生物化学中起着重要作用,但只有古细菌使用它们来制造磷脂。这些支链可能有助于防止古细菌膜在高温下泄漏。[20]
- 在一些古细菌中,脂质双层膜被单层膜取代。实际上,古细菌将两个独立的磷脂分子的尾部融合成一个具有两个极性头的单一分子;这种融合可能使它们的膜更加坚固,并更好地抵抗恶劣的环境。[21] 例如,铁质菌属中的脂类就是这种类型,人们认为这有助于该生物在其高酸性栖息地中生存。[22]
萜类生物合成
[edit | edit source]

萜类在生物合成上衍生自异戊二烯单元,异戊二烯的分子式为C5H8。萜类的基本分子式是该分子式的倍数,(C5H8)n,其中n是连接的异戊二烯单元的数目。这被称为异戊二烯规则或C5规则。异戊二烯单元可以“头尾相连”连接在一起形成线性链,也可以排列成环状结构。可以将异戊二烯单元视为自然界中常见的结构单元之一。
异戊二烯本身不会参与构建过程,而是活化的形式,即异戊烯焦磷酸(IPP,也称为异戊烯二磷酸)和二甲基烯丙基焦磷酸(DMAPP,也称为二甲基烯丙基二磷酸)是生物合成途径中的组成部分。IPP由乙酰辅酶A通过HMG-CoA还原酶途径中甲羟戊酸的中间体形成。在一些细菌类群和植物的质体中,已知IPP的另一种完全无关的生物合成途径,即所谓的MEP(2-甲基-D-赤藓糖醇-4-磷酸)途径,该途径从C5-糖开始。在这两个途径中,IPP通过异戊烯焦磷酸异构酶被异构化为DMAPP。
 |
 |
随着异戊二烯单元链的增长,形成的萜类按照大小依次分类为半萜、单萜、倍半萜、二萜、倍二萜、三萜和四萜[23]。
甲羟戊酸途径和他汀类药物
[edit | edit source]甲羟戊酸途径或HMG-CoA还原酶途径或甲羟戊酸依赖性(MAD)途径或类异戊二烯途径是存在于所有高等真核生物和许多细菌中的重要细胞代谢途径。它对产生二甲基烯丙基焦磷酸(DMAPP)和异戊烯焦磷酸(IPP)非常重要,它们作为生物合成各种分子(用于萜类合成、蛋白质预烯化、细胞膜维持、激素、蛋白质锚定和N-糖基化等多种过程)的基础。它也是类固醇生物合成的组成部分[24]。
在激活SREBP(固醇调节元件结合蛋白-1和-2)后,可以通过DNA转录调节激活几种关键酶。这种细胞内传感器检测低胆固醇水平,并通过HMG-CoA还原酶途径刺激内源性胆固醇产生,以及通过上调LDL受体来增加脂蛋白的摄取。该途径的调节还通过控制mRNA的翻译速率、还原酶的降解和磷酸化来实现。
| 反应 | 图示 | 酶 |
| 乙酰辅酶A(柠檬酸循环)通过乙酰辅酶A转移酶与另一个乙酰辅酶A亚基发生缩合,形成乙酰乙酰辅酶A | 硫解酶 | |
| 乙酰辅酶A与乙酰乙酰辅酶A缩合,形成3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)。 | HMG-CoA合成酶 | |
| HMG-CoA通过NADPH被还原为甲羟戊酸。该反应发生在胞质溶胶中。它是胆固醇合成的限速步骤,因此催化该反应的酶是他汀类药物的目标。 |  |
HMG-CoA还原酶 |
| 甲羟戊酸到5-磷酸甲羟戊酸。 |  |
甲羟戊酸激酶 |
| 5-磷酸甲羟戊酸到5-焦磷酸甲羟戊酸。 | 磷酸甲羟戊酸激酶 | |
| 甲羟戊酸-5-焦磷酸到3-异戊烯焦磷酸(IPP)(另见HIDS)。 |  |
甲羟戊酸-5-焦磷酸脱羧酶 |
| 3-异戊烯焦磷酸被异构化为二甲基烯丙基焦磷酸。 |  |
异戊烯焦磷酸异构酶 |

1971年,日本生物化学家远藤章在制药公司三共工作期间,开始寻找降低胆固醇的药物。研究已经表明,胆固醇主要由肝脏通过一种称为HMG-CoA还原酶的酶在体内合成。远藤及其团队推断,某些微生物可能产生该酶的抑制剂来防御其他生物,因为甲羟戊酸是许多生物维持其细胞壁(麦角固醇)或细胞骨架(类异戊二烯)所需物质的前体。他们识别的第一个药物是麦维菌素(ML-236B),这是由真菌青霉菌属中的一种真菌产生的分子。记者约翰·西蒙斯在《财富》杂志上写道,这一发现的消息很快在医学界传开,同时传言也暗示了这种他汀类药物与实验室犬的肿瘤、肌肉退化以及有时死亡有关。几家制药公司都被这些报道吓退了,但默克公司的首席科学家兼后来的首席执行官P·罗伊·瓦格洛斯表现出了兴趣,并从1975年开始多次前往日本。到1978年,默克已经从真菌曲霉属中分离出洛伐他汀(mevinolin,MK803),该药物于1987年首次以美降脂的名称上市。胆固醇与心血管疾病之间的联系,即脂质假说,已经被提出。胆固醇是动脉粥样硬化中动脉壁脂肪块(动脉粥样硬化斑块)的主要成分,当这些斑块破裂时,会引起绝大多数的心脏病发作。治疗主要包括膳食措施,例如低脂肪饮食,以及难以耐受的药物,例如氯贝特、考来烯胺和烟酸。胆固醇研究员丹尼尔·斯坦伯格写道,虽然1984年的冠心病一级预防试验表明,降低胆固醇可以显著降低心脏病发作和心绞痛的风险,但包括心脏病专家在内的医生仍然持怀疑态度。为了有效地将他汀类药物推向市场,默克必须让人们相信高胆固醇的危害,以及他汀类药物的安全性和延长寿命的效果。由于公众宣传的成果,人们开始熟悉自己的胆固醇数值,以及“好”胆固醇和“坏”胆固醇之间的区别,而竞争对手制药公司也开始生产自己的他汀类药物,例如普伐他汀(普罗卡,Pravachol),由三共和百时美施贵宝公司生产。1994年4月,默克公司赞助的一项研究,即“斯堪的纳维亚辛伐他汀生存研究”或“4S”的结果公布。研究人员对4,444名患有高胆固醇和心脏病的患者进行了辛伐他汀(后来由默克公司以卓维尔的名称销售)的测试。5年后,研究得出结论,患者的胆固醇降低了35%,死于心脏病发作的可能性降低了42%。1995年,卓维尔和美降脂都为默克公司带来了超过10亿美元的收入。远藤章获得了2006年日本奖和2008年拉斯克-德贝基临床医学研究奖。他汀类药物通过竞争性抑制HMG-CoA还原酶(HMG-CoA还原酶途径中的第一个关键酶)发挥作用。由于他汀类药物在分子水平上与HMG-CoA相似,因此它们取代了HMG-CoA在酶中的位置,并降低了其产生甲羟戊酸(最终产生胆固醇以及其他一些化合物的级联反应中的下一个分子)的速率。这最终通过几种机制降低了胆固醇[25]。
他汀类药物的作用机制
[edit | edit source]抑制胆固醇合成 抑制HMG-CoA还原酶,他汀类药物会阻断肝脏合成胆固醇的途径。这一点很重要,因为大多数循环胆固醇来自内部制造而不是饮食。当肝脏不再能产生胆固醇时,血液中的胆固醇水平就会下降。胆固醇合成似乎主要在夜间发生,因此半衰期短的他汀类药物通常在晚上服用,以最大限度地发挥其作用。研究表明,在晚上服用短效辛伐他汀比在早上服用能更好地降低低密度脂蛋白胆固醇和总胆固醇,但在长效阿托伐他汀中没有发现差异。
增加低密度脂蛋白摄取 肝细胞感知到肝脏胆固醇水平下降,并试图通过合成低密度脂蛋白受体来补偿,从而从循环中吸取胆固醇。这是通过蛋白酶完成的,蛋白酶裂解一种称为“膜结合固醇调节元件结合蛋白”的蛋白质,该蛋白质迁移到细胞核并导致各种其他蛋白质和酶的产生增加,包括低密度脂蛋白受体。然后,低密度脂蛋白受体重新定位到肝细胞膜,并与经过的低密度脂蛋白和极低密度脂蛋白颗粒(与疾病相关的“坏胆固醇”)结合。低密度脂蛋白和极低密度脂蛋白被从循环中吸收到肝脏,在那里胆固醇被重新加工成胆汁盐。这些胆汁盐被排出体外,随后大部分通过内部胆汁盐循环被回收利用。
其他作用 他汀类药物除了降低脂质外,还表现出其他作用,可以预防动脉粥样硬化。ASTEROID试验显示,他汀类药物治疗期间,动脉粥样硬化斑块的超声波图像直接表明其消退。研究人员推测,他汀类药物通过四种机制(所有这些都是大量生物医学研究的主题)来预防心血管疾病:改善内皮功能,调节炎症反应,维持斑块稳定性,预防血栓形成。他汀类药物甚至可能对那些没有高胆固醇的人有益。2008年,JUPITER研究表明,即使是那些没有高胆固醇或心脏病史,但只有C反应蛋白水平升高的人,其卒中、心脏病发作和手术次数也更少。癌症死亡减少,导致总死亡率减少了20%,但心血管疾病造成的死亡率没有减少。
他汀类药物的不良反应 最常见的不良反应是肝酶升高和肌肉问题。在随机对照临床试验中,报道的不良反应率很低;但他们在“现实世界使用研究中更高”,并且更多样化。在随机试验中,他汀类药物与安慰剂相比,不良反应风险增加了39%(优势比为1.4);其中三分之二为肌痛或肝酶升高,严重不良反应与安慰剂相似。然而,依赖临床试验可能会误导现实世界不良反应的指示——例如,他汀类药物塞瑞瓦他汀于2001年从市场上撤回,原因是出现了横纹肌溶解症(肌肉分解)病例,尽管塞瑞瓦他汀临床试验的荟萃分析中没有出现横纹肌溶解症。其他可能的不良反应包括认知障碍、神经病变、胰腺和肝功能障碍以及性功能障碍。一些服用他汀类药物的患者报告肌痛、肌肉痉挛,或较少见的是胃肠道或其他症状。肝酶异常也可能发生,通常发生在约0.5%的患者中,安慰剂的使用率和重复的酶测试中也观察到类似的发生率,并且通常在没有停药的情况下随着时间的推移恢复正常,或者在短暂停药后恢复正常。其他许多副作用很少发生;通常在大型他汀类药物安全/疗效试验中,仅安慰剂组的发生率也相似。两项随机对照临床试验发现认知问题,而另两项没有发现认知问题;重新引入后复发表明,在某些人中,这些问题与他汀类药物之间存在因果关系。2002年发表的一项丹麦病例对照研究表明,长期服用他汀类药物与神经损伤或多发性神经病的风险增加之间存在关联,但表明这种副作用“很少见,但确实存在”;其他研究人员指出,在涉及50,000人的试验中,他汀类药物的有效性研究并没有显示神经损伤是一种重要的副作用[26]。
乙酰辅酶A羧化酶 (ACC):
原核生物 和 植物 具有多亚基ACC,由不同基因编码的多个多肽组成。生物素羧化酶 (BC) 活性、生物素羧基载体蛋白 (BCCP) 和羧基转移酶 (CT) 活性分别包含在一个不同的亚基中。这些亚基在ACC 全酶 中的化学计量学在不同生物体之间有所不同。 人类 和大多数 真核生物 进化出了一种ACC,其具有CT和BC催化域,以及单个多肽上的生物素羧基载体域。从 N端 到 C端 的ACC功能区域分别是生物素羧化酶 (BC)、生物素结合 (BB)、羧基转移酶 (CT) 和ATP结合 (AB)。AB位于BC内。 生物素 通过酰胺键共价连接到BB中赖氨酸残基的长 侧链 上。由于BB位于BC和CT区域之间,生物素可以轻松地转移到需要它的两个活性位点。
在表达两种ACC同工型的哺乳动物中,这些同工型之间的主要结构差异是ACC2的N端扩展,包含线粒体靶向序列。
ACAC(A,B) 的总体反应通过两步机制进行。[27] 第一个反应是由BC完成的,它涉及用 碳酸氢盐 作为CO 2 来源,对 生物素 进行ATP依赖性羧化。羧基从 生物素 转移到 乙酰辅酶A,在第二个反应中形成 丙二酰辅酶A,该反应由CT催化。
在 活性位点 的背景下,反应在Glu296的残基以及带正电荷的Arg338和Arg292与底物之间的广泛相互作用下进行。[28] 两个Mg2+ 与 ATP 上的磷酸基团配位,并且是ATP与酶结合所必需的。碳酸氢盐被Glu296去质子化,尽管在溶液中,这种质子转移不太可能发生,因为 碳酸氢盐 的 pKa 为10.3。该 酶 显然操纵 pKas 来促进碳酸氢盐的去质子化。 碳酸氢盐 的pKa 通过与Arg338和Arg292带正电荷的侧链的相互作用而降低。此外,Glu296 与Glu211的侧链相互作用,这种相互作用已被证明会导致表观pKa的增加。在碳酸氢盐去质子化后,碳酸氢盐的氧气作为 亲核试剂,攻击ATP上的γ磷酸。羧基磷酸中间体迅速分解成CO 2 和PO 4 3- 。PO 4 3- 去质子化生物素,产生一个烯醇负离子,该烯醇负离子被Arg338稳定,随后攻击[[CO 2 ]],导致生成羧基生物素。[28] 羧基生物素转移到羧基转移酶 (CT) 活性位点,在那里羧基转移到乙酰辅酶A。与BC结构域相反,对CT反应机制知之甚少。一种提议的机制是生物素释放 二氧化碳,然后从乙酰辅酶A羧化酶的甲基中夺取一个质子。生成的 烯醇负离子 攻击CO 2,形成丙二酰辅酶A。在一种竞争机制中, 质子 的提取与乙酰辅酶A的攻击是协同的。ACAC的功能是调节脂肪酸的代谢。当酶处于活性状态时,会产生产物丙二酰辅酶A,它是新脂肪酸的组成部分,并且可以抑制脂肪酰基从酰基辅酶A到肉碱的转移,肉碱酰基转移酶抑制线粒体中脂肪酸的β氧化。在哺乳动物中,表达了两种主要的ACC同工型,ACC1和ACC2,它们在组织分布和功能方面都不同。ACC1存在于所有细胞的细胞质中,但在脂肪组织和泌乳乳腺等脂肪生成组织中富含,这些组织中脂肪酸合成很重要。在氧化组织(如骨骼肌和心脏)中,表达的ACC2比例更高。ACC1和ACC2在肝脏中高表达,肝脏中脂肪酸氧化和合成都很重要。组织分布的差异表明,ACC1维持脂肪酸合成的调节,而ACC2主要调节脂肪酸氧化。
非甲羟戊酸途径或MEP/DOXP途径
[edit | edit source]经典的甲羟戊酸途径或 HMG-CoA 还原酶途径是存在于所有高等真核生物和许多细菌中的一种重要的细胞代谢途径。它对于 IPP 和 DMAPP 的产生至关重要,IPP 和 DMAPP 是用于蛋白质预烯基化、细胞膜维持、激素、蛋白质锚定和N-糖基化等多种过程的生物合成分子的基础。
与经典的类异戊二烯生物合成甲羟戊酸途径相反,植物和顶复门原生动物,如疟疾寄生虫,能够利用另一种途径,即非甲羟戊酸途径来产生它们的类异戊二烯(萜类),该途径发生在它们的质体中。[29] 此外,大多数细菌,包括重要的病原体,如结核分枝杆菌,通过非甲羟戊酸途径合成 IPP 和 DMAPP。

{{cite journal}}: CS1 maint: uses authors parameter (link) 请注意,该来源使用的酶名称和缩写既不全面也不标准(参见Eisenreich W, Bacher A, Arigoni D, Rohdich F (2004). "Biosynthesis of Isoprenoids Via the Non-mevalonate Pathway". Cell. Mol. Life Sci. 61 (12): 1401–26. doi:10.1007/s00018-004-3381-z. PMID 15197467. Retrieved March 23, 2017.{{cite journal}}: CS1 maint: multiple names: authors list (link));因此,图像内容必须与三个相关门/界中任何一个途径的标准酶名称和缩写相协调。有关说明,请参阅英文维基百科的“非甲羟戊酸途径”文章。反应如下:[30]
| 反应物 | 酶 | 产物 | |
| 丙酮酸和3-磷酸甘油醛 | DOXP 合成酶 (Dxs) | 1-脱氧-D-木酮糖-5-磷酸 (DOXP) |  |
| DOXP | DOXP 还原酶 (Dxr, IspC) | 2-C-甲基赤藓糖醇-4-磷酸 (MEP) |  |
| MEP | 4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇合成酶 (YgbP, IspD) | 4-二磷酸胞苷-2-C-甲基赤藓糖醇 (CDP-ME) |  |
| CDP-ME | 4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶 (YchB, IspE) | 4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇-2-磷酸 (CDP-MEP) | |
| CDP-MEP | 2-C-甲基-D-赤藓糖醇-2,4-环二磷酸合成酶 (YgbB, IspF) | 2-C-甲基-D-赤藓糖醇-2,4-环焦磷酸 (MEcPP) |  |
| MEcPP | HMB-PP 合成酶 (GcpE, IspG) | (E)-4-羟基-3-甲基-丁-2-烯基焦磷酸 (HMB-PP) |  |
| HMB-PP | HMB-PP 还原酶 (LytB, IspH) | IPP 和 DMAPP |   |
磷霉素是一种抗生素,它特异性地抑制 DXP 还原异构酶,这是一种类异戊二烯生物合成非甲羟戊酸途径中的关键酶。它是一种 2-C-甲基-D-赤藓糖醇-4-磷酸的结构类似物。它以 38 nM (4) 的 KI 值抑制大肠杆菌酶,以 80 nM 抑制 MTB,以 99 nM 抑制弗朗西斯菌酶。疟疾寄生虫中非甲羟戊酸途径的发现表明了使用磷霉素和其他此类抑制剂作为抗疟药物。事实上,磷霉素已与克林霉素联用治疗疟疾,并取得了良好的结果。据证实,在致死性疟疾寄生虫恶性疟原虫中,靶酶(DXP 还原异构酶)的拷贝数增加与体外磷霉素耐药性相关。
参考文献
[edit | edit source]- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Testosterone&oldid=425129619
- ↑ http://en.wikipedia.org/w/index.php?title=Anabolic_steroid&oldid=425234650
- ↑ http://en.wikipedia.org/w/index.php?title=Cholesterol&oldid=425127311
- ↑ http://en.wikipedia.org/w/index.php?title=Cholesterol&oldid=425127311
- ↑ Lichtenthaler H (1999). "植物类异戊二烯生物合成的 1-脱氧-D-木酮糖-5-磷酸途径". Annu Rev Plant Physiol Plant Mol Biol. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ↑ a b 堪萨斯大学医学中心 (2004). "类二十烷酸和炎症" (PDF). 检索于 2007-01-05. [失效链接] 无效的
<ref>标记;名称 "University" 定义了多次,内容不同 - ↑ Soberman, Roy J. 和 Christmas, Peter (2003). "类二十烷酸信号传导的组织及其后果". J. Clin. Invest. 111 (8): 1107–1113. doi:10.1172/JCI200318338. PMC 152944. PMID 12697726. 检索于 2007-01-05.
{{cite journal}}: CS1 维护:多个名称:作者列表 (link) - ↑ Cyrus, Tillmann; Witztum, Joseph L.; Rader, Daniel J.; Tangirala, Rajendra; Fazio, Sergio; Linton, Macrae F.; Funk, Colin D. (1999). "12/15-脂氧合酶基因的破坏减少了 Apo E 缺陷小鼠的动脉粥样硬化". J Clin Invest. 103 (11): 1597–1604n. doi:10.1172/JCI5897. PMC 408369. PMID 10359569.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Schewe T. (2002 年 3 月 - 4 月). "15-脂氧合酶-1:一种促氧化酶". Biol Chem. 383 (3–4): 365–74. doi:10.1515/BC.2002.041. PMID 12033428.
{{cite journal}}:|access-date=requires|url=(help); Check date values in:|year=(help) - ↑ '医学生物化学基础,Lieberman、Marks 和 Smith 编,第 432 页,2007 年'
- ↑ Chen, H;Born, E;Mathur, S N;Field, F J, J Lipid, Res Dec12 2159-67 培养的人肠道细胞(CaCo-2)中胆固醇和鞘磷脂的合成是独立调控的:膜胆固醇和鞘磷脂含量的作用 ¦Volume= 34 ¦Year= 1993 ¦PMID=8301234 ¦ISBN=0022-2275
- ↑ de Meyer F, Smit B. 胆固醇对磷脂双分子层结构的影响。Proc Natl Acad Sci U S A 2009; 106: 3654-8.
- ↑ Lang T, Bruns D, Wenzel D, Riedel D, Holroyd P, Thiele C, Jahn R. SNARE 蛋白浓缩在胆固醇依赖性簇中,定义了胞吐作用的停靠和融合位点 EMBO J 2001;20:2202-13.
- ↑ a b Koga Y, Morii H (2007). "古菌中醚型极性脂类的生物合成及其进化意义". Microbiol. Mol. Biol. Rev. 71 (1): 97–120. doi:10.1128/MMBR.00033-06. PMC 1847378. PMID 17347520.
- ↑ http://en.wikipedia.org/w/index.php?title=Archaea&oldid=423838280
- ↑ De Rosa M, Gambacorta A, Gliozzi A (1986 年 3 月 1 日). "古细菌脂类的结构、生物合成和理化性质". Microbiol. Rev. 50 (1): 70–80. PMC 373054. PMID 3083222.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Albers SV, van de Vossenberg JL, Driessen AJ, Konings WN (2000). "古菌细胞膜对热胁迫的适应". Front. Biosci. 5: D813–20. doi:10.2741/albers. PMID 10966867.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Damsté JS, Schouten S, Hopmans EC, van Duin AC, Geenevasen JA (2002). "Crenarchaeol:广泛分布的远洋古菌群的特征性核心甘油双二植烷基甘油四醚膜脂类". J. Lipid Res. 43 (10): 1641–51. doi:10.1194/jlr.M200148-JLR200. PMID 12364548.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Koga Y, Morii H (2005). "古菌中醚脂结构研究的最新进展,包括比较和生理学方面". Biosci. Biotechnol. Biochem. 69 (11): 2019–34. doi:10.1271/bbb.69.2019. PMID 16306681.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Hanford MJ,Peeples TL(2002)。“古细菌四醚脂类:独特的结构和应用”。Appl。生物化学。生物技术。97(1):45-62。 doi:10.1385/ABAB:97:1:45。 PMID 11900115.
{{cite journal}}: 未知参数|month=忽略 (帮助) - ↑ Macalady JL,Vestling MM,Baumler D,Boekelheide N,Kaspar CW,Banfield JF(2004)。“铁质体属中的四醚连接膜单层:酸性环境中生存的关键”。极端微生物。8(5):411-9。 doi:10.1007/s00792-004-0404-5。 PMID 15258835.
{{cite journal}}: 未知参数|month=忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ http://en.wikipedia.org/w/index.php?title=Terpene&oldid=425141133
- ↑ http://en.wikipedia.org/w/index.php?title=Mevalonate_pathway&oldid=404974883
- ↑ http://en.wikipedia.org/w/index.php?title=Statin&oldid=425079417
- ↑ http://en.wikipedia.org/w/index.php?title=Statin&oldid=425079417
- ↑ Lee CK,Cheong HK,Ryu KS,Lee JI,Lee W,Jeon YH,Cheong C(2008 年 8 月)。“人乙酰辅酶 A 羧化酶的生物素酰基结构域:羧基转移机制的结构洞察”。蛋白质。72(2):613-24。 doi:10.1002/prot.21952。 PMID 18247344.
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ a b Chou CY,Yu LP,Tong L(2009)。“生物素羧化酶与底物的复合物晶体结构及其催化机制的启示”。J。生物化学。284(17):11690-7。 doi:10.1074/jbc.M805783200。 PMC 2670172。 PMID 19213731.
{{cite journal}}: 未知参数|month=忽略 (帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Lichtenthaler H(1999)。“植物中类异戊二烯生物合成的 1-脱氧-D-木酮糖-5-磷酸途径”。安努 Rev 植物生理学植物分子生物学。50:47-65。 doi:10.1146/annurev.arplant.50.1.47。 PMID 15012203.
- ↑ Eisenreich W,Bacher A,Arigoni D,Rohdich F。通过非甲羟戊酸途径合成类异戊二烯。细胞分子生命科学。2004;61:1401-1426。 PMID 15197467









