蛋白质组学/翻译后修饰/氨基修饰
本节

蛋白质在翻译后会经历一种称为翻译后修饰的化学修饰。这些修饰可能通过改变氨基酸的化学性质或通过结构变化(如折叠、构象分布、稳定性、活性等)来改变蛋白质的功能,例如通过添加像乙酸盐这样的生化官能团。
乙酰化是一种酰化(向有机化合物中引入酰基)过程,它涉及用乙酸的有机基团取代 N 端的活性氢原子。
在真核生物中,最广泛的修饰是蛋白质 N 端 α-胺基的乙酰化。大约 50% 的酵母蛋白质和大约 90% 的人类蛋白质通过这种机制进行修饰。修饰模式在整个进化过程中都是保守的。尽管这是一种非常常见的修饰,但关于 N-α-末端乙酰化的生物学功能的信息并不多。N-α-乙酰转移酶 (NATs) 是负责乙酰化的酶。NATs 属于 GNAT 家族,该家族位于乙酰转移酶超家族之下。[1]
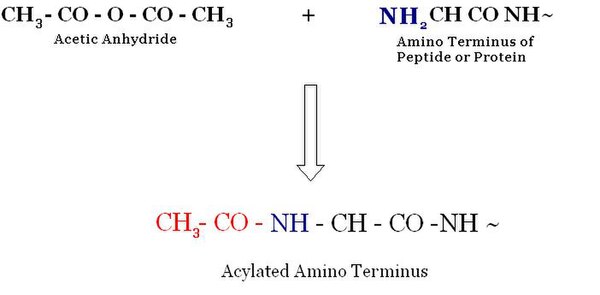
乙酰化和去乙酰化发生在组蛋白乙酰化和去乙酰化中 N 端尾部的赖氨酸残基上。这些反应在组蛋白乙酰转移酶 (HAT) 或组蛋白去乙酰化酶 (HDAC) 酶的存在下进行。
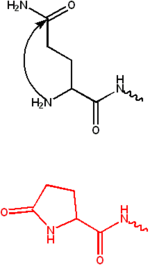
焦谷氨酸是通过谷氨酰胺的环化(化学化合物中形成环)形成的。它通常在抗体中观察到,这些抗体在它们的 N 端含有谷氨酸或谷氨酰胺残基。氨基和谷氨酸或谷氨酰胺缩合成一个五元环,称为焦谷氨酸。该残基使蛋白质对氨基肽酶更具抵抗力,并具有许多功能作用。[2]
它在 N 端 α-螺旋处保持结构完整性,并为电离组氨酸残基的催化和对HeLa细胞的细胞毒性提供合适的环境。
N-肉豆蔻酰化也是一种酰化过程,发现它对蛋白质中 N 端氨基酸甘氨酸具有特异性,其中肉豆蔻酰基(源自肉豆蔻酸)通过酰胺键与 N 端甘氨酸的 α-氨基共价连接。肉豆蔻酰化在真核生物的二级细胞信号传导、逆转录病毒的感染力和致癌中起着至关重要的作用。它还影响钙结合蛋白的生理功能。[3] 胞质酶 N-肉豆蔻酰转移酶 (NMT) 催化肉豆蔻酰化。
观察到的蛋白质甲基化是最常见的翻译后修饰形式。与其他翻译后修饰类似,蛋白质甲基化参与调节蛋白质-蛋白质相互作用,从而在关键的细胞事件中产生大量影响,包括转录调控[4] [5] [6] 应激反应、衰老和蛋白质修复[7] T 细胞激活[8]、核转运[9]、神经元分化[10] [11]、离子通道功能和细胞因子信号传导。当一个甲基基团被添加到一个或多个亲核侧链上时,蛋白质被认为是甲基化的。侧链氮上的甲基化被认为是不可逆的,而羧基上的甲基化可能是可逆的。蛋白质中氮上发生甲基化的残基包括赖氨酸的 ε-胺、组氨酸的咪唑环、精氨酸的胍基以及谷氨酰胺和天冬酰胺的侧链酰胺氮。

蛋白质中的甲基化抵消了蛋白质上的负电荷,并增加了蛋白质的疏水性。羧酸酯侧链上的甲基化掩盖了负电荷,并增加了疏水性。赖氨酸的 N-甲基化不会改变阳离子电荷,但会增加疏水性。特别是,蛋白质中赖氨酸侧链的二甲基化和三甲基化既增加了疏水性又增加了空间位阻,如果它们位于相互作用表面,则会影响蛋白质-蛋白质相互作用。
当异氰酸 (HCNO) 与蛋白质的氨基末端残基(如赖氨酸)反应时,就会发生氨甲酰化。它是公认的 等电聚焦 中常见的蛋白质人工修饰之一。风险因素是溶液中存在的尿素(致混沌剂),它与氨基甲酸 氰酸盐 处于平衡状态。异氰酸是与蛋白质氨基反应的氰酸盐形式。为了发生氨甲酰化,蛋白质的氨基酸基团(如赖氨酸、精氨酸侧链)应该被去质子化,这通常发生在碱性 pH 值下。当蛋白质在尿素溶液中在室温下放置,并且异氰酸可以自由地与蛋白质反应时,就会发生氨甲酰化。
异氰酸引起的氨甲酰化对蛋白质表征的下一步不利,因为异氰酸与蛋白质的氨基末端反应,阻碍了肽或蛋白质进行 N 末端测序。异氰酸攻击赖氨酸和精氨酸残基的侧链,使蛋白质不适合许多酶消化。即使氨甲酰化不阻止酶消化,它也会经常混淆来自 质谱 实验的结果,因为肽具有意外的保留时间和质量。在几种疾病状态下观察到体内蛋白质的氨甲酰化。[12]
甲酰化
[edit | edit source]甲酰化是蛋白质的翻译后修饰之一,其中蛋白质通过连接甲酰基进行修饰。最常研究的机制是赖氨酸的 N6-甲酰化,它与组蛋白和其他核蛋白相关。组蛋白和其他染色质蛋白的翻译后修饰在 基因表达 的生理学中起作用。“N6-甲酰赖氨酸残基似乎代表了内源性组蛋白次级修饰,这种修饰与赖氨酸 N6-乙酰化在化学上相似,被认为是哺乳动物细胞中基因表达的重要决定因素。”研究得出结论,赖氨酸的 N6-甲酰化修饰会干扰乙酰化和甲基化的信号功能,这些功能在氧化和亚硝化应激的生理学中起作用。[13]
参考文献
[edit | edit source]- ↑ 维基百科 : 乙酰化 [1]
- ↑ 牛前阿片黑素皮质素的翻译后修饰。酪氨酸硫酸化和焦谷氨酸形成,一项质谱研究。A Bateman、S Solomon 和 HP Bennett.J. Biol. Chem., Vol. 265, Issue 36, 22130-22136, 12, 1990[2]
- ↑ N 末端肉豆蔻酰化调节神经元钙传感器-1 中钙诱导的构象变化。Andreas Jeromin、Dasari Muralidhar、Malavika Nair Parameswaran、John Roder、Thomas Fairwell、Suzanne Scarlata、Louisa Dowal、Sourajit M. Mustafi、Kandala V. R. Chary 和 Yogendra Sharma J. Biol. Chem., Vol. 279, Issue 26, 27158-27167, June 25, 2004[3]
- ↑ Clarke S: 年龄作为化学和生化过程之间的战争:蛋白质甲基化和识别受损蛋白质以修复。衰老研究评论 2003, 2(3):263-285。
- ↑ Blanchet F、Cardona A、Letimier FA、Hershfield MS、Acuto O: CD28 共刺激信号在 T 细胞中诱导蛋白质精氨酸甲基化。实验医学杂志 2005, 202(3):371-377。
- ↑ Smith WA、Schurter BT、Wong-Staal F、David M: RNA 解旋酶 a 的精氨酸甲基化决定了它的亚细胞定位。生物化学杂志 2004, 279(22):22795-22798。
- ↑ Kujubu DA、Stimmel JB、Law RE、Herschman HR、Clarke S: PC-12 细胞对 NGF 和 EGF 的早期反应:K252a 和 5'-甲硫腺苷对基因表达和膜蛋白甲基化的影响。神经科学研究杂志 1993, 36(1):58-65.
- ↑ Cimato TR、Ettinger MJ、Zhou X、Aletta JM: 神经生长因子特异性调节 PC12 细胞神经元分化过程中的蛋白质甲基化。细胞生物学杂志 1997, 138(5):1089-1103
- ↑ Vemuri R、Philipson KD: 蛋白质甲基化抑制心脏肌浆网囊泡中的 Na+-Ca2+ 交换活性。生物化学与生物物理学报 1988, 939(3):503-508.
- ↑ Chen YF、Zhang AY、Zou AP、Campbell WB、Li PL: 蛋白质甲基化激活从冠状动脉肌细胞重建的柳叶碱受体-钙释放通道。血管研究杂志 2004, 41(3):229-240.
- ↑ Mowen KA、Schurter BT、Fathman JW、David M、Glimcher LH: NIP45 的精氨酸甲基化调节效应 T 淋巴细胞中细胞因子的基因表达。分子细胞 2004, 15(4):559-571.
- ↑ 蛋白质组分析的转折点:使用具有等电膜的多隔室电解器进行样品预分级。Herbert B、Righetti PG.[4]
- ↑ 赖氨酸的 Nepsilon-甲酰化是核蛋白的广泛翻译后修饰,发生在参与染色质功能调节的残基上 (PMID: 18056081)。Wisniewski JR、Zougman A、Mann M. [5]



