科学:小学教师指南/物质的构成要素
物质是任何具有质量并占据空间的物质。我们能触碰和看到的日常物体最终都是由原子组成的,原子本身又是由相互作用的亚原子粒子组成的,例如质子、中子和电子(这些粒子本身又是由更小的粒子组成的!)。物质通常包括原子以及由各种原子以分子形式相互连接而成的任何物质。单个原子太小,我们无法看到或操作,但如果我们有数万亿个相同类型的原子(例如纯金或纯氦的样本),我们可以研究这种元素的性质。我们已经了解了不同元素的性质,并将它们整理成“元素周期表”(见下文)。
两个或多个相互连接的原子被称为分子,我们将在后面讨论它们如何相互连接。一个分子的性质可能与它所组成的原子完全不同(氢气是一种气体,氧气也是一种气体,但如果你将两个氢原子与一个氧原子结合起来,你将得到 H2O(水),它的性质与它所组成的元素大不相同)。
化合物是许多相同类型的分子。因此,一杯水是水分子的一种化合物,一勺糖是糖分子的一种化合物。蛋壳主要是碳酸钙化合物(许多碳酸钙分子相互连接)。
混合物仅仅是不同事物的混合物!因此,如果你将糖和水混合在一起,那么你将得到一种混合物,而不是两种化合物。对于液体混合物,我们可以使用溶液这个词,它由溶剂(液体部分,例如水)和溶质(溶解在溶剂中的固体部分——例如糖)组成。
你周围的空气是不同气体分子(氮气、氧气、二氧化碳、水蒸气和其他气体)的混合物。将化合物混合在一起很容易得到混合物;从混合物中分离出化合物比较棘手,但可以做到:例如,你可以取你的糖水混合物,将其煮沸,收集水蒸气,你将再次得到纯水的化合物,因为糖会留下来(如果你让它完全干燥,你应该会得到纯糖化合物)。
每个原子都由一个原子核和一个或多个以极快的速度绕着原子核运动的电子组成。原子核由一个或多个质子和通常数量相似的中子组成(例外是氢,它只有一个质子,没有中子)。质子带正电荷,每个质子的质量为 1 个原子质量单位 (AMU);电子带负电荷,几乎没有质量(5/10,000 个 AMU),中子不带电,质量与质子相似。如果质子和电子的数量相等,则该原子是电中性的。如果一个原子拥有比质子多或少的电子,则它分别带负电荷或正电荷,被称为离子。质子的数量决定了原子的类型:一个氢原子总是拥有 1 个质子,一个碳原子总是拥有 6 个质子。质子的数量只能在核反应中改变,如果质子数量发生改变,则该原子将变成另一种元素。相反,电子的数量可以很容易地改变,具体取决于原子以及它所接触的其他类型的原子。由于电子位于原子的外部,所以它们与其他原子发生相互作用,并且正是电子负责元素的大部分化学性质。中子的数量不太可能改变,即使改变了,该原子的化学性质也不会改变(具有相同元素但中子数量不同的原子被称为同位素,它们可能是放射性的,并且可能有多种用途)。一个原子的质量有 99.95%集中在原子核中——与质子和中子相比,电子非常小,几乎没有质量。在元素周期表中,原子质量显示在每个方格的左下方,是所有质子、中子和电子的总和。
原子中粒子的排列很有趣:质子和中子紧密地堆积在一起,形成一个叫做原子核的小区域(不要将其与细胞核混淆——它们是同一个词,但不是同一个东西)。由于正电荷相互排斥,因此质子能够如此紧密地聚集在原子核中(以及中子)很奇怪。关于将原子核结合在一起的“强核力”还有很多东西需要学习,但对于我们的课程,我们只说它是宇宙中最强的已知力!它也是在核反应中必须打破的力!电子通过“电磁力”被吸引到原子中,电磁力更容易理解(并且负责磁力和电)并且弱得多。电子与原子核之间的距离实际上相当大:如果一个原子的原子核像高尔夫球一样大,如果你将这个高尔夫球放在足球场的中央,电子就像微小的沙粒,以极快的速度绕着足球场的边缘转圈!换句话说,每个原子都大部分是空的空间!如果你把身体中所有原子中的所有空的空间都去掉,你就可以把你整个身体塞进这封信顶部的“i”上的墨水中!(令人惊奇的是,那个小点仍然会和你一样重,因为它仍然包含你所有质子和中子的质量!)。
我们实际上永远无法准确地知道电子的位置,因为它们太小,而且运动速度太快,但它们往往停留在“电子轨道”中,这些轨道就像原子核周围的不同云层。不同的原子,拥有不同数量的电子,拥有不同形状的云层。最外层的云层(或“壳层”)被称为“价电子层”,该壳层中的电子被称为“价电子”。这些电子与其他原子的价电子相互作用,电子可能会从一个原子转移到另一个原子,或者在两个原子之间共享(化学键将在其他地方讨论),或者只是相互排斥。当你用拳头敲打桌子时,你的拳头和桌子似乎都非常坚固,但实际上,你只是感受到了数万亿个电子在你的手原子周围嗡嗡作响,这些电子排斥着数万亿个电子,这些电子在你的桌子原子周围嗡嗡作响。
原子非常小;典型的尺寸约为 100 皮米(十亿分之一米)。这不仅是我们无法看到的尺寸,也是我们无法用显微镜看到的尺寸!为了帮助你直观地理解这一点,请探索这个“宇宙尺度”动画(需要 Flash 才能运行;如果你无法访问它,请观看此视频)。注意圆圈,因为每次你放大或缩小经过一个圆圈时,它都代表着 1000 倍的小或 1000 倍的大!放大,直到你找到原子,然后继续放大,直到你找到质子、中子,最终找到电子。如果你继续放大,你会发现各种奇怪的粒子,因为即使质子和中子也是由其他东西组成的。如果你向另一个方向移动,你会看到越来越大的物体、行星、星系等等。我们将把非常大的东西留到下一章!
公制系统非常有用,以至于它发明后被世界上几乎所有国家采用(美国是例外!)。即使在美国,所有科学家都使用公制系统。为什么?好吧,旧的英制系统很不一致:1 英尺有 12 英寸,1 码有 3 英尺,但 1 磅有 16 盎司,1 杯有 8 盎司……这可能会让人非常困惑。在过去,它是实用的——1 英寸大约是你拇指尖的大小。1 英尺大约是(不出所料)你脚的大小。公制系统完全基于十、百和千的乘除,因此,计算出 453 厘米等于 4.53 米比计算出 453 英寸等于 37 英尺 9 英寸容易得多。公制系统的另一个好处是,它使用标准的前缀,无论你讨论的是长度、重量、体积,还是其他任何东西。
要更好地理解公制系统,只需知道对于任何你想要测量的量,都存在一个标准单位。对于质量,它是克;对于体积,它是升;对于计算机数据,它是字节;对于长度,它是米。一旦你了解了标准单位,你就可以使用前缀作为一种简单的方法来讨论比标准单位大得多或小得多的东西。例如,我可以以米为单位测量我的铅笔,但称它为 0.12 米有点尴尬,而我可以称它为 12 厘米。
对于人们来说,理解这些前缀可能会很困难的一件事是,他们可能不习惯使用科学记数法,科学记数法涉及指数。100 = 10 X 10 = 102。100,000 = 10 X 10 X 10 X 10 X 10,或 105。你可能注意到 105 后面跟着一个 1 和 5 个零。这很简单,但有时很难去想比 10 小的东西。例如,1/1000 = 10-3。如果你用计算器将 1 除以 1000,你会得到答案 0.001。你可能意识到,对于 10-3,你需要将小数点向右移动 3 位才能得到“1”,或者你可能更喜欢这样想:“我写下 1,然后将小数点向左移动 3 位。”在公制系统中,最重要的前缀是我们乘以或除以 1000 的情况。例如,1 米除以 1000 = 1 毫米(“毫”表示“千分之一”),简写为 1 mm。如果我们乘以 1000,我们得到 1 公里(“千”表示“一千”),简写为 1 km。我们可以对体积做同样的操作,得到 1 mL(毫升)或 1 kL(1 千升)。我们可以将 1 毫米分成 1000 个更小的部分。每一个部分都是 1 毫米的千分之一,或者 1 米的百万分之一。为此,我们使用前缀“微”,所以我们会说 1 微米(它在简写中用希腊字母小写 µ 表示,它看起来像 μ(所以 1 微米写成 1 µm)。如果我们将 1 微米分成 1000 个部分,我们得到 1 纳米!
固体、液体、气体
[edit | edit source]    | |
| 物质通常被分类为三种经典状态(固体、液体和气体),有时会添加等离子体作为第四种状态。从上到下:石英(一种矿物固体)、水(液态)、二氧化氮(一种棕色气体)和等离子球(等离子体)。 |
外太空大部分是空的,在“非空”的星系(数量高达数千亿个!)之间存在着巨大的距离。但无论哪里有星系,也都会有由恒星制造的物质组成的行星。就我们而言,**物质**是指由原子组成的物质(因此不包括光子、声波、热量或其他形式的能量,即使物质和能量通过爱因斯坦方程联系在一起)。

物质存在于三种主要状态:固体、液体和气体。一些物质,包括水,可以存在于这三种状态。它处于哪种状态是温度和压力等变量的函数。许多元素在室温下是固体,需要极高的热量才能熔化成液体(例如铁)。其他元素在室温下是气体(例如氮气或氧气),需要极低的温度才能凝结成液体(液氮在 -196 摄氏度(-321 华氏度)的极低温度下沸腾成气体)。
在固体中,例如岩石、桌子或玻璃窗,固体内的原子仍在振动和抖动,但它们不能自由移动,因为它们与周围的其他原子紧密结合在一起。不同的固体具有不同的特性,这取决于哪些类型的原子结合在一起。因此,光滑的河石浑浊而光滑的金属闪亮,这是分子本身的函数。
在液体中,分子自由移动,以随机模式相互碰撞。即使在一杯放在桌子上一个小时,静止不动的水中,其中的水分子也处于不断运动中。你可以通过滴入一滴食用色素来证明这一点——食用色素不会停留在一个地方,而是会迅速扩散,这要归功于水分子不断的运动。热量实际上是衡量分子运动或振动速度的指标。因此,如果你把一杯水放进冰箱,用微波炉加热另一杯水,然后在两杯水中都滴入一滴食用色素,你就能看到不同分子运动速度的影响。
在气体中,分子比液体中分布得更稀疏。事实上,无论容器的大小或形状,气体分子都会均匀地扩散并以均匀的压力充满容器。与液体或固体不同,气体很容易压缩。当你压缩气体时,分子会被迫更靠近在一起。气体压缩得越多,反作用于容器的压力就越大(通常以每平方英寸磅数或 PSI 衡量)。这种压力对于轮胎很有用(一辆普通汽车轮胎的充气压力约为 35 PSI),或者用压缩空气罐喷射电子产品,或者能够背着大量空气进行水肺潜水。当气体减压时,压力下降,温度也下降。你可能感觉到压缩空气罐在喷射了几秒钟后变得很冷。这种基于压力的温度变化用于家庭和汽车冷却系统。空调有一个压缩机来加热气体,这种热量会释放到环境中,然后让气体膨胀和冷却一些管道,然后将空气吹过这些管道,将一股冷空气带入家中或车内。
元素的诞生
[edit | edit source]每颗恒星发出的光和热都是核聚变反应的产物。我们的太阳通过氢原子核的核聚变生成氦来产生能量。在太阳的核心,每秒会聚变 6.2 亿公吨的氢。在四个氢原子核聚变成一个氦原子核的过程中,0.7% 的质量以 α 粒子的动能或其他形式的能量的形式带走,例如电磁辐射,遵循爱因斯坦著名的方程 E = mc2(能量等于质量乘以光速的平方)。核反应中释放的能量比化学反应中释放的能量**大得多**,因为将原子核结合在一起的结合能比将电子与原子核结合在一起的能量大得多(记住,强核力是我们知道的力中最强的力)。为了说明这一点,如果你能聚变一杯简单水中的氢原子,你将有足够的能量让你的汽车行驶 10,000 英里!因此,我们周围的所有物质中都蕴藏着巨大的能量,但大多数能量都不可用,因为分解原子核(裂变)或将它们撞击在一起(聚变)非常困难。恒星能够进行聚变,因为它们的质量非常大(参见宇宙的尺度),因此引力在恒星的核心产生了巨大的压力和热量。氢是最小的原子(只有 1 个质子),也是宇宙中最常见的元素。氢是恒星的基本燃料,至少在它们年轻的时候(对于恒星来说,“年轻”可以是数十亿年)。氦有 2 个质子,2 个中子(记住氢没有中子)。一个氦原子的质量大约比四个氢原子核的质量少 0.7%(因为一小部分质量在聚变反应过程中转化为了能量)。如果另外两个氢原子与氦原子发生聚变,它们可以形成一个有 3 个质子和 3 个中子的原子,这就是锂。换句话说,元素是由其拥有的质子数来定义的,所有比氢重的元素都是在恒星中产生的。令人惊叹的是,我们星球上所有固体物体(包括你)都是由在遥远恒星中诞生的原子组成的!最重的元素是由一颗更重的恒星在其生命末期发生剧烈超新星爆炸时发生的聚变合成的(随着一颗恒星的衰老,它会消耗掉轻元素,并继续进行更重元素的聚变——一次燃烧的灰烬成为下一次燃烧的燃料)。然后超新星爆炸,更重的元素像宇宙尘埃一样散布到各个方向。一些尘埃和晶体开始在巨大的宇宙云中聚集成团。在云的中心,可能形成一颗新的恒星,行星也可能随着碎片越来越密集地聚集成团而形成。据信,我们的地球与我们太阳系中的其他行星一起,在大约 45.4 亿年前的 1000-2000 万年的时间里形成的。
如何整理元素:元素周期表
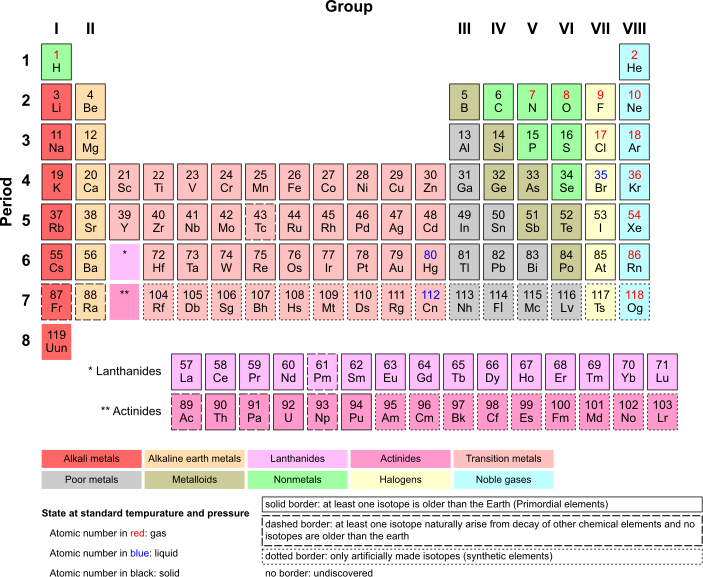
[edit | edit source]我们生活在一个由铁、镍、碳、硅和许多其他元素组成的星球上。一些元素很常见(比如氧气),而另一些元素则很稀有(比如黄金)。化学家们在研究元素的过程中,用各种方法整理了他们的知识。其中最实用的方法之一叫做元素周期表。在这个表格中,原子是按照质子数依次排列的:氢的原子序数为 1,因为它有 1 个质子,氦的原子序数为 2,因为它有 2 个质子,银的原子序数为 47,因为它有 47 个质子。你明白了吧。当你从左到右,从上到下移动时,元素会越来越重。原子序数只告诉我们质子的数量。原子质量略有不同——它包括质子和中子的总重量(技术上它包括电子,但它们的重量可以忽略不计)。碳有 6 个质子和 6 个中子,原子质量为 12.011。它不等于 12.000 的原因是,有时碳原子会多出一个中子(所以叫做碳13),或者多出两个中子(叫做碳14)。碳13 或碳14 同位素很少,但它们的数量足够多,以至于任何纯碳块的重量都会比只由碳12 原子组成的碳块略重一点。[旁注:碳14 是由 CO2 在地球大气层高处被离子轰击而产生的。它以已知的速率缓慢衰变为碳12。生物以恒定的速率吸收碳14,当它们死亡时,它们就不再吸收碳14 了。考古学家和古生物学家可以测量残留的碳14 的数量,并估计某个东西的年代——这被称为碳年代测定法。]
关于元素周期表,很重要的一点是,各列由具有相似化学性质的原子组成,因为它们具有相似的价电子。最左侧的列(第一族,包括 H、Li、Na、K 等)在外层都有 1 个电子。下一列(第二族)在外层都有 2 个电子。这条规则在中间部分的金属中有些失效,原因我们不再讨论——它们在外层大多有 2 个电子。然后,在第 13 列(硼族)中,外层有 3 个电子。接下来是碳族,外层有 4 个电子。然后是 5 个、6 个、7 个外层电子,最后是右边的最后一列——外层有 8 个电子(氦除外,将在其他地方解释)。为什么这很重要?这很重要,因为元素的化学行为很大程度上取决于外层有多少个电子。这将在关于化学反应和键的章节中更详细地讨论,但现在我们说“每个原子的梦想都是拥有一个充满电子的外层”。(没错,原子不做梦,但那比说“如果原子的价层充满电子,它们就会达到最大稳定性”更有趣)。最右侧(第 18 族)的外层都完整、充满电子。它们被称为“惰性气体”,以单个原子的形式漂浮在周围,不被任何其他原子吸引,也不与任何其他原子发生化学反应。正如我们将看到的,所有其他列都准备以各种方式起作用。
在下方的简化元素周期表中,您将看到每个元素的单字母或双字母符号,原子序数(指该元素每个原子中的质子数),以及元素的排列方式:分成族(列)和周期(行)。完整的元素周期表可以在此链接中查看,该链接提供了关于每个元素的更多信息。如果您想以一种有趣的方式了解更多关于任何特定元素的信息,请观看来自英国诺丁汉大学的周期视频中的一些有趣内容(该网站上有真正的疯狂科学家!)

下一章:化学反应