感觉系统/神经感觉植入物/视网膜植入物
自20世纪后期以来,通过人工眼假体恢复盲人的视力一直是世界各地众多研究小组和一些私营公司的目标。与人工耳蜗植入物类似,关键概念是利用电脉冲刺激视觉神经系统,绕过人类视网膜上受损或退化的感光细胞。在本章中,我们将描述视网膜植入物的基本功能,以及目前正在研究和开发的不同方法。视网膜植入物最常见的两种方法称为“视网膜上”和“视网膜下”植入物,分别对应于位于视网膜顶部或视网膜后面的眼假体。我们不会涵盖任何与视网膜无关的恢复视力的方法,例如旨在从视觉输入刺激舌头的BrainPort视觉系统、围绕视神经的袖套电极或初级视觉皮层的刺激植入物。
图1描绘了人类视网膜的神经结构示意图。我们可以区分三层细胞。第一层,位于最远离眼球晶状体的部位,由感光细胞(视杆细胞和视锥细胞)组成,其目的是将传入的光线转换为电信号,然后进一步传播到中间层,该层主要由双极细胞组成。这些双极细胞与感光细胞以及水平细胞和无长突细胞等细胞类型相连,将电信号传递到视网膜神经节细胞(RGC)。有关双极细胞功能的详细描述,特别是关于其细分为ON和OFF双极细胞,请参阅视觉系统章节。最上层由RGCs组成,收集来自水平细胞的电脉冲,并通过视神经将其传递到丘脑。从那里,信号传播到初级视觉皮层。关于人类视网膜内的信号处理,有一些关键方面值得一提。首先,虽然双极细胞以及水平细胞和无长突细胞产生渐变电位,但RGCs反而产生动作电位。此外,每种细胞类型的密度在视网膜上并不均匀。虽然在中央凹区域存在极高密度的视杆细胞和视锥细胞,此外只有很少的感光细胞通过中间层连接到RGCs,但在视网膜的周边区域发现的感光细胞密度要低得多,并且许多感光细胞连接到单个RGC。后者也对RGC的感受野有直接影响,因为它往往向视网膜的外侧区域迅速增加,仅仅是因为感光细胞密度较低,并且连接到相同RGC的感光细胞数量增加。
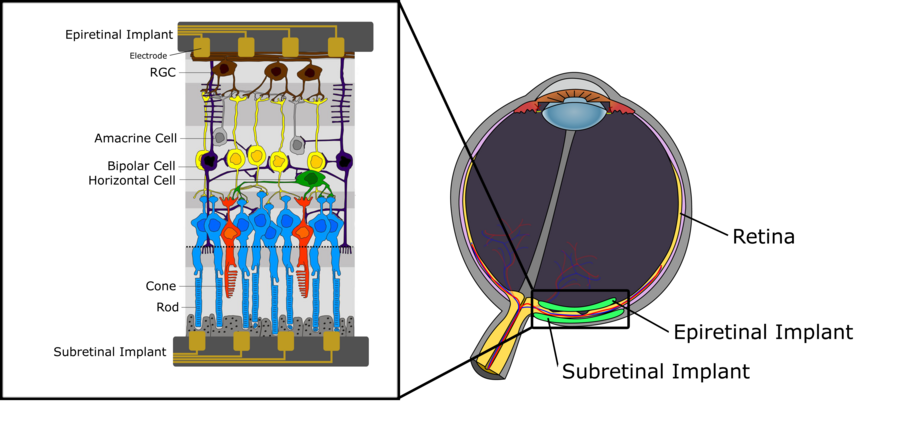
如本维基先前所述,视网膜是位于眼球后部的一种感光组织,由包含各种细胞类型的不同层组成。视网膜主要参与神经视觉处理,信号起源于感光细胞,并通过神经节细胞的轴突传递到大脑。当这种分层组织退化时,可能会发生永久性视力丧失[1]。这通常是由视网膜退行性疾病引起的,例如年龄相关性黄斑变性 (AMD) 和视网膜色素变性 (RP),它们是两种最普遍的疾病,会逐渐导致永久性视力障碍和丧失。目前,这两种视网膜疾病还没有治愈方法,并且现代疗法只能减缓疾病进展,因此需要制定恢复患者视力的策略。目前正在研究的工具之一是视网膜假体技术,它可以刺激存活的视网膜组织以恢复视力,这将在后面的部分进行描述[2]。
顾名思义,黄斑变性是一种视网膜退行性疾病,主要发生在老年人身上。AMD围绕着黄斑中视锥细胞的进行性退化,导致视野中心视力模糊。这可能会发展到患者视野中心完全丧失视力的程度,称为盲点。虽然AMD可能影响一只或两只眼睛,但它很少导致完全失明,因为患者的周边视力仍然完好无损。AMD主要有两种类型:干性和湿性。干性AMD占该病病例的大多数,其特征是在视网膜色素上皮和脉络膜之间黄斑处出现小的黄色沉积物,称为老年斑。这种形式的AMD的进展最初缓慢,症状很少,只有当视网膜萎缩发生时才会加剧。湿性AMD的特点是脉络膜新生血管形成,即容易破裂并导致血液、蛋白质泄漏和瘢痕形成的异常血管生长,最终导致视锥细胞永久性损伤,从而导致视力丧失。湿性AMD的进展和视力丧失的速度比干性AMD快得多[3]。


色素性视网膜炎是一种遗传性退行性眼病,涉及视杆细胞,在年轻人中早期发病。在这种疾病中,视杆细胞逐渐退化,最终导致周边视野和夜视力丧失。这种视力丧失首先发生在外部,然后逐渐向内发展,在患者中产生“隧道视野”的效果。视力损害对称发生,双眼在类似的时间范围内受到影响。与年龄相关性黄斑变性不同,这种眼病可以扩展到周边以外,并通过视锥细胞的退化开始影响中央视野。这导致患者持续视力丧失,最终可能导致完全失明,尽管这种情况非常罕见。色素性视网膜炎是遗传性疾病,具有多种可导致RP表型的基因突变,导致多种遗传模式。然而,当遗传模式为常染色体显性遗传时,大多数病例与视紫红质基因的突变有关。这种突变破坏了视杆蛋白的功能,视杆蛋白是光转导级联反应中必不可少的蛋白质。目前还没有治愈色素性视网膜炎的方法[2]。然而,2008年,佐藤茂和他的同事发现了一种名为Pikachurin的细胞外基质样视网膜蛋白,由于其参与光感受器细胞和双极细胞之间的相互作用,因此可能导致潜在的疾病治疗方法[4]。

如上所述,目前还没有治愈黄斑变性和色素性视网膜炎引起的进行性视力损害的方法。然而,在这两种疾病中,即使存在大量的光感受器细胞丢失,大量内视网膜神经元在疾病发病数年后仍然存活。这为通过电极对剩余的、仍然正常运作的视网膜细胞进行人工刺激提供了机会,从而为人类患者恢复视觉信息。微电极阵列利用电极通过紧密放置来刺激视网膜细胞外,从而允许在阵列和视网膜周围发现的盐水中形成电化学界面。电流被注入到阵列-视网膜界面,最终驱动神经元膜的去极化,从而导致动作电位。这种刺激可以是阴极的或阳极的。在阴极刺激中,负电荷出现在膜外,从而驱动正电荷进入细胞内,导致去极化梯度,该梯度在靠近电极的地方最强。在阳极刺激中,超极化发生在最靠近电极的区域,而去极化发生在较远的距离。因此,阴极通常被认为更有效地用于刺激,因为它需要更低的电流注入。刺激的相位不是影响刺激有效性的唯一因素。波形可以采用多种形状,例如单相和双相,在视网膜神经元刺激的安全方面起着重要作用。例如,在猴子身上发现,仅具有阳极相位的单相电流会损害先前可存活的细胞。因此,使用视网膜刺激的植入物将使用电荷平衡的双相波形。这种波形利用阴极相位进行刺激,利用阳极相位进行放电,从而平衡膜周围的电荷。通过这种刺激能力,视网膜假体可以植入视网膜后方,然后被称为视网膜下植入物。这使得电极最靠近受损的光感受器和仍然正常运作的双极细胞,而双极细胞是这里的真正刺激目标。如果刺激电极穿透脉络膜(包含视网膜的血液供应),则植入物有时被称为“脉络膜上”植入物。或者,植入物可以放置在视网膜顶部,最靠近神经节细胞层,目的是刺激RGC而不是光感受器细胞。这些植入物被称为视网膜上植入物。这两种方法目前正由多个研究小组进行研究。它们都具有明显的优势和缺点。在我们分别详细介绍它们之前,我们先描述一些在这两种情况下都需要考虑的关键挑战[2]。
视网膜植入物面临的一个巨大挑战来自人视网膜中神经细胞的极高空间密度。人视网膜大约有1.25亿个光感受器(视杆和视锥细胞)和150万个神经节细胞,而人耳蜗中只有大约15000个毛细胞[5] [6]。在视网膜中央凹处,视觉敏锐度最高,每平方毫米有高达15万个视锥细胞。虽然与光感受器相比,RGC的总数要少得多,但它们在中央凹区域的密度接近视锥细胞的密度,这给用人工电极以足够高的空间分辨率来寻址神经细胞带来了巨大挑战。几乎所有目前关于视网膜植入物的科学实验都使用微电极阵列(MEA)来刺激视网膜细胞。高分辨率MEA实现了大约50微米的电极间距,导致每平方毫米400个电极的电极密度。因此,在中央凹区域,用传统的电极技术不可能实现电极与光感受器或RGC之间的一一对应关系。然而,光感受器和RGC的空间密度都迅速向视网膜外围区域下降,使得电极与外周神经细胞之间的一一刺激变得更加可行[7]。另一个挑战是在安全限值内操作电极。施加超过0.1 mC/cm²的电荷密度可能会损坏神经组织[7]。通常,细胞离刺激电极越远,刺激细胞所需的电流幅度就越大。此外,刺激阈值越低,电极的设计就可以越小,电极在MEA上的放置就可以越紧凑,从而提高空间刺激分辨率。刺激阈值定义为触发至少50%的刺激脉冲中神经反应所需的最小刺激强度。出于这些原因,设计视网膜植入物的主要目标是在仍然保证可靠刺激(例如,在RGC的情况下产生动作电位)目标细胞的同时,使用尽可能低的刺激电流。这可以通过将电极尽可能靠近对施加的电场脉冲最敏感的目标细胞区域来实现,或者通过使细胞突起(即树突和/或轴突)在电极上生长来实现,即使细胞体位于远处,也能以非常低的电流刺激细胞。此外,固定在视网膜上的植入物会自动跟随眼球的运动。虽然这带来了一些显著的好处,但也意味着任何与植入物的连接(用于调整参数、读取数据或为刺激提供外部电源)都需要一根随植入物一起移动的电缆。当我们每秒大约移动眼睛三次时,这会使电缆和相关的连接暴露在严重的机械应力下。对于一个应该在整个生命周期内无需外部干预就能保持功能的设备来说,这对所涉及的材料和技术提出了严峻的挑战。
除了电气挑战之外,视网膜植入物的关键挑战在于它与生物组织的接触。当异物(例如植入物)与生理物质接触时,会触发免疫反应。这种反应通常以炎症或物质隔离的形式出现,这通常会导致相关组织的瘢痕形成。这对视网膜植入物来说尤其是一个问题,因为假体必须穿过组织插入到适当的位置。如果使用的材料太锋利或放置不当,可能会对组织造成损伤,从而进一步加剧免疫反应。此外,这些反应会导致电信号随着时间的推移而丢失,因为免疫系统会随着时间的推移“包封”刺激区域,从而难以实现长期植入。到目前为止,一种视网膜上植入物Argus II已经能够通过使视网膜植入物在患者体内3年后仍然发挥作用来规避生物相容性问题。这种植入物使用了硅胶,硅胶是一种具有良好长期生物相容性的材料,但它是一种刚性基材,不允许轻松修改设备的配置。其他材料,如聚酰亚胺和金,也已被研究用于视网膜植入物的功能和生物相容性。聚酰亚胺是一种很有前途的用于未来植入物的聚合物,因为由这种材料制成的植入物在短期研究中对人眼有功能。这种材料的优点在于其高生物相容性、柔韧性和低成本。随着技术进步产生更复杂的微电极阵列,需要不同的基材来实现最大功能,因此对适合视网膜植入物的材料的优化工作正在进行中[8] [9]。
正如其名称所暗示的那样,视网膜下植入物是位于视网膜后面的视觉假体。因此,植入物位于最靠近受损感光细胞的位置,旨在绕过视杆细胞和视锥细胞,并刺激视网膜下一神经层的双极细胞。这种方法的主要优势在于,在感光细胞和需要由植入物模拟的双极细胞之间发生的视觉信号处理相对较少。也就是说,原始视觉信息(例如,由摄像机捕捉到的信息)可以直接或仅经过相对基本的信号处理分别转发到刺激双极细胞的MEA,从信号处理的角度来看,该过程相当简单。然而,这种方法也有一些严重的缺点。人眼视网膜中感光细胞的高空间分辨率对开发和设计具有足够高刺激分辨率、因此具有较低电极间距的MEA提出了巨大挑战。此外,神经层在z方向(x-y平面与视网膜曲率相切)上的堆叠在将电极放置靠近双极细胞时增加了另一个困难。由于MAE位于视网膜后面,因此电极和目标细胞之间存在明显的空间间隙需要克服。如上所述,电极到目标细胞距离的增加迫使MAE以更高的电流工作,从而增大电极尺寸、单个电极刺激范围内的细胞数量以及相邻电极之间的空间距离。所有这些都会导致刺激分辨率降低,以及使视网膜面临因电荷密度过高而导致组织损伤的风险。如下所示,克服电极与目标细胞之间大距离的一种方法是使细胞在其上直接生长出更长的突起,覆盖在电极上。
2010年底,一个德国研究小组与德国私营公司“Retina Implant AG”合作,发表了涉及人体视网膜下植入物测试研究的结果[10]。一个3×3毫米的微光电二极管阵列(MPDA)包含1500个像素,每个像素包含一个独立的光敏光电二极管和一个电极,被植入三名因黄斑变性而失明的患者的视网膜后。像素彼此之间的距离约为70微米,产生大约160个电极/平方毫米的空间分辨率——或者,如论文作者所指出的,每个电极的视觉锥角为15角分。需要注意的是,与使用外部摄像机生成视觉输入的植入物不同,MPDA的每个像素本身都包含一个光敏光电二极管,自主地从通过眼球接收到的光线中产生电流,供其自身关联的电极使用。因此,每个MPDA像素在完整的功能上都对应于一个感光细胞。这具有一个主要优势:由于MPDA固定在人眼视网膜后面,因此在眼球移动时会自动随之移动。并且,由于MPDA本身接收视觉输入以产生用于刺激电极的电流,因此头部或眼球的运动会自然地得到处理,无需人工处理。在一例患者中,MPDA直接放置在黄斑下方,与其他两例患者(其MPDA植入在视网膜中心较远的位置)相比,在实验测试中取得了优异的结果。在黄斑后植入植入物的患者取得的结果非常出色。他能够识别字母(5-8厘米大)和阅读单词,以及区分不同方向的黑白图案[10]。
MPDA植入物的实验结果也引起了人们对另一种视觉现象的关注,揭示了MPDA方法相对于使用外部成像设备的植入物的额外优势:视网膜细胞的后续刺激会迅速导致反应减少,表明视网膜神经元在短时间内反复受到刺激后会受到抑制。这意味着投射到固定在视网膜上或视网膜后面的MEA上的视觉输入将导致感知到的图像迅速消失,即使电极的电刺激保持不变。这是由于视网膜上的固定电极始终刺激视网膜上的相同细胞,导致细胞对恒定刺激的敏感性随着时间的推移而降低。然而,该过程是可逆的,一旦刺激消失,细胞就会恢复其初始敏感性。那么,完整的视觉系统如何处理这种效应?为什么健康的人能够长时间注视一个物体而不使其消失?如[11]中所述,人眼实际上会持续进行细微、不易察觉的眼球运动,导致相同的视觉刺激随着时间的推移投射到略微不同的视网膜位置,即使我们倾向于将眼睛聚焦并固定在某个目标物体上。这成功地规避了细胞反应衰减现象。由于植入物既充当感光细胞又充当电极刺激器,就像MPDA一样,自然的小眼球调整可以很容易地以简单的方式处理这种效应。其他使用外部视觉输入(即来自摄像机)的植入方法如果持续受到刺激,其投射图像将逐渐消失。摄像机图像的快速人工抖动可能无法解决问题,因为这种外部运动可能与眼球运动不一致,因此视觉皮层可能将其简单地解释为摇晃或模糊的场景,而不是所需的固定图像的稳定长期投射。视网膜下植入物的另一个优势是视网膜上受刺激区域与人眼视场中刺激感知位置之间的精确相关性。与视网膜神经节细胞(RGC)相反,其在视网膜上的位置可能不直接对应于其各个感受野的位置,双极细胞的刺激恰好被感知为与该双极细胞所在的视网膜几何位置相对应的视场中的那个点。视网膜下植入物的一个明显的缺点是涉及侵入性手术过程。
视网膜上植入物
[edit | edit source]视网膜上植入物位于视网膜顶部,因此最靠近视网膜神经节细胞(RGC)。因此,视网膜上植入物的目标是直接刺激RGC,不仅绕过受损的感光细胞,还绕过双极细胞、水平细胞和无长突细胞进行的任何中间神经视觉处理。这有一些优势:首先,视网膜上植入物的手术过程远没有视网膜下植入物那么关键,因为假体不需要从眼睛后面植入。此外,RGC的数量远少于感光细胞或双极细胞,允许更粗粒度的刺激,并增加电极间距(至少在视网膜的周边区域),或者电极密度甚至高于实际RGC密度,从而在刺激细胞时提供更大的灵活性和准确性。一项关于猕猴视网膜上周边伞状细胞的视网膜上刺激的研究提供了定量细节[7]。伞状细胞是一种RGC,形成视网膜中第二密集的视觉通路。它们的主要目的是编码视觉场中物体的运动,从而感知运动。这些实验是在体外进行的,将猕猴视网膜组织放置在61电极MEA(60微米电极间距)上。识别并电子刺激了25个独立的伞状细胞,同时分析了刺激阈值和最佳刺激位置等特性。阈值电流定义为在50%的刺激脉冲(脉冲持续时间:50毫秒)中触发目标细胞尖峰的最低电流,并通过逐步增加刺激强度直至记录到足够的尖峰响应来确定。请注意两个方面:首先,伞状细胞作为RGC表现出动作电位行为,而双极细胞则使用渐变电位。其次,MAE上的电极既用于刺激脉冲,也用于记录目标细胞的尖峰响应。25个伞状细胞位于61电极MAE上,电极密度明显高于伞状细胞密度,有效地使单个伞状细胞的感受野内有多个电极。除了测量触发可靠细胞响应所需的刺激阈值外,还确定了最佳刺激位置。最佳刺激位置是指相对于目标细胞的刺激电极的位置,在该位置实现了最低的刺激阈值。令人惊讶的是,发现它不在细胞体上,正如人们所预期的那样,而是在轴突路径向下大约13微米处。从那里开始,实验表明刺激阈值电流相对于电极到细胞体距离的增加呈预期的二次方增加。研究结果还表明,所有刺激阈值都远低于安全限值(约0.05mC/cm²,而0.1mC/cm²是(低)安全限值),并且细胞对刺激脉冲的反应很快(平均延迟0.2毫秒)且精确(延迟变化小)。此外,电极密度优于伞状细胞密度,允许通过刺激适当的电极可靠地寻址单个细胞,同时防止相邻细胞也引起尖峰。
在本节中,我们将简要概述一些目前正在研究的替代方法和技术。
传统的微电极阵列(MEA)使用氮化钛或氧化铟锡制成的电极,这导致植入物在长期生物相容性方面面临严重问题[12]。碳纳米管(CNT)是一种很有前景的金属电极替代材料,它结合了许多非常有利的特性。首先,它们完全生物相容,因为它们由纯碳制成。其次,它们的稳健性使其适用于长期植入,这是视觉假体的一个关键特性。此外,良好的导电性使其能够作为电极工作。最后,它们的多孔性导致极大的接触表面积,促使神经元在CNT上生长,从而改善神经元与电极的接触并降低引发细胞反应所需的刺激电流。然而,CNT电极只是最近才出现,目前只有很少的科学研究成果。
视网膜植入物的主要技术挑战之一是连接MEA与外部刺激、电源以及控制信号的电缆。电缆上的机械应力会影响其长期稳定性和耐久性,这对所用材料提出了很大的挑战。无线技术可以作为一种方法来避免实际视网膜植入物与外部设备之间的任何电缆连接。入射光通过眼睛产生的能量不足以触发神经反应。因此,要使无线植入物工作,必须向植入物提供额外的能量。斯坦福医学院提出的一种方法是使用红外LCD显示器将摄像机捕获的场景投射到护目镜上,将红外脉冲反射到视网膜上的芯片上。该芯片还使用光伏可充电电池来提供将红外光转换为足够强度的刺激脉冲所需的能量。类似于视网膜下植入方法,这也允许眼睛自然地将焦点固定在场景中的物体上,因为眼睛可以自由移动,从而允许护目镜上的不同部分的红外图像投射到视网膜上芯片上的不同区域。除了使用红外光之外,还可以使用感应线圈将电能和数据信号从外部设备传输到视网膜上的植入物。这项技术已成功应用于EPIRET3视网膜植入物[13]。然而,这些测试更多的是概念验证,因为只测试了患者在对电极施加刺激时感知视觉信号的能力。
一种通过极低的电流甚至在更长的距离上实现非常精确的神经刺激的方法是使神经元将其突起生长到电极上。通过在视网膜组织上应用正确的化学溶液,可以促进神经生长。这可以通过在MEA表面涂覆一层层粘连蛋白来实现。为了控制神经通路,层粘连蛋白不是均匀地涂覆在整个MEA表面,而是在形成特定图案的狭窄路径上涂覆,这些图案对应于神经元应该形成的连接。这种以精确、图案化的方式涂覆层粘连蛋白的过程称为“微接触印刷”。图5显示了这些层粘连蛋白路径的示意图。通过这种方法实现的成功定向神经生长使得与传统的电极刺激相比,可以应用显著更低的刺激电流,同时仍然能够可靠地触发神经反应[14]。此外,刺激阈值不再遵循相对于电极-胞体距离的二次增长,而是在较长距离(>200微米)时保持恒定在同一低水平。
如前面视网膜植入物挑战部分所述,许多微电极阵列存在间距大、电极数量少的问题,这影响了它们在神经网络中对神经元的特异性和靶向性。这是能够观察神经元群体网络动态和功能的限制因素。具体来说,许多细胞细节,如轴突传播速度和轴突信息处理,在低密度阵列中丢失。最近,研究人员利用互补金属氧化物半导体(CMOS)技术制造了具有高空间分辨率的高密度微电极阵列,这些阵列可以检测这些细胞信息,并通过铂黑沉积获得高信噪比。此类阵列在3.85 x 2.10 mm²的传感阵列上可以拥有26400个微电极。间距为17.5 μm,电极密度为每μm² 3265个电极,以配合1024个读出通道[15]。电极下方有许多开关,可以使用各种电极配置来评估芯片上的神经元群体。使用这种灵敏且密集的微电极芯片,可以从神经细胞记录单细胞识别、网络水平分析和轴突信息。这项技术为确定疾病建模和组织功能的电生理表型“生物标志物”打开了大门,因为可以解剖视网膜并在微电极阵列上进行培养和记录[16]。
光信号在视网膜中被解释,并且这些信息存储在神经节细胞层的神经元中,称为视网膜神经节细胞(RGCs)。然后,这些细胞通过动作电位发送这些信息,这些信息可以通过微电极阵列记录下来,以了解视网膜回路、发育和视觉场景的编码。这些体外实验通常首先从其天然组织中分离视网膜,将组织与视网膜神经节细胞向下朝向阵列培养,并使用光刺激进行记录。之后,使用稍后将解释的尖峰排序来分析数据。药物阻断剂和不同的光刺激可以用来确定光感受器的反应并评估功能。此外,研究人员可以评估视网膜突变对RGC尖峰行为的影响,以确定电生理生物标志物。在一个实验中,研究人员使用微电极阵列对野生型小鼠视网膜和FRMD7基因敲除小鼠进行记录。FMRD7是一种与受影响个体水平、注视依赖性快速眼球运动相关的突变。微电极阵列记录会话的数据表明,视网膜中对水平方向选择性细胞的反应有所丧失。野生型小鼠在水平或垂直方向选择性细胞中都没有反应丧失。这一发现表明,在未来的研究中,可以使用微电极阵列技术来确定视网膜疾病的电生理生物标志物[17]。

随着最新微电极技术的出现,可以从数千个电极记录神经活动,可以分析来自神经组织和网络的大量同步电生理数据,以揭示关于神经系统的重要电信息。当使用微电极阵列进行神经科学研究时,神经元(动作电位)的电信号被细胞外记录。这意味着在这些记录中获得的信号与膜片钳相反;动作电位的幅度为负,而不是膜片钳。这些细胞外特征不仅包含有关动作电位的信息,还包含突触机制(局部场电位)的信息,这些信息可以通过滤波和分析来识别。分析并将这些电生理信息分配给单个神经元的过程称为尖峰排序。


在微电极记录中分析的主要记录方面是尖峰序列。神经元可以通过其尖峰活动来识别,因为每个事件的时间取决于神经元相对于电极的大小、形状和位置。当从数千个神经元记录时,尖峰排序变得具有挑战性,类似于鸡尾酒会现象。当多个神经元彼此靠近时,电极很容易记录来自多个神经元的信号。因此,尖峰排序必须通过其电“杂音”来识别单个神经元,即使存在大量的背景“杂音”。尖峰排序是一个多步骤的过程,它获取神经元群体原始数据,并尽管存在这种背景噪声,仍然将尖峰分配给单个神经元。
尖峰排序过程的概述可以包括以下步骤:原始数据预处理 → 尖峰检测 → 尖峰提取和对齐 → 特征提取 → 聚类 → 分类。在这个通用工作流程中,尖峰排序算法获取神经群体中的原始数据,并首先通过滤除动作电位(噪声)的低频部分对其进行预处理。然后通过设置电压阈值来检测尖峰。之后,需要根据动作电位的一般特征(例如其位置)对提取的尖峰波形进行时间对齐。然后,通过使用主成分分析或小波从每个单独的波形中提取特征,这对于将数据减少到包含感兴趣信息必要的维度是必要的。然后对尖峰进行聚类,以便为单个神经元创建模板。这针对数据中的单个神经元完成。没有一种“一刀切”的尖峰排序算法,因为多电极记录在不同细胞类型、物种和记录类型之间可能存在差异。因此,必须调整和优化算法以产生能够准确表示原始数据的结果。但是,一旦数据经过尖峰排序,就可以从数据中获取大量信息,例如尖峰间期、不应期,以及能够将单个神经元的数据彼此绘制以检测差异[18]。
- ↑ Larry Squire;等(2012)。《基础神经科学第4版》。
{{cite book}}: 在“|author=”中明确使用等。(帮助) - ↑ a b c Lan Yue,James D. Weiland,Botond Roska,Mark S. Humayun(2016)。“恢复视力的视网膜刺激策略:基础和系统”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助)CS1维护:作者列表中有多个名称(链接) - ↑ Jackson,G.R.,Owsley,C.,Curcio,C.A(2002)。“衰老和年龄相关性黄斑病变中感光细胞的退化和功能障碍”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助)CS1维护:作者列表中有多个名称(链接) - ↑ Shigeru Sato,Yoshihiro Omori;等(2008)。“Pikachurin,一种dystroglycan配体,对于感光细胞带状突触的形成至关重要”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助); 在“|author=”中明确使用等。(帮助) - ↑ Jost B. Jonas,UlrikeSchneider,Gottfried O.H. Naumann(1992)。“人视网膜感光细胞的数量和密度”。施普林格。
{{cite journal}}: 引用期刊需要“|journal=”(帮助)CS1维护:作者列表中有多个名称(链接) - ↑ Ashmore Jonathan(2008)。“耳蜗外毛细胞的运动性”。美国生理学会。
{{cite journal}}: 引用期刊需要“|journal=”(帮助) - ↑ a b c Chris Sekirnjak,PawelHottowy,Alexander Sher,Wladyslaw Dabrowski,Alan M. Litke,E.J. Chichilnisky(2008)。“用于视网膜植入物设计的灵长类动物视网膜高分辨率电刺激”。神经科学学会。
{{cite journal}}: 引用期刊需要“|journal=”(帮助)CS1维护:作者列表中有多个名称(链接) - ↑ Jong-Mo Seo;等(2004)。“用于视网膜刺激的聚酰亚胺微电极阵列的生物相容性”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助); 在“|author=”中明确使用等。(帮助) - ↑ Eui Tae Kim;等(2009)。“基于硅-聚酰亚胺混合物的视网膜假体微电极阵列(MEA)的可行性”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助); 在“|author=”中明确使用等。(帮助) - ↑ a b Eui Ta Eberhart Zrenner,KarlUlrich Bartz-Schmidt,Heval Benav,Dorothea Besch,Anna Bruckmann,Veit-Peter Gabel,Florian Gekeler,Udo Greppmaier,Alex Harscher,Steffen Kibbel,Johannes Koch,Akos Kusnyerik,tobias Peters,Katarina Stingl,Helmut Sachs 等。Kim;等(2010)。“视网膜下电子芯片使盲人能够阅读字母并将它们组合成单词”。
{{cite journal}}: 引用期刊需要“|journal=”(帮助); 在“|author=”中明确使用等。(帮助)CS1维护:作者列表中有多个名称(链接) - ↑ Pritchard Roy。“视网膜上的稳定图像”。
{{cite journal}}: Cite journal 需要|journal=(帮助) - ↑ Asaf Shoval,ChrisopherAdams,Moshe David-Pur,Mark Shein,Yael Hanein,Evelyne Sernagor (2009)。“用于与视网膜组织有效连接的碳纳米管电极”。
{{cite journal}}: Cite journal 需要|journal=(帮助)CS1 维护:作者列表使用了多重名称 (链接) - ↑ Susanne Klauke,Michael Goertz,Stefan Rein,Dirk Hoehl,Uwe Thomas,Reinhard Eckhorn,Frank Bremmer,Thomas Wachtler (2011)。“使用无线眼内视网膜植入物刺激在失明人群中引起视觉感知”。视觉和眼科研究协会。
{{cite journal}}: Cite journal 需要|journal=(帮助)CS1 维护:作者列表使用了多重名称 (链接) - ↑ Neville Z. Mehenti,GrehS. Tsien,Theodore Leng,Harvey A. Fishman,Stacey F. Bent (2006)。“基于定向神经元生长用于单细胞刺激的模型视网膜界面”。施普林格。
{{cite journal}}: Cite journal 需要|journal=(帮助)CS1 维护:作者列表使用了多重名称 (链接) - ↑ Jan Muller;等 (2015)。“用于在亚细胞、细胞和网络水平研究神经元的 高分辨率 CMOS MEA 平台”。
{{cite journal}}: Cite journal 需要|journal=(帮助); 在|author=中明确使用等 (帮助) - ↑ Fiscella M;等 (2012)。“使用具有实时可切换电极选择的 高密度 CMOS 集成微电极阵列记录视网膜神经节细胞的特定群体”。
{{cite journal}}: Cite journal 需要|journal=(帮助); 在|author=中明确使用等 (帮助) - ↑ Fiscella M,Yonehara K,Drinnenberg A,Franke F,Müller J,Roska B 和 Hierlemann A (2016)。“使用 CMOS 高密度微电极阵列筛选人类眼部疾病的转基因小鼠模型”。
{{cite journal}}: Cite journal 需要|journal=(帮助)CS1 维护:作者列表使用了多重名称 (链接) - ↑ Gaute T Einevoll,Felix Franke,Espen Hagen,Christophe Pouzat 和 Kenneth D Harris (2012)。“利用多电极从数千个神经元获得可靠的脉冲序列记录”。
{{cite journal}}: Cite journal 需要|journal=(帮助)CS1 维护:作者列表使用了多重名称 (链接)


