感觉系统/神经感觉植入物
自 20 世纪后期以来,利用人工眼假体恢复盲人的视力一直是世界各地许多研究小组和一些私人公司的目标。与人工耳蜗类似,其关键概念是利用电脉冲刺激视觉神经系统,绕过人类视网膜上受损或退化的感光细胞。本章将描述视网膜植入物的基本功能,以及目前正在研究和开发的不同方法。视网膜植入物的两种最常见方法被称为“视网膜上”和“视网膜下”植入物,分别对应于位于视网膜顶部或后面的眼假体。我们不会涵盖任何与视网膜无关的恢复视力的方法,例如旨在从视觉输入刺激舌头的 BrainPort 视觉系统、视神经周围的袖状电极,或初级视觉皮层的刺激植入物。
图 1 描述了人类视网膜的示意图神经结构。我们可以区分三层细胞。第一层,位于最远离眼球晶状体的位置,由感光细胞(杆状细胞和锥状细胞)组成,其作用是将入射光转换为电信号,然后将电信号进一步传播到中间层,该层主要由双极细胞组成。这些双极细胞连接到感光细胞以及水平细胞和无长突细胞等细胞类型,将电信号传递到视网膜神经节细胞 (RGC)。有关双极细胞功能的详细说明,特别是在其细分为 ON 双极细胞和 OFF 双极细胞方面的说明,请参阅视觉系统的章节。最上层由 RGC 组成,收集来自水平细胞的电脉冲,并通过视神经将其传递到丘脑。从那里,信号被传播到初级视觉皮层。关于人类视网膜内信号处理的一些关键方面值得一提。首先,虽然双极细胞以及水平细胞和无长突细胞产生等级电位,但 RGC 反而产生动作电位。此外,每种细胞类型的密度在整个视网膜中并不均匀。虽然在中央凹区域有非常高的杆状细胞和锥状细胞密度,并且只有很少的感光细胞通过中间层连接到 RGC,但在视网膜的周边区域发现了远低于的感光细胞密度,而许多感光细胞连接到单个 RGC。后者也对 RGC 的感受野有直接影响,因为它倾向于向视网膜的外围区域快速增加,仅仅因为感光细胞密度较低以及连接到相同 RGC 的感光细胞数量增加。
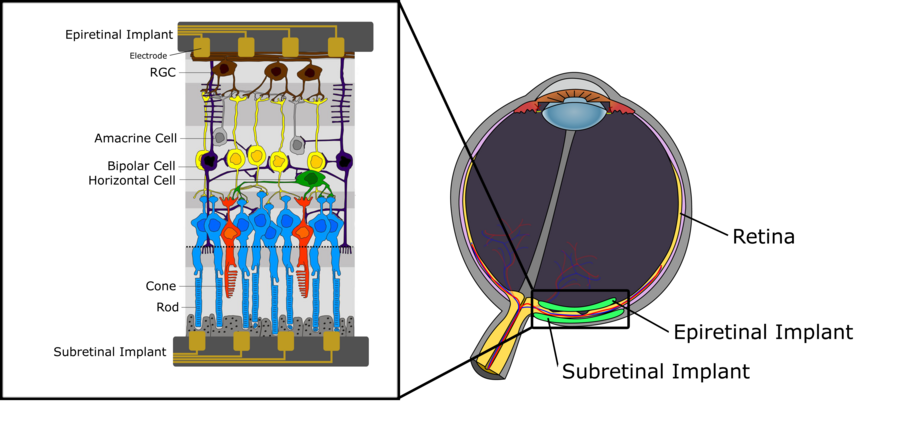
如本维基中先前所述,视网膜是位于眼球后部的感光组织,由包含各种细胞类型的不同层组成。视网膜主要参与神经视觉处理,信号起源于感光细胞,并通过神经节细胞的轴突传递到大脑。当这种分层组织退化时,可能会发生永久性视力丧失[1]。这通常是由视网膜退行性疾病引起的,例如年龄相关性黄斑变性 (AMD) 和视网膜色素变性 (RP),它们是两种最普遍的导致逐渐发生永久性视力障碍和视力丧失的疾病。目前,这两种视网膜疾病没有治愈方法,现代疗法只能减缓疾病进展,因此需要采取策略来恢复患者的视力。正在研究的一种工具是视网膜假体技术,该技术刺激可存活的视网膜组织以恢复视力,这将在后面的部分中进行描述[2]。
正如其名称所暗示的,黄斑变性是一种视网膜退行性疾病,主要发生在老年人。AMD围绕着黄斑中视锥细胞的进行性退化,导致视野中心出现模糊。这可能会发展到患者在视野中心完全失明的程度,被称为盲点。尽管AMD可能影响一只或两只眼睛,但它很少导致完全失明,因为患者的周边视力仍然完好。AMD主要有两种类型:干性和湿性。干性AMD占该疾病病例的大多数,其特征是在视网膜色素上皮和脉络膜之间的黄斑处出现称为脂蛋白的小黄斑沉积物。这种形式的AMD的进展最初是缓慢的,症状很少,只有在视网膜萎缩发生时才会加剧。湿性AMD的特征是脉络膜新生血管,即容易破裂并导致血液、蛋白质渗漏和瘢痕形成的异常血管生长,最终导致视锥细胞永久性损伤,从而导致视力丧失。湿性AMD的进展和视力丧失比干性AMD快得多[3]。
视网膜色素变性(RP)
[edit | edit source]

视网膜色素变性是一种遗传性退行性眼病,涉及杆状感光细胞,在年轻人中早期发病。在这种疾病中,杆状感光细胞逐渐退化,最终导致周边视野和夜视力的丧失。这种损失首先发生在外部,然后向内发展,对患者造成“隧道视野”的影响。视力障碍对称发生,两只眼睛在类似的时间范围内受到影响。与AMD不同,这种眼病可以扩展到周边以外,并通过视锥细胞的退化开始影响中央视野。这会导致患者持续视力丧失,最终可能导致完全失明,尽管这种情况非常罕见。视网膜色素变性是遗传的,并且有各种各样的基因突变会导致RP表型,从而导致多种遗传模式。然而,当遗传模式为常染色体显性遗传时,大多数病例与视紫红质基因的突变有关。这种突变会破坏视杆蛋白的功能,视杆蛋白是光转导级联反应中的一种必需蛋白。目前还没有治疗视网膜色素变性的方法[2]。然而,2008年,佐藤茂和他的同事发现了一种叫做Pikachurin的细胞外基质样视网膜蛋白,由于它参与光感受器细胞和双极细胞之间的相互作用,因此可能导致潜在的疾病治疗[4]。
用于视网膜刺激的微电极阵列
[edit | edit source]
如上所述,黄斑变性和视网膜色素变性导致的进行性视力障碍目前还没有治疗方法。然而,在这两种疾病中,尽管存在大量的光感受器细胞损失,但在疾病发病后数年,大量的内视网膜神经元仍然存活。这为通过电极对剩余的、仍然正常工作的视网膜细胞进行人工刺激提供了一个机会,从而为患者恢复视觉信息。微电极阵列使用电极通过紧密放置来刺激视网膜细胞外,从而允许电化学界面在阵列和视网膜周围发现的盐水中形成。电流通过阵列-视网膜界面注入,最终驱动神经元膜的去极化,从而产生动作电位。这种刺激可以是阴极的也可以是阳极的。 在阴极刺激中,负电荷出现在膜外,从而将正电荷驱入细胞内,导致去极化梯度,在靠近电极的地方最强。在阳极刺激中,超极化发生在最靠近电极的区域,去极化发生在更远的地方。因此,阴极通常被认为更有效,因为它需要更低的电流注入。刺激的相位不是影响刺激效果的唯一因素。波形,它可以呈现多种形状,如单相和双相,在视网膜神经元刺激的安全方面起着重要作用。例如,在猴子身上发现,只有阳极相位的单相电流会损害先前存活的细胞。因此,使用视网膜刺激的植入物将使用电荷平衡的双相波形。这种波形利用阴极相位进行刺激,利用阳极相位进行放电,从而平衡膜周围的电荷。有了这种刺激能力,视网膜假体可以植入视网膜后,称为视网膜下植入物。这将电极最靠近受损的光感受器细胞和仍然正常工作的双极细胞,而双极细胞是这里真正的刺激目标。如果刺激电极穿透脉络膜,脉络膜包含视网膜的血液供应,那么植入物有时被称为“脉络膜上”植入物。或者,植入物可以放置在视网膜顶部,最靠近神经节细胞层,目标是刺激RGC而不是光感受器细胞。这些植入物被称为视网膜上植入物。两种方法目前都正在由多个研究小组进行研究。它们都具有明显的优点和缺点。在我们更详细地分别处理它们之前,我们将描述两种情况下需要考虑的一些关键挑战[2]。
挑战
[edit | edit source]电极技术挑战
[edit | edit source]视网膜植入物面临的一个重大挑战是人眼中神经细胞的极高空间密度。人眼视网膜中大约有1.25亿个光感受器(杆状和锥状)和150万个神经节细胞,而人耳蜗中只有大约1.5万个毛细胞[5][6]。在中央凹,视觉锐度最高的地方,在一个平方毫米内有15万个锥状细胞。虽然与光感受器相比,RGC的总数要少得多,但它们在中央凹区域的密度接近锥状细胞的密度,这对用人工电极以足够高的空间分辨率来定位神经细胞提出了巨大挑战。实际上,所有当前使用视网膜植入物的科学实验都使用微电极阵列 (MEA) 来刺激视网膜细胞。高分辨率MEA实现了大约50微米的电极间距,导致每个平方毫米的电极密度为400个电极。因此,在中央凹区域,用传统的电极技术不可能实现电极与光感受器或RGC之间的OneToOne关联。然而,光感受器和RGC的空间密度都迅速下降到视网膜的外围区域,使得电极与外周神经细胞之间的OneToOne刺激更加可行[7]。另一个挑战是在安全范围内操作电极。施加大于0.1 mC/cm²的电荷密度可能会损坏神经组织[7]。通常,细胞距离刺激电极越远,刺激细胞所需的电流幅度就越大。此外,刺激阈值越低,电极的设计就可以越小,电极在MEA上的放置就可以越紧密,从而提高空间刺激分辨率。刺激阈值定义为触发至少50%的刺激脉冲中神经反应所需的最小刺激强度。由于这些原因,设计视网膜植入物的主要目标是在仍然保证可靠的刺激(即在RGC的情况下产生动作电位)目标细胞的情况下,使用尽可能低的刺激电流。这可以通过将电极尽可能靠近对施加的电场脉冲最敏感的目标细胞区域来实现,或者通过使细胞突起,即树突和/或轴突,生长在电极上,即使细胞体位于很远的地方,也能以非常低的电流刺激细胞。此外,固定在视网膜上的植入物会自动跟随眼球的运动。虽然这带来了许多显著的好处,但也意味着与植入物的任何连接(用于调整参数、读取数据或为刺激提供外部电源)都需要一根随植入物一起移动的电缆。由于我们每秒大约移动眼睛三次,这会使电缆和涉及的连接暴露在严重的机械应力下。对于一个应该在整个生命周期内无需外部干预就能正常工作的设备来说,这对所涉及的材料和技术提出了严峻的挑战。
生物相容性挑战
[edit | edit source]除了电气挑战之外,视网膜植入物的一个关键挑战是它与生物组织的接触。当外来物质(如植入物)与生理物质接触时,会触发免疫反应。这种反应通常表现为炎症或对该物质的隔离,这通常会导致相关组织的瘢痕形成。对于视网膜植入物来说,这是一个特别的问题,因为假体必须通过组织插入到适当的位置。如果使用的材料过于尖锐或放置不当,可能会损伤组织,从而进一步加剧免疫反应。此外,随着时间的推移,这些反应会导致电信号的丢失,因为免疫系统会随着时间的推移“包裹”受刺激的区域,从而难以实现长期植入。迄今为止,有一种上皮视网膜植入物,Argus II,能够通过在患者体内植入3年后仍然能够正常工作来规避生物相容性问题。该植入物利用硅胶,硅胶是一种具有良好长期生物相容性的材料,但它是一种刚性基材,无法轻松修改设备的配置。其他材料如聚酰亚胺和金也已被研究用于视网膜植入物的功能和生物相容性。聚酰亚胺是一种很有前途的聚合物,用于未来的植入物,因为在短期研究中,用这种材料制成的植入物已在人眼上发挥作用。这种材料的优点是生物相容性高、柔韧性好、成本低。随着技术进步产生更复杂的神经电极阵列,需要不同的基材来实现最大功能,适合视网膜植入物的材料优化正在进行中 [8] [9]。
顾名思义,视网膜下植入物是位于视网膜后方的视觉假体。因此,植入物位于最靠近受损感光细胞的位置,旨在绕过视杆和视锥细胞,刺激视网膜中下一层神经层的双极细胞。这种方法的主要优势在于,在感光细胞和需要被植入物模拟的双极细胞之间发生的视觉信号处理相对较少。也就是说,原始视觉信息(例如由摄像机捕获)可以直接转发,或者分别进行相对简单的信号处理,到刺激双极细胞的 MEA,从信号处理的角度来看,该过程相当简单。但是,这种方法也有一些严重的缺点。人眼视网膜中感光细胞的高空间分辨率,给开发和设计具有足够高刺激分辨率(因此电极间距低)的 MEA 带来了巨大挑战。此外,神经层在 z 方向(x-y 平面与视网膜曲率相切)的堆叠,在将电极放置在靠近双极细胞的位置时增加了另一个困难。由于 MAE 位于视网膜后方,电极和目标细胞之间存在显著的空间间隙需要克服。如上所述,电极到目标细胞距离的增加迫使 MAE 以更高的电流运行,从而增大了电极尺寸、单个电极刺激范围内的细胞数量以及相邻电极之间的空间分离。所有这些都导致刺激分辨率降低,以及使视网膜面临因电荷密度过高而导致组织损伤的风险。如下图所示,克服电极和目标细胞之间较大距离的一种方法是让细胞在更长距离上直接在电极顶部生长突起。
2010 年底,一个德国研究小组与德国私营公司“Retina Implant AG”合作,公布了对人类受试者进行视网膜下植入物测试的研究结果 [10] 。一个 3x3 毫米的微型光电二极管阵列 (MPDA) 包含 1500 个像素,每个像素都包含一个独立的光敏光电二极管和一个电极,被植入三名因黄斑变性而失明的患者的视网膜后方。像素之间的距离大约为 70 微米,产生大约 160 个电极每平方毫米的空间分辨率——或者,正如论文作者所指出的,每个电极的视觉锥角为 15 角分。需要注意的是,与使用外部摄像机生成视觉输入的植入物不同,MPDA 的每个像素本身都包含一个光敏光电二极管,它通过眼球接收的光线自主地为其自身的相关电极产生电流。因此,每个 MPDA 像素在其全部功能上相当于一个感光细胞。这有一个主要优势:由于 MPDA 固定在人眼视网膜后方,因此当眼球移动时,它会自动随之移动。并且由于 MPDA 本身接收视觉输入来生成刺激电极的电流,因此头部或眼球的运动可以自然地处理,不需要人工处理。在其中一名患者中,MPDA 被放置在黄斑的正下方,导致实验测试的结果优于另外两名患者,他们的 MPDA 被植入离视网膜中心较远的地方。在植入物位于黄斑后方的患者身上取得的结果相当非凡。他能够识别字母(5-8 厘米大)并阅读单词,以及区分不同方向的黑白图案 [10]。
使用 MPDA 植入物的实验结果也引起了人们对另一种视觉现象的关注,揭示了 MPDA 方法相对于使用外部成像设备的植入物的一个额外优势:随后的视网膜细胞刺激会迅速导致反应减弱,这表明视网膜神经元在短时间内反复受到刺激后会受到抑制。这意味着投射到固定在视网膜上或视网膜后方的 MEA 上的视觉输入将导致感知到的图像快速消失,即使电极的电刺激保持不变。这是因为固定在视网膜上的电极一直在刺激视网膜上的相同细胞,导致细胞随着时间的推移对持续刺激的敏感性越来越低。然而,这个过程是可逆的,一旦刺激消失,细胞就会恢复其初始敏感性。那么,完整的视觉系统是如何处理这种效应的呢?为什么健康的人能够长时间地固定一个物体而不会消失?如 [11] 中所述,人眼实际上会持续进行小的、不明显的 眼部运动,导致即使我们倾向于将眼睛集中在某个目标物体上,相同的视觉刺激也会随着时间的推移投射到视网膜上稍微不同的位置。这成功地规避了细胞反应衰减现象。由于植入物既充当感光细胞又充当电极刺激器,正如 MPDA 的情况一样,自然的小眼部调整可以很容易地以直接的方式来处理这种效应。其他使用外部视觉输入(即来自摄像机)的植入方法,如果持续刺激,其投射的图像会消失。快速的人工抖动相机图像可能无法解决问题,因为这种外部运动可能与眼部运动不一致,因此,视觉皮层可能会将其简单地解释为一个摇晃的或模糊的场景,而不是期望的固定图像的稳定长期投射。视网膜下植入物的另一个优势是,视网膜上受刺激的区域与人眼视觉场中感知到的刺激位置之间存在精确的关联。与 RGC 不同,RGC 在视网膜上的位置可能与它们各自感受野的位置不直接对应,刺激双极细胞会在与该双极细胞所在的视网膜几何位置相对应的视觉场中的那个点被感知到。视网膜下植入物的一个明显的缺点是,它需要进行侵入性的手术。
视网膜植入物位于视网膜顶部,因此最靠近视网膜神经节细胞 (RGCs)。 因此,视网膜植入物旨在直接刺激 RGCs,绕过受损的光感受器,以及双极细胞、水平细胞和无长突细胞的任何中间神经视觉处理。 这有一些优势:首先,视网膜植入物的外科手术程序远没有亚视网膜植入物那么关键,因为义肢不需要从眼睛后面植入。 此外,RGCs 的数量远少于光感受器或双极细胞,这使得可以用更宽的间距 (至少在视网膜的外周区域)进行更粗粒度的刺激,或者用比实际 RGC 密度更高的电极密度,从而在刺激细胞时获得更大的灵活性和准确性。 一项关于猕猴视网膜外周伞状细胞的视网膜刺激研究提供了定量细节 [7]。 伞状细胞是形成视网膜中第二密集的视觉通路的一种 RGCs。 它们的 主要目的是对视野中物体的运动进行编码,从而感知运动。 实验在体外进行,将猕猴视网膜组织放置在 61 电极 MEA (60 微米电极间距) 上。 识别了 25 个独立的伞状细胞,并在分析刺激阈值和最佳刺激位置等特性时对它们进行电子刺激。 阈值电流被定义为在 50% 的刺激脉冲 (脉冲持续时间:50 毫秒) 中触发目标细胞尖峰的最低电流,并通过逐步增加刺激强度来确定,直到记录到足够的尖峰响应。 请注意两个方面:首先,作为 RGCs 的伞状细胞表现出动作电位行为,而双极细胞则使用分级电位。 其次,MAE 上的电极既用于刺激脉冲,也用于记录目标细胞的尖峰响应。 25 个伞状细胞位于 61 电极 MAE 上,其电极密度明显高于伞状细胞密度,有效地在单个伞状细胞的感受野内产生了多个电极。 除了测量触发可靠细胞反应所需的刺激阈值外,还确定了最佳刺激位置。 最佳刺激位置是指刺激电极相对于目标细胞的位置,在该位置实现了最低刺激阈值。 令人惊讶的是,发现它不在细胞体上,如预期的那样,而是在轴突路径下方约 13 微米处。 从那里开始,实验表明刺激阈值电流随电极到细胞体距离的增加而预期地呈二次方增长。 研究结果还表明,所有刺激阈值都远低于安全限值 (约 0.05mC/cm²,而 0.1mC/cm² 则是 (低) 安全限值),并且细胞对刺激脉冲的反应很快 (平均 0.2 毫秒的延迟) 且精确 (延迟变化小)。 此外,伞状细胞密度更高的电极密度允许通过刺激适当的电极来可靠地寻址单个细胞,同时防止相邻细胞也引发尖峰。
替代技术方法概述
[edit | edit source]在本节中,我们将简要概述一些目前正在研究的替代方法和技术。
纳米管电极
[edit | edit source]传统的 MAEs 含有由氮化钛或氧化铟锡制成的电极,这使得植入物面临长期生物相容性的严重问题 [12]。 一种有希望的金属电极替代品是碳纳米管 (CNT),它结合了许多非常有利的特性。 首先,它们完全生物相容,因为它们是由纯碳制成的。 其次,它们的稳固性使它们适合长期植入,这是视觉义肢的关键特性。 此外,良好的导电性使它们能够作为电极运行。 最后,它们的高度多孔性导致极大的接触表面,鼓励神经元在 CNT 上生长,从而改善神经元与电极的接触,降低引发细胞反应所需的刺激电流。 然而,CNT 电极只是最近才出现,目前只有很少的科学结果可用。
无线植入方法
[edit | edit source]视网膜植入物的主要技术挑战之一是连接 MEA 与外部刺激、电源以及控制信号的电缆。 电缆上的机械应力会影响其长期稳定性和耐用性,对所用材料提出了巨大挑战。 无线技术可以绕过实际视网膜植入物与外部设备之间的任何电缆。 通过眼睛进入的光的能量不足以触发神经反应。 因此,要使无线植入物发挥作用,必须为植入物提供额外的电源。 斯坦福医学院提出的一种方法使用红外 LCD 显示器将视频摄像头捕获的场景投影到护目镜上,并将红外脉冲反射到位于视网膜上的芯片上。 该芯片还使用光伏可充电电池为将红外光转换为足够强的刺激脉冲所需的电力提供动力。 与亚视网膜方法类似,这也允许眼睛自然地固定并聚焦到场景中的物体上,因为眼睛可以自由移动,从而使护目镜上的红外图像的不同部分投影到位于视网膜上的芯片上的不同区域。 除了使用红外光外,还可以使用感应线圈将电力和数据信号从外部设备传输到视网膜上的植入物。 这种技术已在 EPIRET3 视网膜植入物中成功实施和测试 [13]。 然而,这些测试更多的是概念验证,因为只测试了患者在对电极施加刺激后感知视觉信号的能力。
定向神经生长
[edit | edit source]使神经元能够以极低的电流甚至在更长的距离内进行非常精确的神经刺激的一种方法是让神经元将其突起生长到电极上。 通过将正确的化学溶液应用于视网膜组织,可以鼓励神经生长。 这可以通过在 MEA 的表面上应用一层层粘连蛋白来实现。 为了控制神经路径,层粘连蛋白不是均匀地应用于整个 MEA 表面,而是在形成对应于连接的图案的狭窄路径中应用,神经元应该形成这些路径。 这种以精确、图案化的方式应用层粘连蛋白的过程称为“微接触印刷”。 图 5 显示了这些层粘连蛋白路径的外观。 使用这种方法获得的成功的定向神经生长使得能够应用比传统电极刺激低得多的刺激电流,同时仍然能够可靠地触发神经反应 [14]。 此外,刺激阈值不再随电极-细胞体距离的增加而呈二次方增长,而是在更长的距离 (>200 微米) 内保持恒定在同一低水平。
用于表征视网膜功能的微电极阵列:基于 CMOS 的技术
[edit | edit source]如视网膜植入物挑战部分所述,许多微电极阵列的间距很大,电极数量很少,这影响了它们在神经网络中对神经元的特异性和靶向性。 这是能够观察神经群体网络动态和功能的限制因素。 具体来说,许多细胞细节,如轴突传播速度和轴突信息处理,在低密度阵列中会丢失。 近年来,研究人员利用互补氧化物半导体 (CMOS) 技术创建了具有高空间分辨率的高密度微电极阵列,通过铂黑沉积,这些阵列可以检测到这种细胞信息以及高信噪比。 这种阵列可以在 3.85 x 2.10 毫米² 的传感阵列上拥有 26400 个微电极。 随着 17.5 μm 的间距,电极密度为 3265 个电极/μm²,以配合 1024 个读出通道 [15]。 由于电极下方有许多开关,因此可以使用各种电极配置来评估芯片上的神经群体。 使用这种灵敏且密集的微电极芯片,可以从神经细胞记录单细胞识别、网络级分析和轴突信息。 这种技术为疾病建模和组织功能的电生理表型“生物标志物”的确定打开了大门,因为解剖后的视网膜可以在微电极阵列上进行培养和记录 [16]。
视网膜记录
[edit | edit source]光信号在视网膜中被解释,并将该信息存储在神经节层的称为视网膜神经节细胞 (RGC) 的神经元中。然后,这些细胞通过动作电位发送该信息,该动作电位可以通过微电极阵列记录下来,以了解视网膜回路、发育和视觉场景的编码。这些体外实验通常首先通过将视网膜从其原生组织中分离出来、将视网膜神经节细胞朝下铺设在阵列上并使用光刺激进行记录来进行。之后,使用稍后将解释的尖峰排序分析数据。可以使用药物阻滞剂和不同的光刺激来确定光感受器响应和评估功能。此外,研究人员可以评估视网膜突变对 RGC 尖峰行为的影响,以确定电生理生物标志物。在一个实验中,研究人员使用微电极阵列用于野生型小鼠视网膜和具有 FRMD7 敲除的小鼠。FMRD7 是一种与受影响个体水平、注视依赖性快速眼球运动相关的突变。微电极阵列记录会议的数据表明,视网膜中对水平方向选择性细胞的响应发生了损失。野生型小鼠在水平或垂直方向选择性细胞中都没有响应损失。这种发现表明能够在未来的研究中使用微电极阵列技术来确定视网膜疾病的电生理生物标志物[17]。

凭借最新的微电极技术,可以从数千个电极中记录神经活动,可以分析来自神经组织和网络的大量同步电生理数据,以揭示有关神经系统的相关电气信息。在神经科学中使用微电极阵列时,神经元(动作电位)的电信号是在细胞外记录的。这意味着在这些记录中获取的信号与膜片钳相反;动作电位的幅度为负,而不是膜片钳。这些细胞外特征不仅包含有关动作电位的信息,还包含有关突触机制(局部场电位)的信息,可以通过过滤和分析来识别。将这些电生理信息分配给单个神经元的过程称为尖峰排序。


微电极记录中分析的主要记录方面是尖峰序列。神经元可以通过其尖峰活动来识别,因为每个事件的时机取决于神经元的大小、形状和相对于电极的位置。在从数千个神经元中记录时,尖峰排序变得具有挑战性,类似于鸡尾酒会现象。当多个神经元彼此靠近时,电极很容易记录来自多个神经元的信号。因此,尖峰排序必须通过其电“喋喋不休”来识别单个神经元,即使存在大量的背景“喋喋不休”。尖峰排序是一个多步骤过程,它采用神经群体中的原始数据并将尖峰分配给单个神经元,即使存在这种背景噪声。
尖峰排序过程的概述可以包括以下步骤:预处理原始数据→尖峰检测→尖峰提取和对齐→特征提取→聚类→分类。在这个一般工作流程中,尖峰排序算法首先通过过滤掉动作电位(噪声)的低频部分来预处理神经群体中的原始数据。然后通过设置电压阈值检测尖峰。之后,需要根据动作电位的普遍特征(例如其位置)将提取的尖峰波形与时间对齐。然后,使用主成分分析或小波从每个单独的波形中提取特征,这对于将数据简化为包含感兴趣信息的必要维度是必要的。然后对尖峰进行聚类,以便为单个神经元创建模板。这对数据中的单个神经元进行。没有一种“一刀切”的尖峰排序算法,因为多电极记录可能因不同的细胞类型、物种和记录类型而异。因此,必须调整和优化算法才能产生能够准确表示原始数据的结果。但是,一旦对数据进行尖峰排序,就可以从数据中获取大量信息,例如尖峰间隔、不应期,以及能够将单个神经元的数据彼此绘制以检测差异的能力[18]。
除了刺激视网膜之外,还可以刺激视觉系统的其他元素
使用套管电极,通常只有几个部分。
优点
- 对眼睛的创伤很小。
挑战
- 不太具体。

Mohamad Sawan 博士,蒙特利尔理工学院 Polystim 神经技术实验室 的教授和研究员,一直在研究一种视觉假体,该假体将被植入人类大脑皮层。Sawan 博士技术的基本原理是通过在由生物相容性材料制成的一系列电极网络上植入一个硅微芯片来刺激视觉皮层,其中每个电极注入一个刺激电流,以在失明者的视野中出现一系列发光点(像素阵列)。该系统由两个不同的部分组成:植入物和外部控制器。植入在视觉皮层中的植入物通过无线方式从外部控制器接收专用数据和能量。这种可植入部分包含所有必要的电路,用于产生电刺激并监督变化的微电极/生物组织界面。另一方面,电池供电的外部控制器包含一个捕获图像的微型摄像头,以及一个处理器和一个命令生成器,用于处理图像数据以选择和转换捕获的图像,以及生成和管理电刺激过程并监督植入物。外部控制器和植入物通过强大的经皮射频 (RF) 链接双向交换数据。植入物也是以相同的方式供电。(维基百科 [1])
优点
- 更大的刺激区域:中央视网膜视野 2° 半径对应于视网膜上的 1 mm²,但在视觉皮层中对应于 2100 mm²。
挑战
- 植入更具侵入性。
- 视野的一部分位于沟中,很难到达。
- 刺激可能引发癫痫发作。

人工耳蜗 (CI) 是一种植入的电子设备,通过直接刺激耳蜗内电极的听神经纤维来替代听觉系统的机械部分。人工耳蜗的候选人是双耳严重至极重感音神经性听力损失且听觉神经系统正常的人。它们被后天失聪者用于恢复对语音和其他声音的一些理解,以及被先天失聪的儿童使用,以使他们能够获得口语技能。(新生儿和婴儿听力损失的诊断使用耳声发射和/或听觉诱发电位记录。)最近一个相当重要的演变是使用双侧植入物,使接受者能够进行基本的声音定位。
植入物通过手术放置在耳朵后面的皮肤下。该设备的基本部分包括
外部
- 一个麦克风,拾取环境中的声音
- 一个语音处理器,选择性地过滤声音以优先考虑可听语音,并将电声信号通过一根细电缆发送到发射器,
- 一个发射器,它是一个由磁铁固定在耳廓后面的线圈,通过电磁感应将处理后的声音信号传输到内部设备,
内部

- 一个安装在皮肤下骨骼中的接收器和刺激器,它将信号转换为电脉冲,并通过一根内部电缆将电脉冲发送到电极,
- 一个由多达 24 个电极组成的阵列,缠绕在耳蜗中,它将脉冲发送到鼓阶中的神经,然后通过听觉神经系统直接发送到大脑
在正常听力者中,语音信号的主要信息载体是包络,而音乐则是细微结构。这与像普通话这样的声调语言也相关,其中词语的含义取决于它们的声调。研究还发现,细微结构中编码的双耳时间延迟决定了声音从哪里传来,而不是包络中编码的双耳时间延迟,尽管人们仍然可以感知到包络中编码的语音信号。
人工耳蜗中的语音处理器将麦克风输入信号转换为一系列平行电极信号,这些信号将被发送到耳蜗。这些信号之间最佳传递函数的算法仍然是研究的活跃领域。第一批人工耳蜗是单通道设备。原始声音经过带通滤波,只包含语音的频率范围,然后调制到 16 kHz 波上,以使电信号能够与神经进行电耦合。这种方法能够提供非常基础的听力,但非常有限,因为它完全无法利用耳蜗的频率-位置映射。
多通道植入的出现为尝试多种不同的语音处理策略打开了大门,以促进听力。这些策略可以大致分为波形策略和特征提取策略。
这些策略通常涉及对声音进行非线性增益(因为具有约 30 dB 动态范围的输入音频信号必须压缩成具有约 5 dB 动态范围的电信号),然后通过平行滤波器组。第一个尝试的波形策略是压缩模拟方法。在这个系统中,原始音频最初使用增益控制放大器进行滤波(增益控制降低了信号的动态范围)。然后将信号通过平行带通滤波器,这些滤波器的输出继续在适当的位置刺激电极。
压缩模拟方法的一个问题是,相邻电极之间存在很强的相互作用效应。如果由两个滤波器驱动的电极碰巧在同一时间进行刺激,则叠加的刺激会导致来自这两个电极范围内毛细胞的信号产生不必要的失真。解决这个问题的方法是连续交错采样方法 - 其中由相邻滤波器驱动的电极在略微不同的时间进行刺激。这消除了相邻电极之间的干扰效应,但引入了由于交错导致时间分辨率下降的问题。
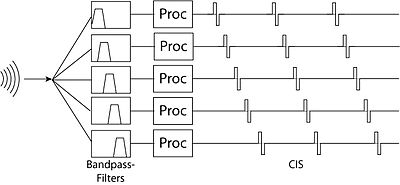
这些策略不太关注传输音频信号的滤波版本,而更多地关注提取信号的更抽象的特征并将它们传输到电极。最初的特征提取策略寻找语音中的共振峰(能量最大的频率)。为此,它们会应用宽带滤波器(例如,F0(基共振峰)的 270 Hz 低通滤波器,F1 的 300 Hz-1 kHz 滤波器,F2 的 1 kHz-4 kHz 滤波器),然后使用每个滤波器输出的过零点计算共振峰频率,并通过查看每个滤波器信号的包络来计算共振峰幅度。只有对应于这些共振峰频率的电极会被激活。这种方法的主要限制是,共振峰主要识别元音,而主要存在于较高频率的辅音信息则传输效果不佳。MPEAK 系统后来通过加入高频滤波器改进了这种设计,这些滤波器可以通过刺激高频电极和随机间隔的共振峰频率电极来更好地模拟清音(辅音)。[19][20][21]

目前,领先的策略是 SPEAK 系统,它结合了波形策略和特征检测策略的特性。在这个系统中,信号通过一个由 20 个带通滤波器组成的平行阵列。从每个滤波器中提取包络,并选择几个最强频率(具体数量取决于频谱形状),其余的频率被丢弃。这被称为“n-of-m”策略。然后对这些幅度进行对数压缩,以使声音的机械信号范围适应毛细胞的窄得多的电信号范围。
在最新的植入物中,Cochlear 公司使用 3 个麦克风而不是 1 个。额外的信息用于波束形成,即从正前方提取更多声音信息。这可以将与他人交谈时的信噪比提高多达 15 dB,从而显着增强噪声环境中的语音感知。
通过细致的手术技巧和仔细的电极设计,可以保留人工耳蜗植入后的低频听力。对于保留了低频听力的患者,MedEl 公司提供人工耳蜗(用于高频)和传统助听器(用于低频)的组合。这种被称为 EAS(电声刺激)的系统使用 18 毫米的导线,而完整的 CI 则使用 31.5 毫米的导线。(耳蜗的长度约为 36 毫米。)这显着改善了音乐感知,并改善了声调语言的语音识别。

对于高频,人类听觉系统仅使用音调编码来获取信息。但是,对于低频,还会使用时间信息:听觉神经会同步于信号的相位而放电。相比之下,最初的人工耳蜗仅使用传入信号的功率谱。在其新模型中,MedEl 将低频的时间信息(称为细微结构)纳入到刺激脉冲的时间确定中。这改善了音乐感知,以及像普通话这样的声调语言的语音感知。
在数学上,可以使用希尔伯特变换优雅地获得信号的包络和细微结构(见图)。相应的 Python 代码可在以下位置获得:[22]
可用电极的数量受到电极尺寸(以及由此产生的电荷和电流密度)以及沿内淋巴的电流扩散的限制。为了提高频率特异性,可以刺激两个相邻的电极。受试者报告他们感知到一个频率位于两个电极之间的单个音调。
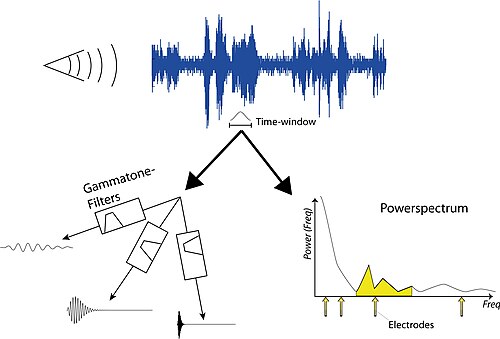
人工耳蜗中的声音处理仍然是研究的重点,也是制造商之间主要的产品差异之一。但是,基本的声音处理相当简单,可以实现以获得使用人工耳蜗患者感知到的声音质量的印象。该过程的第一步是对一些声音进行采样并分析其频率。然后选择一个时间窗口,在此期间我们希望找到 CI 电极的刺激强度。有两种方法可以实现这一点:i) 通过使用线性滤波器(参见伽马音滤波器);或 ii) 通过计算功率谱(参见频谱分析)。
全球已植入超过150,000台的人工耳蜗 (CI) 现已成为治疗重度至极重度听力损失的标准方法。由于人工耳蜗的益处越来越明显,支付方也越来越愿意支持人工耳蜗,并且由于大多数工业化国家对新生儿的筛查项目,许多患者在婴儿期就接受了人工耳蜗植入,并且很可能会在一生中一直使用。他们中的一些人可能需要在一生中进行诊断性扫描,而磁共振成像 (MRI) 可以帮助他们进行成像检查。对于大部分人口,包括中风、背痛或头痛患者,MRI 已成为诊断的标准方法。MRI 使用磁场脉冲来生成图像,当前的 MRI 机器使用的是 1.5 特斯拉磁场。0.2 到 4.0 特斯拉的设备很常见,并且射频功率在 1.5 特斯拉机器中可以达到 6 kW 的峰值。
人工耳蜗在历史上被认为与大于 0.2 T 的磁场不兼容。设备的外部部件必须始终移除。对于设备的内部部件,有不同的规定。现行美国食品药品监督管理局 (FDA) 指南允许在人工耳蜗植入后有限制地使用 MRI。Pulsar 和 Sonata (MED-EL Corp, Innsbruck, Austria) 设备获准在磁体到位的情况下进行 0.2 T MRI。Hi-res 90K (Advanced Bionics Corp, Sylmar, CA, USA) 和 Nucleus Freedom (Cochlear Americas, Englewood, CO, USA) 获准在手术移除内部磁体后进行高达 1.5 T 的 MRI。每次移除和更换磁体都可以使用局部麻醉下的小切口进行,但该手术可能会削弱磁体的囊袋,并可能导致患者感染。
尸体研究表明,在 1.5 T MRI 扫描仪中,植入物可能从内部设备中移位。然而,当使用加压敷料时,可以消除这种风险。然而,人工耳蜗会产生伪影,这可能会降低扫描的诊断价值。伪影的大小相对于患者头部的大小更大,这对于儿童的 MRI 扫描来说可能特别具有挑战性。Crane 等人 2010 年的一项研究发现,人工耳蜗周围区域的伪影平均前后尺寸为 6.6 +/- 1.5 cm(平均值 +/- 标准差),左右尺寸平均为 4.8 +/- 1.0 cm(平均值 +/- 标准差)(Crane 等人,2010)。([23])
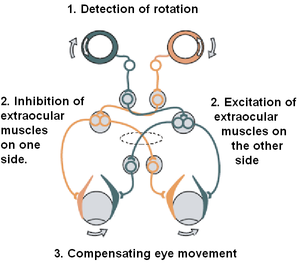
前庭系统受损的人会经历一系列症状,包括听觉和视觉障碍、眩晕、头晕和空间定向障碍。目前,对于前庭系统薄弱或受损的患者没有有效的治疗方法。在过去十年中,科学家开发了一种与人工耳蜗类似的电刺激装置,可以恢复半规管的功能。前庭植入旨在恢复前庭系统受损患者的平衡。图[24] 显示了一个前庭植入原型,它是 MED-EL (Innsbruck, Austria) 设计的改进型人工耳蜗。

这种前庭神经假体原型包含四个主要组件:一个电刺激器、三个放置在每个半规管壶腹的耳蜗外电极,以及一个耳蜗内阵列。当前庭植入开启时,以电荷平衡双相脉冲形式的电刺激序列会沿着每个耳蜗外电极传送到相应的 vestibular nerve [24]。最终,电刺激通过稳定通过前庭-眼反射 (VOR) 的注视,从而恢复患者的平衡。朝植入式假体方向的进展表明,有效地恢复头部旋转的正常前庭感觉传导取得了令人鼓舞的结果。然而,在不引起不必要的 neuronal activity 的情况下,实现对三维头部运动进行慢性编码的准确刺激范式仍然是几个关键挑战之一。
1963 年,Cohen 和 Suzuki [25] 通过证明可以通过电刺激前庭神经的壶腹支来诱发眼球运动,从而引入了前庭假体的概念。随后的研究致力于设计一种连续而准确的刺激模型,用于康复患有不同类型的前庭疾病的患者,例如双侧前庭功能丧失 (BVL) 和美尼尔氏病 [24] [26]。在 Cohen 和 Sukui 开创性工作的四十年后,Merfeld 及其同事开发了首个前庭装置,通过电刺激前庭神经来产生平滑的眼球运动 [27] [28]。神经电子前庭装置的可行性进一步激发了研究人员将运动检测系统集成到一起,以测量头部运动。Santina 及其同事 [29] [30] [31] [32] 使用陀螺仪传感器来测量三维空间中的运动,并对这些信息进行编码以生成信号,这些信号通过前庭神经控制每只眼睛的肌肉。截至 2012 年底,全球只有两个小组对人类进行了前庭植入研究:华盛顿大学 Jay Rubinstein 领导的团队,以及由荷兰马斯特里赫特大学医学中心 Herman Kingma 领导的团队和由瑞士日内瓦大学医院 Jean-Phillippe Guyot 领导的第二个团队的联合努力 [24]。Jay Rubinstein 在 2010 年领导了第一项前庭临床研究。Rubinstein 及其同事已成功安装了前庭起搏器,以减少或停止诊断为美尼尔氏病的患者的自发性眩晕发作 [26]。该设备与手持控制器相结合,可以启动和停止可以定向到任何一个或所有电极的一系列电刺激,但不能对运动进行编码 [26]。不幸的是,植入患者的前庭起搏器导致听觉和前庭功能都明显下降 [33] [26] [24]。该小组正在探索不同的电刺激范式,方法是将有关运动的信息纳入其中 [33]。第二次人类临床研究是由 Kingma、Guyot 及其同事在 2012 年进行的。本研究中使用的前庭植入由 MED-EL 原型制作。Perez-Fornos 及其同事 [24] 表明,患者获得了令人满意的功能性恢复水平,使他们能够进行日常活动,例如步行。
目前正在通过持续的大学与行业之间的合作取得进展。有四个领先的大学和/或行业合作伙伴正在努力将前庭假体用于临床应用。这些团队包括:华盛顿大学的 Rubinstein 和 Cochlear Ltd (Lane Cove, Australia),Della Santina 的团队在 Johns Hopkins 医学院 [Baltimore, MD, USA] 的前庭神经工程实验室,Daniel Merfeld 的团队在哈佛大学的 Jenks 前庭生理实验室 [Massachusetts Eye and Ear Infirmary, Boston, MA, USA],以及 Herman Kingma、Jean-Philippe Guyot 和 MED-EL 的联合努力。
最先进的前庭植入技术是一个两步式系统,该系统会产生电刺激,以响应围绕相应轴 (前、后或水平管) 的旋转,从而刺激三个壶腹神经。然而,假体神经刺激的生物物理学仍然是模拟正常感觉传导的一个挑战。尽管我们已经了解了前庭神经传入如何对头部运动进行编码,但我们尚未了解如何为多通道假体设计非侵入性刺激编码策略。积极的研究一直在继续,重点是克服设计和信号传导方面的限制。
目前的脑神经假体旨在刺激植入的脑神经组织,但持续的兴奋性刺激会导致神经功能缺损 [26]。最终,人们非常需要一种既能激发一个方向的头动,又能抑制相反方向的运动的装置。Santina 及其同事开发的最新原型系统 SCSD1 已证明直流刺激可以引起兴奋性和抑制性 VOR 反应 [34]。他们的结果表明,将前庭系统引入人工基线可能会以不可预测的方式改变兴奋性和抑制性阈值的动态范围。另一方面,临床研究表明,人类可以在合理的时间内(几分钟)适应人工神经活动的缺失和存在 [35]。一旦适应完成,就可以调整刺激的幅度和频率调制,以引发不同速度和方向的平滑眼球运动 [35]。
电假体的另一种设计局限性是电流会扩散到目标神经组织之外,并引起错误的通道刺激 [36] [37]。因此,这种电流扩散会导致眼轴和头部旋转之间的错位 [38]。因此,方向性神经可塑性的机制可以为人类提供对齐良好的反应。其他研究表明,红外神经刺激对于靶向特定神经元有利,并且对附近的神经元群体侵入性较小 [36] [38]。光学的使用将允许更高的空间选择性和改善的手术通路 [36]。
此外,前庭假体开发面临的一个基本挑战是考虑前庭末端器官的信息如何引发特定运动。研究表明,反射和感知反应取决于刺激哪些前庭传入输入 [33]。对手术方法进行了检查,以准确地放置电极相对于传入神经,最终这可能会极大地影响刺激所需反应的能力。
由于内耳的听觉区和前庭区是相连的,因此电流扩散到目标壶腹神经之外,以及/或手术风险可能会干扰耳蜗神经活动。人类植入后可能会出现听力损失的风险,正如在恒河猴身上观察到的那样 [39]。Santina 及其同事 [39] 发现,电极植入会导致高达 14 dB 的听力损失,而电刺激的传递会进一步降低听力 0.4-7.8 dB。这项研究表明,电流扩散到耳蜗毛细胞可能会导致附近耳蜗区域的随机活动。
嗅觉植入
[edit | edit source]
嗅觉丧失(嗅觉丧失)约占总人口的 5%。完整的嗅觉系统是感知饮酒和进食时的风味的核心部分。大多数出现味觉丧失的问题都是由嗅觉障碍引起的。此外,对气味的感知也是我们生活质量的核心。许多体验,如春雨、鲜花或家的气味,都会增添任何事件,即使难以描述。虽然用局部和全身类固醇可以解决嗅觉丧失的炎症原因,但针对其他常见嗅觉丧失原因的许多治疗方法,包括上呼吸道感染 (URI)、头部外伤和衰老,尚未被证明有效。

可行性研究
[edit | edit source]Eric H. Holbrook、Sidharth V. Puram 等人进行了一项研究,以确定通过对人类嗅球进行人工电刺激诱发嗅觉的可行性。招募了五名受试者(年龄 43-72 岁)。三名受试者报告在电刺激下感觉到气味。所有受试者都耐受了这项研究,只有轻微的不适。测试受试者都能够感知气味,这已通过市售的 40 项刮嗅识别测试得到证实。在内镜引导下,无需局部麻醉,将单极或双极电极放置在筛板外侧薄板与颅底交界处的 3 个区域:(1) 额窦开口后方的前筛板;(2) 蝶骨面前方的后筛板;(3) 中筛板,近似于前点和后点之间距离的一半 [40]。在 0.2-0.3ms 内,对植入物进行刺激,强度范围为 1 到 20 mA。5 名受试者中的 3 人报告有嗅觉体验,但无法清楚地说明该气味类似于什么,并且彼此之间存在差异。气味的感知不会随着不同的强度或电极位置而发生重大变化,但有报道称微小的偏差被描述为“甜”、“酸”或“坏”。单极或双极电极之间没有差异。感知到的气味被描述为“洋葱味”、“消毒剂味”或“酸味”,以及“水果味”或“难闻”。当被要求在 1 到 10 的范围内对感知到的气味强度进行排名时,结果范围为 2 到 4。所有受试者还体验到设备造成的一些不适,表现为位于接地电极、眼内眦或鼻梁、鼻尖或在一种情况下眼后深处的一种跳动、刺痛或搏动感。放置在嗅裂的电极会导致四名受试者打喷嚏或不适,并且在唯一一名能够忍受它的人身上没有出现嗅觉感知。总之,这项研究首次通过嗅球的电刺激实现了嗅觉感知。作者计划进一步探索此类植入物的使用,并指出“未来的工作将扩展试验,纳入没有嗅觉的受试者,并开发更一致的嗅觉感知客观测量方法。”这项研究仅旨在作为未来研究嗅觉丧失的嗅觉恢复电刺激技术的可能性概念验证 [41]。
未来方向
[edit | edit source]气味的电子测量
[edit | edit source]如今,气味可以通过多种不同的方式进行电子测量,例如:质谱法、气相色谱法、拉曼光谱法,以及最近的电子鼻。一般而言,它们假设不同的嗅觉受体对特定分子理化性质具有不同的亲和力,并且这些受体的不同激活会产生反映气味的时空活动模式。
电子鼻
[edit | edit source]
电子鼻是一种基于化学传感器阵列和模式识别的仿生气味传感装置。它们用于识别和量化溶解在空气(或其他载体物质)中的物质。电子鼻由采样装置(类似于鼻子)、传感器阵列(类似于嗅觉受体神经元)和计算单元(类似于大脑)组成。
传感器阵列
[edit | edit source]与动物鼻子一样,使用非特异性传感器。这不仅是因为很难找到非常特异的传感器,而且还因为人们希望覆盖巨大的可能化合物范围,而无需针对每种化合物使用传感器。此外,如果处理基于多个传感器的信息,则会更加稳健、精确和高效。当这些传感器与化合物接触时,它们的电性能会发生变化(例如,电阻变大)。这种改变会导致电压变化,电压变化会被数字化(AD 转换器)。
最常用的传感器类型包括金属氧化物半导体 (MOS)、石英晶体微天平 (QCM)、导电聚合物 (CP) 和表面声波 (SAW) 传感器。另一种很有前途的技术是使用蛋白质作为传感器的生物电子鼻。还可以结合使用不同的传感器来获得更精确的结果,并结合几种传感器类型的优点,例如更好的时间响应速度与更好的灵敏度。
示例:导电聚合物传感器的运行原理
[edit | edit source]导电聚合物传感器由约 2 到 40 种不同导电聚合物(长链有机分子)阵列组成。一些气味分子渗透到聚合物薄膜中,导致薄膜膨胀,从而增加其电阻。许多聚合物类型的电阻增加可以用渗流理论来解释。[42] 由于材料的化学性质,不同的聚合物对相同的气味反应不同。
传感器信号必须与模式识别算法匹配的气味混合物。可以使用多元统计方法创建潜在组合的数据库,并在出现气味时找到最佳匹配,或者可以训练神经网络来识别模式。通常也使用主成分分析来降低传感器数据的维度。
电子鼻有许多应用。它们被用于航空航天和其他工业领域,以检测和监测有害或危险物质,以及用于质量控制。安全方面的可能应用包括毒品或炸药检测。电子鼻可能有一天能够取代警犬。一种非常强大的应用可能是诊断改变呼吸或排泄物或血液化学成分的疾病,从而可能取代侵入性诊断技术。它还可以用于诊断癌症,因为某些癌细胞可以通过其挥发性有机化合物谱来识别。通过嗅觉诊断癌症已被发现对狗、苍蝇有效,[43] 但具有高灵敏度和特异性的实用方法仍在开发中。另一种医疗应用是通过基于电子鼻的嗅觉植入物治疗嗅觉缺失症(无法感知气味)。这同样仍在开发中。相比之下,电子鼻已用于环境监测和保护。在机器人技术中,电子鼻可用于跟踪空气中的气味或地面的气味。特别是对于机器人技术而言,更好地了解昆虫的嗅觉系统将非常有趣,因为为了利用气味导航或定位气味来源,往往被忽视的时间刺激信息必须被利用。
昆虫可以跟踪气味,因为它们可以对大约 150 毫秒内的变化做出反应,并且它们的一些受体能够描绘出至少 10 赫兹以上的频率发生的快速气味浓度变化。相比之下,导电聚合物以及金属氧化物电子鼻的响应时间范围从几秒到几分钟,[42] 只有少数报道在几十毫秒范围内。
- ↑ Larry Squire; et al. (2012). Fundamental Neuroscience 4th edition.
{{cite book}}: Explicit use of et al. in:|author=(help) - ↑ a b c Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun (2016). "Retinal stimulation strategies to restore vision: Fundamentals and Systems".
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jackson, G.R., Owsley, C., Curcio, C.A (2002). "Photoreceptor degeneration and dysfunction in aging and age-related maculopathy".
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Shigeru Sato, Yoshihiro Omori; et al. (2008). "Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation".
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann (1992). "Count and density of human retinal photoreceptors". Springer.
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Ashmore Jonathan (2008). "Cochlear Outer Hair Cell Motility". American Physiological Society.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ a b c Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky (2008). “用于人工视网膜植入物设计的灵长类视网膜高分辨率电刺激”。神经科学学会。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jong-Mo Seo; 等 (2004). “用于视网膜刺激的聚酰亚胺微电极阵列的生物相容性”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Eui Tae Kim; 等 (2009). “基于硅树脂-聚酰亚胺混合材料的人工视网膜微电极阵列 (MEA) 的可行性”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ a b Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs 等.e Kim; 等 (2010). “视网膜下电子芯片让失明患者能够阅读字母并将字母组合成单词”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ↑ Pritchard Roy. “视网膜上的稳定图像”。
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor (2009). “用于有效与视网膜组织连接的碳纳米管电极”。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler (2011). “使用无线眼内人工视网膜植入物进行刺激在失明人群中引起视觉感知”。视觉与眼科研究协会。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent (2006). “基于定向神经元生长的单细胞刺激模型视网膜界面”。施普林格。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jan Muller; 等 (2015). “用于在亚细胞、细胞和网络水平上研究神经元的 CMOS 高分辨率 MEA 平台”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Fiscella M; 等 (2012). “使用具有实时可切换电极选择的 CMOS 集成高密度微电极阵列从定义的视网膜神经节细胞群体中记录”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B 和 Hierlemann A (2016)。“使用 CMOS 高密度微电极阵列筛选人类眼部疾病的转基因小鼠模型”。
{{cite journal}}: 引用期刊需要|journal=(帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat 和 Kenneth D Harris (2012)。“使用多电极从数千个神经元获得可靠的尖峰序列记录”。
{{cite journal}}: 引用期刊需要|journal=(帮助)CS1 维护:多个名称:作者列表 (链接) - ↑ http://www.utdallas.edu/~loizou/cimplants/tutorial/tutorial.htm
- ↑ www.ohsu.edu/nod/documents/week3/Rubenstein.pdf
- ↑ www.acoustics.bseeber.de/implant/ieee_talk.pdf
- ↑ T. Haslwanter (2012)。“希尔伯特变换 [Python]”。 私人通信。
- ↑ Crane BT, Gottschalk B, Kraut M, Aygun N, Niparko JK (2010) 磁共振成像在人工耳蜗植入后 1.5 T 下。Otol Neurotol 31:1215-1220
- ↑ a b c d e f Perez Fornos, A.; Guinand, N.; Van De Berg, R.; Stokroos, R.; Micera, S.; Kingma, H.; Pelizzone, M.; 和 Guyot, J. (2014)。“人工平衡:使用原型前庭神经假体恢复人类前庭眼反射”。神经病学前沿。5。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Cohen, B. 和 Suzuki, J. (1963)。“壶腹神经刺激诱发的眼球运动”。美国生理学杂志。204: 347–351。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ a b c d e Golub, J. S.; Ling, L.; Nie, K.; Nowack, A.; Shepherd, S. J.; Bierer, S. M.; Jameyson, E.; Kaneko, C. R.; Phillips, J. O.; 和 Rubinstein, J. T. (2014)。“人类前庭系统的假体植入”。耳鼻喉科与神经病学。1: 136–147。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Gong, W. 和 Merfeld, D. M. (2000)。“使用模式化电刺激的原型神经半规管假体”。生物医学工程年鉴。28: 572–581。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Lewis, R. F.; Haburcakova, C.; Gong, W.; Makary, C.; 和 Merfeld, D. M. (2010)。“使用半规管传入神经的慢性运动调制电刺激研究前庭眼反射适应”。神经生理学杂志。103: 1066–1079。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Dai, C.; Fridman, G. Y.; Chiang, B.; Davidovics, N.; Melvin, T.; Cullen, K. E. 和 Della Santina, Charles C. (2011)。“交叉轴适应在使用头部安装的多通道前庭假体进行慢性刺激期间改善了 3D 前庭眼反射对准”。实验脑研究。210: 595–606。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Dai, C.; Fridman, G. Y.; Davidovics, N.; Chiang, B.; Ahn, J. 和 Della Santina, C. C. (2011)。“使用多通道前庭假体恢复恒河猴的 3D 前庭感觉”。听力研究。281: 74–83。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Dai, Chenkai 和 Fridman, Gene Y. 和 Chiang, Bryce 和 Rahman, Mehdi A. 和 Ahn, Joong Ho 和 Davidovics, Natan S. 和 Della Santina, Charles C. (2013)。“方向可塑性使用多通道前庭假体快速改善了猴子 3D 前庭眼反射对准”。耳鼻喉科研究协会杂志。14: 863–877。
{{cite journal}}: CS1 维护:多个名称:作者列表 (链接) - ↑ Davidovics, Natan S. 和 Rahman, Mehdi A. 和 Dai, Chenkai 和 Ahn, JoongHo 和 Fridman, Gene Y. 和 Della Santina, Charles C. (2013). "利用脉冲速率和电流调制结合预补偿对准的多通道前庭假体在猴子中提高了VOR性能". 耳鼻喉研究协会杂志. 14: 233–248.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b c Phillips, Christopher 和 DeFrancisci, Christina 和 Ling, Leo 和 Nie, Kaibao 和 Nowack, Amy 和 Phillips, James O. 和 Rubinstein, Jay T. (2013). "人类受试者前庭末端器官电刺激的姿势反应". 实验脑研究. 229: 181–195.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ Fridman, Gene Y. 和 Della Santina, Charles C. (2013). "安全直流电刺激扩展神经假体功能". IEEE 神经系统与康复工程学报. 21: 319–328.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b Guyot, Jean-Philippe 和 Sigrist, Alain 和 Pelizzone, Marco 和 Kos, Maria I. (2011). "人类前庭系统稳态电刺激的适应". 耳鼻喉年鉴. 120: 143–149.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b c Harris, David M. 和 Bierer, Steven M. 和 Wells, Jonathon D. 和 Phillips, James O. (2009). "前庭假体的光神经刺激". SPIE 论文集. 5.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ Della Santina, Charles C. 和 Migliaccio, Americo A. 和 Patel, Amit H. (2007). "使用电刺激恢复三维前庭感觉的多通道半规管神经假体". IEEE 生物医学工程学报. 54: 1016–1030.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b Lumbreras, Vicente 和 Bas, Esperanza 和 Gupta, Chhavi 和 Rajguru, Suhrud M. (2014). "脉冲红外辐射通过调节线粒体钙循环激发培养的新生耳蜗和前庭神经节神经元". 神经生理学杂志.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b Dai, Chenkai 和 Fridman, Gene Y. 和 Della Santina, Charles C. (2011). "前庭假体电极植入和刺激对恒河猴听力的影响". 听力研究. 277: 204–210.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ Holbrook EH,Puram SV,See RB,Tripp AG,Nair DG。(2019)。“通过经筛骨电刺激嗅球诱发嗅觉”。国际过敏与鼻科论坛. 2019, 9: 158–164.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ Holbrook EH,Puram SV,See RB,Tripp AG,Nair DG。(2019)。“通过经筛骨电刺激嗅球诱发嗅觉”。国际过敏与鼻科论坛. 2019, 9: 158–164.
{{cite journal}}: CS1 maint: 多个姓名:作者列表 (link) - ↑ a b Arshak, K.;Moore, E.;Lyons, G.M.;Harris, J.;Clifford, S. (2004 年 6 月)。“电子鼻应用中气体传感器的综述”。传感器综述. 24 (2): 181–198. doi:10.1108/02602280410525977.
- ↑ Strauch, Martin; Lüdke, Alja; Münch, Daniel; Laudes, Thomas; Galizia, C. Giovanni; Martinelli, Eugenio; Lavra, Luca; Paolesse, Roberto; Ulivieri, Alessandra; Catini, Alexandro; Capuano, Rosamaria; Di Natale, Corrado (2014年1月6日). "不仅仅是苹果和橘子——用果蝇的触角检测癌症". 科学报告. 4. doi:10.1038/srep03576.
神经元的光刺激是一个新兴的研究领域。通过将聚焦的光源照射到神经细胞上,使其去极化来实现神经元的发射。实现这一目标主要有两种方法:用激光照射神经元,产生局部温度梯度;以及将对光敏感的通道或受体导入神经细胞,使其对光敏感,类似于人眼视网膜中的视杆细胞和视锥细胞。与传统的电刺激相比,光刺激的优势在于更高的精确度和更少的组织损伤或没有组织损伤。[1]
与光刺激相比,电刺激存在着固有的局限性。为了引发可靠的神经元发射,电极必须与目标组织物理接触或非常靠近目标组织。将电极植入神经组织会导致神经组织及其周围组织的损伤。
在许多情况下,电极阵列被植入导电组织中,这会导致电流扩散,进一步降低了可以达到的空间分辨率。
诱发的神经元活动的测量结果往往会被比测量的脑活动大得多的刺激伪影污染。在靠近兴奋部位进行测量时,尤其如此。
相比之下,光刺激可以可靠地实现单个细胞或小群细胞的兴奋。它不需要直接接触目标组织,从而减少了组织损伤。最后,靠近兴奋部位的神经元反应的电生理记录不会被兴奋刺激污染。[1] [2] [3] 尽管电刺激存在上述缺点,但它仍然是患者神经刺激中最成熟、最可靠的方法。
红外刺激是基于红外激光在神经元内部产生局部温度梯度。它不需要在刺激前对细胞进行任何改造。低能量激光不会对组织造成损伤,并能引发无伪影的刺激。导致神经元放电的确切机制尚不清楚。然而,研究表明,这种现象很可能是由于局部光热过程造成的。因此,红外辐射会产生局限在很小空间内的温度梯度,并在辐射停止后迅速消失。高达 9°C 的局部温度升高被认为会导致分子构象发生变化,最终导致神经元放电。在高辐射频率下,热量会叠加,导致受照射的组织逐渐升温,最终损害细胞。[2][3]
视光遗传学是指通过导入外源基因使细胞对光敏感,从而能够以高时空分辨率地改变神经元发射模式。这些基因可以在动物的基因改造过程中表达,也可以通过病毒等载体导入。如今,大多数用于光敏基因的基因最初是在单细胞生物体如藻类或古细菌中发现的。这些基因可以编码光敏离子通道或受体,产生对光刺激的不同反应。

对于神经元激活,通常使用天然视紫红质通道(ChR)或其基因工程改造的变体。ChRs 是对光敏感的非特异性阳离子通道,当用蓝光(480nm)激发时,通道会打开。在神经细胞中,ChR 开放会导致钠离子涌入和膜去极化。[4] [5] 光敏成分是全反式视黄醛,它也存在于人眼视网膜中。光诱导全反式视黄醛到 13-顺式视黄醛的构象变化,从而允许阳离子穿过通道。[4][5][6][7] 在视黄醛结合位点附近引入特定的点突变可以改变通道的动力学特性和特异性。[8] 将 ChR 与其他蛋白质连接可以产生具有多种功能的工具,例如对导入构建体的体内监测。[9]
视紫红质卤素(HR)是用于光激活的神经元抑制的光控氯离子泵。在敏感的神经元中,黄光(570nm)的光学激发会导致氯离子进入细胞并发生超极化。[10][11] 与 ChR 一样,光敏分子也是全反式视黄醛。由于 HR 和 ChR 中视黄醛的稳定性不同,以及由此产生的波长敏感性差异,它们可以在同一个细胞中使用,并分别进行靶向。这使得能够对神经回路中的活动进行非常精确的控制。[11][12]
为了光学控制细胞通路,开发了 Opto-XR 蛋白质,[13] 其中 X 代表目标信号通路。Opto-XRs 由动物视紫红质(牛、大鼠等)组成,其胞内结构域被细胞的信号序列替换。[14] 这使得能够对细胞的信号通路进行光学调节。信号序列可以通过光落在视紫红质上诱导的构象变化来激活或失活。这使得能够特异性地激活某些受体通路,如血清素或肾上腺素信号通路。[13][15]
在神经假体中,电刺激长期以来一直被用于诱发神经元放电。然而,电流的扩散和电场的产生限制了可以实现的空间分辨率。这限制了传输信号的保真度。[16] 在听觉假体的情况下,最多可以使用大约二十个电极,这使得所获得的音质远远低于预期目标。转向光学技术可以实现更小区域的激活,从而增加潜在感知音调的数量。最近光学刺激技术的发展为克服这些障碍并改善假体装置和患者的生活质量提供了希望。
人工耳蜗
[edit | edit source]在各种动物模型(如啮齿动物和猫)中,已经测试了耳蜗和听觉神经的红外线刺激。光学变体在激光刺激的区域方面显示出显着的精度,该区域的大小与中等响度音调激活的区域大小大致相同。研究还表明,使用低能量红外辐射,可以实现持续刺激,而不会造成组织的逐渐升温或损伤。这使得植入物可以在一天内使用,而不会损坏耳蜗系统。红外刺激的主要缺点是与电刺激相比,能量消耗要高得多。[2]
为了克服上述能量问题,研究人员开始在啮齿动物中测试光遗传学方法。他们对小鼠进行了基因改造,使之在脊髓神经节神经元中表达通道视紫红质。神经细胞的敏感性降低了诱发放电所需的能量,与红外辐射相比降低了七倍(红外:15 μJ,光遗传学:2 μJ,电刺激:0.2 μJ)。因此,可以使用 μLED 而不是激光进行刺激。尽管取得了这些进展,但在不久的将来将该技术应用于人类仍存在疑问。这主要是因为将遗传物质引入生物体中可能存在病毒感染的风险。到目前为止,只有极少数基因疗法获得批准。必须实施并批准一种安全且有效的方式来特异性感染耳蜗器官。[17]
已经注册了描述针对人类的潜在光学耳蜗植入物的首批专利。这些植入物的功能类似于传统的电学植入物。但是,它们使用的是垂直腔面发射激光器 (VCSEL),而不是电极,这些激光器由植入物的输入设备驱动。VCSEL 是可以安装在植入物小型管中的激光发射二极管。激光器指向 Corti 器官,并且可以比电极更紧密地间隔,从而使植入物输出通道的数量增加了一倍以上。激光二极管用于更高音调的信号传递,而电极驱动较低振幅的神经细胞。[18]
前庭假体
[edit | edit source]前庭假体旨在恢复因前庭系统功能障碍而引起的不平衡问题。由于半规管相互连接,电流扩散是电刺激传递中的一个主要问题。电流扩散会导致对不需要的半规管的额外刺激,从而导致发送到大脑的平衡信号错误。已经研究了使用红外辐射的可能性。对壶腹的照射没有诱发动作电位。刺激失败的原因可能在于毛细胞对红外辐射不敏感。然而,前庭神经的光学刺激可能是可行的。目前尚不清楚以这种方式是否可以单独刺激来自不同壶腹的神经。[2][19]
参考文献
[edit | edit source]- ↑ a b Szobota, Stephanie; Isacoff, Ehud Y (2010). "Optical control of neuronal activity". Annual review of biophysics. 39: 329–348.
{{cite journal}}: Cite has empty unknown parameter:|1=(help) - ↑ a b c d Richter, Claus-Peter; Matic, Agnella Izzo; Wells, Jonathon D; Jansen, E Duco; Walsh, Joseph T (2011). "Neural stimulation with optical radiation". Laser & photonics reviews. 5 (1): 68–80.
- ↑ a b Wells, Jonathon D; Cayce, Jonathan M; Mahadevan-jansen, Anita; Konrad, Peter E; Jansen, E Duco (2011). "Infrared Nerve Stimulation: A Novel Therapeutic Laser Modality". Optical-Thermal Response of Laser-Irradiated Tissue (2 ed.). Dordrecht: Springer Netherlands. pp. 915–939.
- ↑ a b Berthold, Peter; Tsunoda, Satoshi P; Ernst, Oliver P; Mages, Wolfgang; Gradmann, Dietrich; Hegemann, Peter (2008). "Channelrhodopsin-1 initiates phototaxis and photophobic responses in chlamydomonas by immediate light-induced depolarization". The Plant cell. 20 (6): 1665–1677.
- ↑ a b Nagel, Georg; Szellas, Tanjef; Huhn, Wolfram; Kateriya, Suneel; Adeishvili, Nona; Berthold, Peter; Ollig, Doris; Hegemann, Peter; Bamberg, Ernst (2003). "Channelrhodopsin-2, a directly light-gated cation-selective membrane channel". Proceedings of the National Academy of Sciences. 100 (24): 13940–13945.
- ↑ Bamann, Christian; Kirsch, Taryn; Nagel, Georg; Bamberg, Ernst (2008). "Spectral characteristics of the photocycle of channelrhodopsin-2 and its implication for channel function". Journal of Molecular Biology. 375 (3): 686–694.
- ↑ Ernst, Oliver P; Sánchez Murcia, Pedro a; Daldrop, Peter; Tsunoda, Satoshi P; Kateriya, Suneel; Hegemann, Peter (2008). "通道视紫红质的光活化". 生物化学杂志. 283 (3): 1637–1643.
- ↑ Gunaydin, Lisa; Yizhar, Ofer; Berndt, André; Sohal, Vikaas S; Deisseroth, Karl; Hegemann, Peter (2010). "超快光遗传学控制". 自然神经科学. 13 (3): 387–392.
- ↑ Lin, John Y; Lin, Michael Z; Steinbach, Paul; Tsien, Roger Y (2009). "具有改进性能和动力学的工程化通道视紫红质变体的表征". 生物物理学杂志. 96 (5): 1803–1814.
- ↑ Duschl, A; Lanyi, JK; Zimanyi, L (1990). "来自嗜盐碱菌,法拉奥嗜盐菌的卤视紫红质的性质和光化学". 生物化学杂志. 265: 1261–1267.
- ↑ a b Zhang, Feng; Wang, Li-Ping; Brauner, Martin; Liewald, Jana F; Kay, Kenneth; Watzke, Natalie; Wood, Phillip G; Bamberg, Ernst; Nagel, Georg; Gottschalk, Alexander; Deisseroth, Karl (2007). "神经回路的多模式快速光学询问". 自然. 446 (7136): 633–639.
- ↑ Han, Xue; Boyden, Edward S (2007). "神经活动的多色光学激活、沉默和去同步,具有单脉冲时间分辨率". Plos one. 2 (3): e299.
- ↑ a b Kim, Jong-myoung; Hwa, John; Garriga, Pere; Reeves, Philip J; Rajbhandary, Uttam L; Khorana, H Gobind (2005). "包含β2肾上腺素受体胞质环的嵌合视紫红质的光驱动激活β2肾上腺素受体信号传导". 生物化学. 44 (7): 2284–2292.
- ↑ Airan, Raag D; Thompson, Kimberly R; Fenno, Lief E; Bernstein, Hannah; Deisseroth, Karl (2009). "细胞内信号传导的时间精确体内控制". 自然. 458 (7241): 1025–1029.
- ↑ Oh, Eugene; Maejima, Takashi; Liu, Chen; Deneris, Evan; Herlitze, Stefan (2010). "通过光激活的G蛋白偶联受体替代5-HT1A受体信号传导". 生物化学杂志. 285 (40): 30825–30836.
- ↑ McGill, K C; Cummins, K L; Dorfman, L J; Berlizot, B B; Leutkemeyer, K; Nishimura, D G; Widrow, B (1982). "关于使用表面电极诱发和记录的神经信号中刺激伪影的性质和消除". IEEE 生物医学工程学报. 29 (2): 129–137.
- ↑ Hernandez, VH; Gehrt, Anna; Reuter, Kirsten; Jing, Zhizi; Jeschke, Marcus; Schulz, Alejandro Mendoza; Hoch, Gerhard; Bartels, Matthias; Vogt, Gerhard; Garnham, Carolyn W.; Yawo, Hiromu; Fukazawa, Yugo; Augustine, George J.; Bamberg, Ernst; Kügler, Sebastian; Salditt, Tim; Hoz, Livia de; Strenzke, Nicola; Moser, Tobias (2014). "听觉通路的 optogenetic 刺激". 临床研究杂志. 124 (3): 1114–1129.
- ↑ 具有顶端电极的光刺激人工耳蜗,用于耳蜗顶端螺旋神经节细胞的电刺激, 2013年1月24日
{{citation}}: Check date values in:|publication-date=(help); Unknown parameter|country-code=ignored (help); Unknown parameter|inventor-first=ignored (help); Unknown parameter|inventor-last=ignored (help); Unknown parameter|inventor2-first=ignored (help); Unknown parameter|inventor2-last=ignored (help); Unknown parameter|issue-date=ignored (help); Unknown parameter|patent-number=ignored (help) - ↑ Harris, DM; Bierer, SM (2009). "用于前庭假体的光学神经刺激". SPIE 会议论文集. 5: 71800R.


