感觉系统/非灵长类动物
| 一位华夏公益教科书用户认为此页面应该拆分为更小的页面,具有更窄的子主题。 您可以通过将此大页面拆分为更小的页面来提供帮助。请确保遵循命名策略。将书籍划分为更小的部分可以提供更多重点,并允许每个部分专注于一项任务,这对每个人都有益。 |
灵长类动物是属于哺乳动物纲的动物。灵长类动物包括人类和非人灵长类动物,即猿类、猴类、狐猴类、树鼩、懒猴、眼镜猴和跗猴。它们的特征是前脑体积大且结构复杂。大多数灵长类动物的视力极佳,并且高度适应树栖生活,包括某些物种拥有抓握的尾巴。另一方面,非灵长类动物通常拥有更小的脑。但随着我们对动物界的其他成员了解越来越多,越来越明显的是,非灵长类动物也非常聪明。一些例子包括猪、章鱼和乌鸦。[1]
在许多神话分支中,乌鸦扮演着狡猾的骗子角色,而在现实世界中,乌鸦被证明是一个非常聪明的物种。人们发现乌鸦会进行诸如使用工具、季节性储存食物、类似情景记忆以及根据个人经验预测未来情况等行为。
事实证明,成为一只猪其实是一种非常聪明的策略。猪可能是地球上最聪明的家养动物。尽管它们的原始智力可能与狗或猫相当,但它们的解决问题的能力超过了猫科动物和犬类朋友。
如果猪是最聪明的家养物种,那么章鱼则在无脊椎动物中名列前茅。迷宫和解题实验表明,章鱼既有短期记忆,也有长期记忆。章鱼可以打开罐子,挤过狭窄的缝隙,从一个笼子跳到另一个笼子寻找零食。它们也可以接受训练来区分不同的形状和图案。在一种类似游戏的活动中(这是一种高级智力物种的标志),人们观察到章鱼会反复将瓶子或玩具释放到水族馆的环形水流中,然后捕捉它们。
在过去的四十年里,鸣禽已成为神经科学家研究复杂顺序行为和感觉引导运动学习的广泛使用模型生物。像人类婴儿一样,年轻的鸣禽通过模仿成年鸟学习它们用来进行交流的许多声音。斑胸草雀(Taeniopygia guttata)是一种鸣禽,因为它容易在人工环境中鸣叫和繁殖,并且成熟速度快,因此成为许多研究的焦点。成年雄性斑胸草雀的鸣声是一系列定型的声学信号,其结构和调制跨越了从毫秒到几秒的广泛时间尺度。成年斑胸草雀的鸣声由重复的声序列组成,称为主题,持续约一秒钟。主题由更短的声音爆发组成,称为音节,音节通常包含更简单声学元素的序列,称为音符,如图 1 所示。鸣禽的学习系统是一个非常好的模型,可以研究感觉运动整合,因为幼鸟积极地倾听导师并通过校正音调和偏移的错误来调节自己的鸣声。鸣禽大脑的神经机制和结构在学习中起着至关重要的作用,与人类前额叶皮层中的语言处理区域相似。详细研究参与学习过程的分层神经网络可以为深入了解人类言语学习的神经机制提供重要见解。

鸣禽的歌曲学习过程分为几个阶段,从感觉阶段开始,幼鸟只是听其导师(通常是其父亲)发声,通常自己不发出任何类似歌曲的叫声。幼鸟利用这个阶段记忆导师歌曲的特定结构,形成歌曲的神经模板。然后它进入感觉运动阶段,开始模仿歌曲并利用听觉反馈纠正错误。早期模仿导师歌曲的模板非常嘈杂、无结构且多变,称为“雏歌”。图 1 中的声谱图显示了一个例子。在接下来的几天里,鸟儿进入“可塑阶段”,此时负责生成高度结构化音节的神经网络具有很大的可塑性,歌曲的变异性也降低。到它们性成熟时,变异性基本上消失了——这个过程称为“结晶”——幼鸟开始发出正常的成年歌曲,这可能是导师歌曲的惊人模仿(图 1)。因此,从早期的雏歌到成年歌曲,歌曲变异性的逐渐降低,以及模仿质量的逐渐提高,是鸣禽发声学习的一个重要方面。在接下来的部分中,我们将探讨鸣禽大脑的几个部分以及负责这些鸟类中观察到的这种非凡的发声模仿的潜在神经机制。
详细了解鸣禽的神经解剖结构非常重要,因为它提供了关于各种运动和感觉整合通路中学习机制的重要信息。这最终可以阐明人类的语言处理和发声学习。目前尚不清楚人类语音处理系统的精确神经解剖学数据,鸣禽的解剖结构和生理学将使我们能够提出合理的假设。本章最后一部分(图 6)对哺乳动物大脑和鸣禽(鸟类)大脑进行了比较。在鸟类大脑中观察到的通路可以大致分为运动控制通路和前脑通路,如图 2 所示。听觉通路提供误差反馈信号,导致参与运动通路的突触连接的增强或抑制,这对发声学习起着重要作用。运动控制通路包括腹侧纹状体,尾部(HVC),顶盖核(RA),舌下神经核的喉气管亚群(nXIIts)和鸣管。该通路对于产生产生高度结构化歌曲所需的运动控制信号以及协调呼吸和唱歌至关重要。前脑通路包括前脑背侧丘脑外侧巨细胞核(LMAN),X 区(X)以及背外侧丘脑内侧核(DLM)。该通路在幼鸟的歌曲学习、成鸟的歌曲变异性和歌曲表征中起着至关重要的作用。听觉通路包括黑质(SNc)和腹侧被盖区(VTA),它们在听觉输入处理和分析反馈误差中起着至关重要的作用。鸣管的肌肉由来自 nXIIts 的运动神经元的一个子集支配。一个主要投射到 nXIIts 的来自前脑核 RA 中的神经元。RA 核接受来自另一个皮质类似物,HVC 核的运动相关投射,而 HVC 核又直接接受来自几个脑区(包括丘脑 uva 核(Uva))的输入。

HVC 核和 RA 核以层次化的方式参与歌曲的运动控制(Yu 和 Margoliash 1996)。对鸣唱的斑胸草雀的记录表明,投射到 RA 的 HVC 神经元传递一种极其稀疏的突发模式:每个投射到 RA 的 HVC 神经元在歌曲中的某个特定时间生成一个持续时间约为 6 毫秒的单个高度定型突发(Hahnloser、Kozhevnikov 等,2002)。在鸣唱过程中,RA 神经元产生一系列复杂的、高频的尖峰突发,其模式每次鸟儿鸣唱其歌曲主题时都会精确地复制(Yu 和 Margoliash 1996)。在主题期间,每个 RA 神经元产生一个相当独特的模式,大约有 12 个突发,每个突发持续约 10 毫秒(Leonardo 和 Fee 2005)。基于投射到 RA 的 HVC 神经元在歌曲主题期间产生单个尖峰突发以及不同神经元似乎在主题中的许多不同时间突发这一观察结果,人们假设这些神经元随着时间推移产生连续的活动序列(Fee、Kozhevnikov 等,2004,Kozhevnikov 和 Fee 2007)。换句话说,在歌曲的每个时刻,都有一小组 HVC(RA)神经元在那个时间(仅在那个时间)处于活跃状态(图 3),并且每个小组会短暂地激活(约 10 毫秒)由 HVC 神经元在 RA 中的突触连接决定的 RA 神经元的一个子集(Leonardo 和 Fee 2005)。此外,在这个模型中,肌肉活动的向量(因此是声带器官的配置)由 RA 神经元在约 10 到 20 毫秒的短时间尺度上对运动神经元的收敛输入决定。RA 神经元可能仅仅以某种有效权重短暂地影响声带肌肉活动的观点与灵长类动物皮层控制手臂运动的一些模型一致(Todorov 2000)。许多研究表明,歌曲的时间是由穿过 HVC 神经元的一种稀疏传播的活动波或链在毫秒级控制的。这一假设得到了对自然鸣唱过程中的时间变异性的分析(Glaze 和 Troyer 2007)以及对操纵 HVC 中电路动力学以观察对歌曲时间的影响的实验的支持。因此,在这个模型中,歌曲的时间由活动在 HVC 中的链中的传播控制;这种 HVC 链的通用顺序激活通过 HVC 在 RA 中的连接转化为特定精确的声带配置序列。

人们已经发现了许多与歌曲相关的鸣禽脑区(图 4A)。歌曲产生区域包括 HVC(腹侧纹状体,尾部)和 RA(弓状体核),它们产生一系列神经活动模式,并通过运动神经元控制鸣唱过程中发声器官的肌肉(Yu 和 Margoliash 1996,Hahnloser、Kozhevnikov 等,2002,Suthers 和 Margoliash 2002)。HVC 或 RA 的损伤会导致歌曲的立即丧失(Vicario 和 Nottebohm 1988)。前脑通路(AFP)中的其他区域似乎对歌曲学习很重要,但至少对成鸟来说并不重要。AFP 被认为是哺乳动物基底神经节丘脑皮层环路的鸟类同源物(Farries 2004)。特别是,LMAN 区(前脑背侧巨细胞核)的损伤对成鸟的歌曲产生没有立即影响,但会阻止幼鸟的歌曲学习(Doupe 1993,Brainard 和 Doupe 2000)。这些事实表明,LMAN 在驱动歌曲学习中起着作用,但可塑性的部位是在与歌曲产生相关的脑区,例如 HVC 和 RA。Doya 和 Senjowski 在 1998 年提出了一个三方模式,其中学习基于行为者和批评者之间的相互作用(图 4B)。批评者评估行为者在所需任务中的表现。行为者使用这种评估进行改变,从而改进其表现。为了通过反复试验进行学习,行为者每次以不同的方式执行任务。它会产生好的和坏的变体,而批评者的评估用于加强好的变体。通常假设行为者会自己产生变体。但是,变体的来源来自行为者外部。我们称此来源为实验者。行为者被认为是 HVC、RA 和控制发声的运动神经元。行为者通过 HVC 到 RA 的突触的可塑性进行学习(图 4C)。根据在歌曲学习过程中发生的 HVC 到 RA 投射中的轴突生长和退缩等结构变化的证据,这种观点被广泛认为是一种合理的机制。对于实验者和批评者,Doya 和 Senjowski 认为是前脑通路,假设批评者是 X 区,而实验者是 LMAN。

|
生物物理学上可行的模型
正参数 ,称为学习率,控制突触变化的整体幅度。资格迹 是一个存在于每个塑性突触的假设量。它表示突触是否“有资格”被强化修改,并且基于塑性突触的最近激活和经验突触到同一 RA 神经元的激活 这里 是经验性(LMAN->RA)突触到RA神经元的电导率。时间滤波器 *G(t)* 假设为非负数,其形状决定了资格痕迹可以“记住”过去的时长。经验性突触的瞬时激活取决于平均活动 。学习原则遵循 (图5) 中显示的两个基本规则。第一条规则:如果可塑性 (HVC->RA) 突触和经验性 (LMAN->RA) 突触到同一个 RA 神经元的同步激活之后是正强化,那么可塑性突触就会增强。第二条规则:如果可塑性突触激活而没有经验性突触到同一个 RA 神经元的激活,之后是正强化,那么可塑性突触就会减弱。这些基于执行器神经元的动态电导率扰动的规则对强化信号的期望值进行随机梯度上升。这意味着由评价者评估的鸣叫表演平均而言肯定会得到改善。
|
哺乳动物和鸣禽大脑结构的比较
[edit | edit source]鸟类 X 区与哺乳动物基底神经节 (BG) 同源,包括纹状体和苍白球细胞类型。BG 形成一个高度保守的解剖学回路,经过多个站,从皮层到 BG(纹状体和苍白球),然后到丘脑,再回到皮层。在鸣禽中也观察到类似的回路:皮质类似物核 LMAN 投影到 X 区,其纹状体成分投影到丘脑核 DLM,然后投射回 LMAN。纹状体成分解释了基于奖励的学习和强化学习。如 (图6) 所示,鸟类 X 区的神经元类型及其功能与人类基底神经节完全相当。这种紧密的解剖学相似性促使我们更详细地了解鸣禽大脑,因为有了它,我们终于可以对人类语言学习有了一些重要的理解,并能更精确地治疗许多与语言相关的疾病。

参考文献
[edit | edit source]Brainard, M. S. 和 A. J. Doupe (2000)。“听觉反馈在学习和维持发声行为中的作用”。Nat Rev Neurosci 1(1): 31-40。
Dembo, A. 和 T. Kailath (1990)。“无模型分布式学习”。IEEE Trans Neural Netw 1(1): 58-70。
Doupe, A. J. (1993)。“专门用于声音学习的神经回路”。Curr Opin Neurobiol 3(1): 104-111。
Farries, M. A. (2004)。“从比较角度看鸟类鸣叫系统”。Ann N Y Acad Sci 1016: 61-76。
Fee, M. S.、A. A. Kozhevnikov 和 R. H. Hahnloser (2004)。“鸣禽发声序列产生的神经机制”。Ann N Y Acad Sci 1016: 153-170. Glaze, C. M. 和 T. W. Troyer (2007)。“鸣叫鸟类时间精确运动代码的行为测量”。J Neurosci 27(29): 7631-7639。
Hahnloser, R. H.、A. A. Kozhevnikov 和 M. S. Fee (2002)。“超稀疏代码是鸣禽神经序列产生的基础”。Nature 419(6902): 65-70。
Kozhevnikov, A. A. 和 M. S. Fee (2007)。“斑胸草雀已识别 HVC 神经元中与鸣叫相关的活动”。J Neurophysiol 97(6): 4271-4283。
Leonardo, A. 和 M. S. Fee (2005)。“鸣禽发声控制的整体编码”。J Neurosci 25(3): 652-661。
Seung, H. S. (2003)。“通过增强随机突触传递进行尖峰神经网络学习”。Neuron 40(6): 1063-1073。
Suthers, R. A. 和 D. Margoliash (2002)。“鸣叫鸟类鸣叫的运动控制”。Curr Opin Neurobiol 12(6): 684-690。
Todorov, E. (2000)。“随意手臂运动中肌肉激活的直接皮质控制:模型”。Nat Neurosci 3(4): 391-398。
Vicario, D. S. 和 F. Nottebohm (1988)。“斑胸草雀鸣叫控制系统的组织:I. 舌下神经核中鸣管肌肉的表示”。J Comp Neurol 271(3): 346-354。
Yu, A. C. 和 D. Margoliash (1996)。“鸟类鸣叫的时间层次控制”。Science 273(5283): 1871-1875。
章鱼
[edit | edit source]介绍
[edit | edit source]最有趣的非灵长类动物之一是章鱼。关于这种非灵长类动物最有趣的特点是它的手臂运动。在这些无脊椎动物中,手臂的控制特别复杂,因为手臂可以向任何方向移动,具有几乎无限的自由度。在章鱼中,大脑只需要向手臂发出一个指令来执行动作——如何执行的完整方案本身就嵌入在手臂中。观察表明,章鱼通过将手臂运动保持在设定的、刻板的模式中,降低了控制手臂的复杂性。为了找出章鱼手臂是否拥有自己的意识,研究人员切断了章鱼手臂中的神经与身体中其他神经的连接,包括大脑。然后,他们触碰并刺激手臂上的皮肤。手臂的行为与健康章鱼的行为完全相同。这意味着大脑只需要向手臂发出一个单一的移动指令,手臂就会完成剩下的动作。
本章详细讨论了章鱼的感觉系统,并重点关注这种非灵长类动物的感觉运动系统。
章鱼 - 聪明的非灵长类动物
[edit | edit source]
章鱼有两眼和四对手臂,它们是双侧对称的。章鱼有一个坚硬的喙,其嘴巴位于手臂中心的交汇点。章鱼没有内骨骼或外骨骼(尽管某些物种在斗篷内有退化的壳遗迹),这使它们能够挤过狭窄的地方。章鱼是所有无脊椎动物中最聪明、行为最灵活的动物之一。
章鱼最有趣的特征是它们的手臂运动。为了进行有目标的手臂运动,章鱼的神经系统会生成一系列运动指令,使手臂朝向目标移动。手臂的控制特别复杂,因为手臂可以向任何方向移动,具有几乎无限的自由度。随意运动的基本运动程序嵌入在手臂本身的神经回路中。[2]
章鱼手臂运动
[edit | edit source]在章鱼的层次结构中,大脑只需要向手臂发出一个指令来执行动作。如何执行的完整方案本身就嵌入在手臂中。通过使用手臂,章鱼可以行走,抓住猎物,或者拒绝不需要的物体,还可以从其周围环境中获取各种机械和化学信息。
章鱼手臂与人类手臂不同,它们的运动范围不受肘部、腕部和肩部关节的限制。然而,为了完成诸如伸手抓食物或游泳等目标,章鱼必须能够控制其八条附肢。章鱼手臂可以利用几乎无限的自由度向任何方向移动。这种能力源于章鱼手臂上密集排列的灵活肌肉纤维。
观察表明,章鱼通过将手臂运动保持在设定的、刻板的模式中,降低了控制手臂的复杂性。[3] 例如,伸展动作总是由沿着手臂向尖端传播的弯曲组成。由于章鱼总是使用相同类型的运动来伸展其手臂,因此生成该模式的指令存储在手臂本身中,而不是存储在中枢大脑中。这种机制进一步降低了控制灵活手臂的复杂性。这些灵活的手臂由一个复杂的周围神经系统控制,该神经系统包含 5 × 107 个神经元,分布在每条手臂上。其中有 4 × 105 个是运动神经元,它们支配手臂的内在肌肉并局部控制肌肉活动。
每当需要时,章鱼的神经系统会生成一系列运动指令,这些指令反过来会产生力和相应的速度,使肢体到达目标。通过使用向量叠加和基本运动的叠加所形成的最优轨迹,可以简化运动。这要求肌肉相当灵活。
手臂的神经系统
[edit | edit source]章鱼的八条手臂是细长、逐渐变细的肌肉器官,从头部伸出并规则地排列在嘴巴周围。每条手臂的内表面都有两排吸盘,每个吸盘都与对侧排的吸盘交替排列。每条手臂上大约有 300 个吸盘。[4]
手臂同时执行运动和感觉功能。章鱼手臂的神经系统由神经节代表,负责运动和相互连接功能。周围神经细胞代表感觉系统。神经节和周围神经细胞之间存在密切的功能关系。
手臂的肌肉可以分为三个独立的组,每个组在解剖和功能上都有一定的独立性。
- 手臂的内在肌肉,
- 吸盘的内在肌肉,以及
- 髋臼臂肌肉(连接吸盘到手臂肌肉)。
这三个肌肉群中的每一个都包含三个互相垂直的肌肉束。每个束都从周围的单位独立接收神经支配,并表现出显著的自主性。尽管没有骨骼或软骨骨架,章鱼可以利用不同肌肉的收缩和放松来产生手臂运动。从行为上看,纵向肌肉缩短手臂,在抓住物体并将其送入口中方面起主要作用,而斜向和横向肌肉则伸长手臂,章鱼用它来拒绝不需要的物体。

手臂中有六个主要的神经中枢,负责执行这些肌肉群的功能。轴向神经索是手臂中最重要、最主要的运动和整合中枢。八条神经索,每条手臂一条,总共包含3.5 × 108 个神经元。每条轴向神经索通过连接神经束与五个更周围的神经中枢相连,即四条肌内神经索(位于手臂的内在肌肉中)和吸盘的节(位于每个吸盘的髋臼杯下的柄中)。
所有这些小的周围神经都包含运动神经元,并接收来自深部肌肉受体的传入纤维,这些受体充当局部反射中枢。因此,手臂肌肉的运动神经支配不仅由轴向神经索的运动神经元提供(这些运动神经元接收来自大脑的节前纤维),还由这些更周围的运动中枢提供。
手臂包含一个复杂而广泛的感觉系统。手臂三个主要肌肉系统中的深部受体为动物提供了一个广泛的感觉器官,用于从肌肉收集信息。许多初级受体位于覆盖手臂表面的上皮组织中。吸盘,尤其是吸盘边缘,拥有最多的这些感觉细胞,而手臂的皮肤则比较不敏感。每个吸盘中有数万个受体。
在章鱼的手臂中发现了三种主要类型的受体。分别是圆形细胞、不规则的多极细胞和锥形纤毛细胞。所有这些元素都将它们的突触向心性地送往神经节。这三种受体的功能意义目前还不十分清楚,只能推测。有人认为,圆形和多极受体可能记录机械刺激,而纤毛受体可能是化学受体。
纤毛受体不会直接将它们的轴突送往神经节,而是将轴突与位于上皮组织下方的包囊神经元相遇,并与这些神经元的树突突触连接。这种连接有助于减少初级神经细胞之间的输入。另一方面,圆形和多极受体直接将它们的轴突送往包含运动神经元的神经节。
行为实验表明,关于肌肉运动的信息不会到达大脑的学习中枢,而形态学观察证明,深部受体将它们的轴突送往周围中枢,例如吸盘神经节或肌内神经索。[5] 关于肌肉拉伸或运动的信息只用于局部反射。
当包含来自大脑的轴突束的轴向神经索背侧被电信号刺激时,仍然会注意到整条手臂的运动。运动是由提供的刺激触发的,而不是直接由来自大脑的刺激驱动。因此,手臂伸展是由轴向神经索背侧的刺激引起的。相反,刺激同一区域内的肌肉或神经索的节段部分,只会引起局部肌肉收缩。这意味着大脑只需要向手臂发送一个单一的移动命令,手臂就会完成剩下的工作。
一个背侧方向的弯曲沿着手臂传播,导致吸盘指向运动方向。当弯曲传播时,弯曲近端的臂部分保持伸展。为了进一步确认章鱼手臂有它自己的想法,章鱼手臂中的神经被切断,与身体的其他神经(包括大脑)隔绝。通过对神经索进行电刺激或对皮肤或吸盘进行触觉刺激,在被截肢的手臂中引发了类似于正常手臂伸展的运动。
已经注意到,在刺激之前手动创建弯曲时,弯曲传播更容易启动。如果完全放松的手臂受到刺激,初始运动将由刺激触发,随后是相同的弯曲传播。因此,手臂的神经系统不仅驱动局部反射,还控制涉及整条手臂的复杂运动。
这些诱发的运动在运动学上几乎与自由活动章鱼的运动相同。当受到刺激时,被切断的手臂表现出与自然手臂伸展相同的肌肉活动主动传播。从相似的初始手臂姿势引发的运动会导致相似的路径,而不同的起始姿势会导致不同的最终路径。
由于在去神经章鱼手臂中诱发的伸展在质量上和运动学上与自然手臂伸展相似,因此似乎有一个潜在的运动程序控制着嵌入在手臂神经肌肉系统中的运动,这不需要中枢控制。
鱼是水生动物,种类繁多。鱼类超过 32000 种,是脊椎动物中最大的类群。

大多数鱼类都拥有高度发达的感觉器官。大多数白天活动的鱼类都具有颜色视觉能力。有些鱼甚至可以看到紫外线。鱼类也有很强的嗅觉。例如,鳟鱼的头上有特殊的洞,叫做“鼻孔”,用来感知水中微量的化学物质。从海洋迁徙的鲑鱼利用这种感觉找到返回家乡河流的路,因为它们记得自己闻起来的味道。尤其是底栖鱼类,嘴唇和触须的触觉非常灵敏。它们的味蕾也位于那里。它们利用这些感觉在地面和浑浊的水域中寻找食物。
鱼类还拥有侧线系统,也称为侧线系统。它是一种位于头部和身体两侧的触觉感觉器官系统。它用于检测周围水中的运动和振动。
鱼类利用侧线感觉器官感知猎物和捕食者,感知水流的变化及其方向,并利用它来避免在群体中发生碰撞。
Coombs 等人已经证明 [1],侧线感觉器官对于鱼类检测猎物并朝向猎物定向是必要的。即使鱼类被蒙蔽,它们也能检测并朝向猎物或振动金属球体产生的运动定向。当侧线的信号转导被氯化钴的应用抑制时,靶向猎物的能力会大大降低。
Pitcher 等人在 1976 年证明了鱼类依赖侧线器官来避免在群体鱼类中发生碰撞,他们表明,即使被蒙蔽的鱼类也能在鱼群中游泳,而那些侧线器官失灵的鱼类则不能 [2]。
侧线看起来像是两条微弱的线,从鱼的头部到尾部沿着鱼的身体两侧延伸。它们由一系列称为神经毛的机械感受器细胞组成。这些神经毛要么位于皮肤表面,要么更常见地嵌入侧线管内。侧线管是一种充满粘液的结构,位于皮肤下方,通过外部通往内部神经毛的开口来传导外部水位移。神经毛本身由具有精细毛细胞的感觉细胞组成,这些感觉细胞被一个圆柱形的凝胶状钟罩包裹着。这些毛细胞要么直接到达开阔的水域(常见于深海鱼类),要么到达侧线管的淋巴液中。变化的水压会弯曲钟罩,进而弯曲内部的毛细胞。与所有脊椎动物耳朵中的毛细胞类似,向较短的纤毛方向的偏转会导致超极化(放电速率下降),而相反方向的偏转会导致去极化(放电速率上升)的感觉细胞。因此,压力信息通过速率编码转换为数字信息,然后沿着侧线神经传递到大脑。通过通过传入和传出连接整合多个神经毛,可以形成复杂的回路。这使得它们能够响应不同的刺激频率,从而编码不同的参数,例如加速度或速度 [3]。

鲨鱼和鳐鱼身上的一些神经丘经历了有趣的进化,演变成称为罗伦兹壶腹的电感受器。它们主要集中在鱼的头部周围,可以检测到小至 0.01 微伏的电刺激变化 [4]。借助这种灵敏的器官,这些鱼能够检测到肌肉收缩产生的微弱电势,从而在远距离、浑浊的水域甚至隐藏在沙子下的情况下找到猎物。有人认为鲨鱼也利用这种感觉进行迁徙和定向,因为罗伦兹壶腹足够灵敏,可以检测到地球的磁场。
头足类动物
鱿鱼、章鱼和乌贼等头足类动物在头部和触手上都有排列成行的纤毛表皮细胞,类似于鱼类的侧线。对普通乌贼(Sepia officinalis)和短尾鱿鱼(Lolliguncula brevis)这些排成行的细胞进行的电生理记录表明,它们是鱼类和水生两栖动物机械感受性侧线的无脊椎动物类似物 [5]。
甲壳类动物
一些甲壳类动物也出现了与鱼类侧线相似的趋同进化。与鱼类不同,它们体内没有机械感觉细胞,而是将这些细胞以规则的间隔排列在长长的拖曳触角上。这些触角与身体平行。这形成了两条与身体平行的“侧线”,它们具有与鱼类侧线相似的特性,并且在机械上独立于身体 [6]。
哺乳动物
在水生海牛中,颅后身体长有触觉毛发。它们类似于裸鼹鼠的机械感觉毛发。这种毛发的排列方式与鱼类的侧线相似,弥补了海牛糟糕的视觉能力。同样,港海豹的胡须可以探测微小的水流运动,充当流体动力学感受器系统。该系统远不如鱼类同类系统灵敏。[7]

平衡棒是许多飞行昆虫身上存在的感官器官。人们普遍认为它是这些昆虫后一对翅膀的进化改造,平衡棒提供陀螺仪感官数据,这对飞行至关重要。尽管苍蝇还有其他相关的系统可以帮助飞行,但苍蝇的视觉系统太慢,无法进行快速机动。此外,为了能够在弱光条件下熟练地飞行,这是一个避免捕食的必要条件,因此需要这样的感官系统。事实上,如果没有平衡棒,苍蝇就无法持续、受控地飞行。自 18 世纪以来,科学家们就意识到平衡棒在飞行中所起的作用,但直到最近,人们才更好地了解了它们的工作机制。 [6] [7]
平衡棒是由两对翅膀中最后的一对进化而来的。虽然第一对仍然用于飞行,但后一对失去了飞行功能,并采用了略微不同的形状。平衡棒从视觉上看由三个结构部分组成:一个球形末端、一个细长的柄和一个略宽的基部。球形末端包含大约 13 根神经支配的毛发,而基部包含两个弦音器,每个弦音器都由大约 20-30 根神经支配。弦音器是一种感觉器官,被认为只对伸展有反应,但它们仍然相对未知。基部也覆盖着大约 340 个钟形感觉器,它们是微小的纤维,优先对沿其拉伸方向的压缩做出反应。这些纤维中的每一根也都被神经支配。相对于平衡棒的柄,弦音器和钟形感觉器的方向都大约为 45 度,这对于测量作用在平衡棒上的弯曲力是最佳的。平衡棒在飞行时与翅膀反向(反相)运动。感官成分可以分为三组 [8]):对平衡棒垂直振动敏感的那些,包括背侧和腹侧柄板、背侧和腹侧希克斯乳突(板和乳突都是上述钟形感觉器的子类别),以及小的弦音器。基底板(钟形感觉器的另一种表现形式)和大的弦音器对作用在平衡棒上的陀螺力矩敏感,还有一些未分化的乳突对作用在平衡棒基部上的所有应变都有反应。这为苍蝇提供了一种额外的机制来区分作用在平衡棒上的力的方向。
当人们首次发现和探索同源异形盒基因时,发现删除或失活 Ultrabithorax (Ubx) 同源异形盒基因会导致平衡棒发育为一对正常的翅膀。这是一个非常引人注目的早期结果,说明了同源异形盒基因的本质。对 Antennapedia 基因的操纵同样会导致腿部严重畸形,或者会导致头部发育出一组腿而不是触角。
平衡棒通过检测科里奥利力来发挥作用,感知穿过可能旋转的苍蝇身体的空气运动。研究表明,身体的角速度是由平衡棒测量的科里奥利力编码的 [8]。活跃的平衡棒可以招募任何相邻的单元,影响附近的肌肉并导致飞行动力学的巨大变化。平衡棒已被证明具有极快的响应时间,这使得这些飞行变化的执行速度远远快于苍蝇依靠视觉系统。为了区分不同的旋转分量,例如俯仰和滚动,苍蝇必须能够组合来自两个平衡棒的信号,而这两个信号必须不能重合(重合的信号会削弱苍蝇区分旋转轴的能力)。平衡棒能够有助于图像稳定,以及飞行姿态控制,这是由许多作者指出的,他们注意到头部和翅膀对旋转速率矢量的各个分量的输入的反应。平衡棒对头部和颈部运动的贡献已被注意到,解释了它们在凝视稳定中的作用。因此,苍蝇利用来自平衡棒的输入来确定凝视的固定位置,这是一种有趣的感觉整合。
记录表明,平衡棒能够以与科里奥利力相同的频率(双翅拍频率)响应刺激,这是该概念的证明,它允许人们进一步对这些测量是如何发生的进行数学分析。平衡棒的角速度和身体旋转的矢量叉积为苍蝇提供了科里奥利力矢量。这种力在俯仰和平面中与拍翅频率相同,而在偏航平面上是两倍的频率。平衡棒能够提供速率阻尼信号来影响旋转。这是因为科里奥利力与苍蝇自身的旋转速率成正比。通过测量科里奥利力,平衡棒可以向其关联的肌肉发送适当的信号,使苍蝇能够适当地控制其飞行。平衡棒的大幅度运动允许计算垂直和水平的旋转速率。由于平衡棒在垂直运动和水平运动之间的运动存在很大差异,Ω1,旋转速率的垂直分量,产生的力是水平分量频率的两倍。人们普遍认为,这种两倍的频率差异是苍蝇能够区分垂直和水平分量的原因。如果我们假设平衡棒是正弦运动的,这是一个对其实际世界行为的合理准确的近似,那么角位置 γ 可以建模为: 其中 ω 是平衡棒拍翅频率,幅度为 180,这是对实际运动范围的近似。已知速率(滚动、俯仰和偏航分量分别用 1、2 和 3 标记)可以计算出身体旋转速度,分别来自两个平衡棒(Ωb 为左平衡棒,Ωc 为右平衡棒)的参考系,分别对应于苍蝇的身体,使用以下计算 [7]
α 代表平衡棒从身体平面旋转的角度,Ω 项如前所述是平衡棒相对于身体的角速度。了解这一点,我们可以用平衡棒末端球体上的力方程来粗略模拟平衡棒的输入
m 是平衡棒球体的质量,g 是重力加速度,ri,vi} 和 ai 是球体相对于苍蝇身体在i 方向的位置、速度和加速度,aF 是苍蝇的线加速度,Ωi 和 Ώi 分别是苍蝇在空间中的i 方向的角速度和角加速度分量。科里奥利力由2mΩ × vi 项模拟。由于产生的感觉信号与作用在平衡棒上的力成正比,因此可以模拟平衡棒信号。如果尝试将力方程与旋转分量方程相协调,值得记住的是,必须分别计算两个平衡棒的力方程。
蝴蝶
[edit | edit source]
蝴蝶和蛾子用约翰斯顿器官来保持平衡:这是一个位于蝴蝶触角基部的器官,负责维持蝴蝶的平衡感和方向感,尤其是在飞行过程中。
约翰斯顿器官
[edit | edit source]介绍
[edit | edit source]对于某些昆虫来说,声音的感知对于交配行为很重要,例如果蝇[9]。昆虫和甲壳类动物的听觉能力是由弦音器官提供的:机械感受器,对机械变形做出反应[10]。这些弦音器官广泛分布在昆虫的整个身体中,并且功能不同:本体感受器对昆虫本身产生的力敏感,而外感受器对外力敏感。这些感受器可以通过声音在空气或水中等介质中传播时粒子振动来检测声音。远场声音是指空气粒子将振动作为来自声源的长时间压力变化传播的现象。近场声音是指靠近声源的声音,粒子速度可以移动轻质结构。一些昆虫有可见的听觉器官,比如夜蛾的耳朵,而另一些昆虫则没有可见的听觉器官,但仍然能够感知声音。在这些昆虫中,"约翰斯顿器官"在听觉中起着重要作用。
约翰斯顿器官
[edit | edit source]约翰斯顿器官 (JO) 是大多数昆虫都存在的弦音器官。克里斯托弗·约翰斯顿是第一个在蚊子中描述该器官的人,因此得名约翰斯顿器官[11]。显微镜科学季刊。1855 年,第 s1-3 卷,第 10 卷,第 97-102 页。该器官位于昆虫触角的茎部。它在双翅目 (双翅目) 中发展出最高的复杂程度,对双翅目来说,听觉尤为重要[10]。JO 由称为感觉体的有序基本感觉单元组成(SP)。感觉体的数量在不同的动物中有所不同。JO 具有各种机械感觉功能,例如检测触觉、重力、风和声音,例如蜜蜂的 JO(约 300 个 SP)负责检测来自另一个“跳舞”蜜蜂的声音[12]。在雄性蚊子 (约 7000 个 SP) 中,JO 用于检测和定位雌性飞行声音以进行交配行为[13]。这些昆虫的触角专门用于捕获近场声音。它充当物理机械换能器。
约翰斯顿器官的解剖结构
[edit | edit source]典型的昆虫触角有三个基本部分:柄节 (基部)、梗节 (茎) 和鞭节[14]。一些昆虫的第三部分有一个叫做刚毛的刚毛。图 1 显示了果蝇的触角。对于果蝇来说,触角节 a3 松散地插入节 a2 的窝中,当吸收声能时可以旋转[15]。这会导致感觉体的 JO 神经元伸展或压缩。在双翅目中,JO 感觉体位于第二个触角节 a2 梗节(Yack, 2004)。JO 不仅与声音感知 (外感受器) 相关联,它还可以充当本体感受器,提供有关鞭节相对于梗节的方向和位置的信息[16]。

感觉器是 JO 的基本感觉单位。一个感觉器包含四种细胞类型 [10]:(1)一个或多个双极性感觉神经元,每个神经元都具有远端的树突;(2)包绕树突的感觉器鞘细胞;(3)一个或多个与感觉器鞘细胞远端区域相关的附着细胞;(4)一个或多个围绕感觉神经元细胞体近端区域的神经胶质细胞。感觉器鞘细胞包围着感觉树突(纤毛),并与之一起形成感觉器腔/感受淋巴腔。感觉器腔是密封的。腔内充满淋巴液,据推测淋巴液含有高钾离子浓度和低钠离子浓度,与哺乳动物耳蜗的内淋巴液非常相似。感觉器可根据不同的标准进行分类。顶端细胞产生一个包裹着纤毛尖端并将其连接到第三节(a3)的胞外顶端结构 [17]。
第一型和第二型感觉器在感觉神经元中纤毛节段的类型上有所不同。在第一型中,纤毛的直径一致,除了在长度约为 2/3 处有一个远端膨大。纤毛插入顶端结构而不是插入管状结构。在第二型中,纤毛节段具有增加的直径,形成一个远端膨大,该膨大可以密集地填充微管。远端部分以管状结构结尾。单丝状和双丝状感觉器在与感觉器鞘细胞和树突纤毛相关的胞外结构上有所不同。单丝状感觉器具有插入电子致密结构顶端结构中的树突尖端。在双丝状感觉器中,尖端被电子致密的管状结构包裹。单动性感觉器和异动性感觉器在感觉神经元的数量上有所区别。单动性感觉器具有单个感觉细胞,而异动性感觉器则具有多个感觉细胞。
果蝇 (Drosophila melanogaster) 中研究的 JO
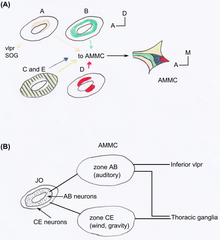
[edit | edit source]果蝇的 JO 由大约 277 个感觉器组成,这些感觉器位于 a2/a3 连接处和 a2 角质层(一种外部组织层)之间 [18]。果蝇的感觉器是单丝状的 [15]。大多数是异动性的,包含两个或三个神经元,因此 JO 包含大约 480 个神经元。它是果蝇最大的机械感觉器官 [9]。JO 对雄性果蝇求偶歌声(由其翅膀发出)的感知使雌性果蝇减少运动,而雄性果蝇则互相追逐形成求偶链 [19]。JO 不仅对感知声音很重要,而且对感知重力和风也很重要 [20] [21]。利用 JO 中的 GAL4 增强子陷阱品系表明,果蝇的 JO 神经元在解剖学上可以分为五个亚组,即 A-E [18]。每个亚组在大脑中的触角机械感觉和运动中心 (AMMC) 都有不同的靶区(见图 2)。Kamikouchi 等人表明,不同的亚组专门针对不同的触角运动类型 [9]。不同的亚组用于声音和重力的反应。
JO 中的神经活动
[edit | edit source]为了研究 JO 神经元的活动,可以观察触角运动引起的细胞内钙信号 [9]。此外,果蝇应该被固定(例如,通过将它们安装在盖玻片上并固定第二节触角以防止肌肉造成的运动)。触角可以用静电场进行机械驱动。当果蝇行走时,触角接收器在吸收声音能量时会振动,并在前后摆动。弯曲和振动触角会导致 JO 神经元产生不同的活动模式:以恒定力向后弯曲接收器会导致 JO 前部区域出现负信号,而在后部区域出现正信号。向前弯曲会产生相反的行为。求偶歌声(脉冲歌声,主频率约为 200Hz)会引起广泛分布的信号。向前和向后弯曲的相反模式反映了 JO 神经元的相反排列方式。它们的树突连接到柄节的解剖学上不同的侧面:接收器的前面和后面。向前弯曲接收器会拉伸前部区域的 JO 神经元,并压缩后部区域的神经元。由此可以得出结论,JO 神经元被拉伸激活(即去极化),被压缩失活(即超极化)。
不同的 JO 神经元
[edit | edit source]一个 JO 神经元通常只靶向 AMMC 的一个区域,而靶向同一区域的神经元位于 JO 内的特征性空间区域 [18]。类似的投射神经元被组织成同心圆环或成对的簇(见图 2A)。
用于声音感知的振动敏感神经元
[edit | edit source]A 和 B 神经元 (AB) 在 19Hz 到 952Hz 之间的接收器振动下被最大程度地激活。这种反应与频率相关。亚组 B 对低频振动表现出更大的反应。因此,亚组 A 负责高频反应。
用于重力和风感知的弯曲敏感神经元
[edit | edit source]C 和 E 对静态接收器弯曲表现出最大的活动。因此,这些神经元提供了有关力方向的信息。它们对触角芒的位移阈值比 AB 神经元更高 [21]。尽管如此,CE 神经元仍可以对触角芒的小位移做出反应(例如,重力):重力使触角芒尖端位移 1 微米(见 [9] 的 S1)。它们还对气流引起的大位移做出反应(例如,风) [21]。C 和 E 区域的神经元对气流方向表现出不同的敏感度,这会导致触角芒在不同方向上发生弯曲。作用于头部前部的气流会在 E 区域引起强烈的激活,而在 C 区域引起微弱的激活。作用于头部后部的气流则显示出相反的结果。作用于头部侧面的气流会在 C 区域引起同侧激活,而在 E 区域引起对侧激活。不同的激活使果蝇能够感知风来自哪个方向。目前尚不清楚相同的 CE 亚组神经元是否介导风和重力检测,或者是否存在对重力检测更敏感的 CE 神经元和对风检测不太敏感的 CE 神经元 [9]。野生型果蝇能够感知重力的一个证明是,果蝇在试管中被摇晃后,会倾向于向上飞行以对抗重力的力矢量(负重力性)。当触角芒被切除时,这种负重力性行为消失,但趋光性行为(果蝇向光源飞行)没有消失。同样地,去除第二节(即 JO 所在位置),负重力性行为再次出现。这表明,当 JO 消失时,果蝇仍然可以通过其他器官感知重力,例如颈部或腿部的机械感受器。这些感受器已被证明在其他昆虫物种中负责重力感知 [22]。
沉默特定神经元
[edit | edit source]可以使用破伤风毒素结合亚组特异性 GAL4 驱动基因和微管-GAL80 选择性地沉默 JO 神经元亚组。后者是温度敏感的 GAL4 阻断剂。利用这种方法可以确认 CE 亚组的神经元负责重力性行为。消除 CE 亚组的神经元不会损害听觉能力 [21]。沉默 B 亚组会损害雄性果蝇对求偶歌声的反应,而沉默 CE 或 ACE 亚组则不会 [9]。由于发现 A 亚组参与听觉(见上文),因此该结果令人意外。从不同的实验中,研究了声音引起的复合动作电位(动作电位的总和),得出的结论是,A 亚组对于求偶雄性发出的微弱歌声所施加的纳米级接收器振动是必需的。
如上所述,JO 神经元的解剖学上不同的亚群具有不同的功能 [9]。这些神经元附着在相同的触角接收器上,但它们在接收器上的相反连接部位有所不同。因此,例如,在向前偏转时,一些神经元会被拉伸,而另一些则会被压缩,从而产生不同的反应特征(相反的钙信号)。振动敏感和偏转敏感神经元的差异可能来自不同的转导分子机制(即适应或不适应通道以及 NompC 依赖性或非依赖性)。声音敏感神经元表达机械转导通道 NompC(无机械感受器电位 C,也称为 TRPN1)通道,而 CE 亚群独立于 NompC [9]。此外,AB 亚群的 JO 神经元转导动态接收器振动,但对静态接收器偏转快速适应(即它们呈相位反应)[23]。CE 亚群的神经元在静态偏转期间显示出持续的钙信号反应(即它们呈紧张反应)。两种不同的行为表明存在具有不同适应特性的转导通道,这在哺乳动物耳蜗或哺乳动物皮肤中也是已知的(即紧张激活的默克尔细胞和快速适应的迈斯纳氏小体)[21]。
A 和 B 亚群的神经元在一侧靶向 AMMC 中的主要听觉中心的区域,而在另一侧靶向腹外侧原脑(VLP)的下部(见图 2B)。这些区域在其自身之间以及与 VLP 之间显示出许多连合连接。对于 CE 亚群的神经元,几乎没有发现其目标区域之间的连合连接,也没有发现与 VLP 的连接。与 CE 亚群区域相关的神经元从胸神经节下降或上升。AB 和 CE 神经元投射的这种差异强烈地提醒了哺乳动物听觉和前庭通路的分离脊椎动物投射 [15]。

蜜蜂的 JO 也位于触角的柄部,用于检测近场声音 [12]。在蜂巢中,一些蜜蜂会进行摇摆舞,据信这种舞蹈会告知同类食物来源的距离、方向和收益率。跟随者必须在蜂巢的黑暗中破译舞蹈的信息,即视觉感知不参与此过程。声音感知是获取舞蹈信息的一种可能方式。跳舞的蜜蜂的声音载波频率约为 260 Hz,是由翅膀振动产生的。蜜蜂有各种机械感受器,例如表皮上的毛发或眼睛上的刚毛。Dreller 等人发现 JO 中的机械感受器负责蜜蜂的声音感知 [12]。尽管如此,当振幅太低而无法振动鞭毛时,毛发传感器仍可能参与检测更远的声音源。Dreller 等人训练蜜蜂将声音信号与蔗糖奖励相关联。训练蜜蜂后,一些蜜蜂的不同机械感受器被去除。然后,再次测试蜜蜂将声音与奖励相关联的能力。操纵 JO 会导致学习技能的丧失。训练可以用 265 Hz 的频率进行,也可以用 10 Hz 的频率进行,这表明 JO 也参与低频听力。只有一根触角的蜜蜂会犯更多错误,但仍然比切除了两根触角的蜜蜂好。每根触角上的两个 JO 可以帮助跟随者计算跳舞的蜜蜂的方向。蜜蜂在其他情况下也可能使用听觉,例如将蜂群聚集在一起。摇摆舞的解码不仅通过听觉感知进行,而且还通过电场感知进行,甚至更多。蜜蜂的 JO 允许检测电场 [24]。如果身体部位一起移动,蜜蜂会在其表皮中积累电荷。昆虫对电场有反应,例如通过改变的运动(Jackson,2011)。表面电荷被认为在授粉中起作用,因为花通常带负电,而到达的花粉带正电荷 [24]。这可以帮助蜜蜂收集花粉。通过训练蜜蜂适应静态和调制电场,Greggers 等人证明蜜蜂可以感知电场 [24]。跳舞的蜜蜂会产生电场,该电场会使鞭毛的运动比仅翅膀振动的机械刺激强 10 倍。蜜蜂鞭毛的振动由 JO 监控,JO 对带电翅膀振动引起的位移幅度有反应。这通过在电场刺激期间记录 JO 轴突的复合动作电位反应来证明。JO 的电场接收在没有触角的情况下无法工作。是否也有其他非触角机械感受器参与电场接收尚未排除。Greggers 等人的研究结果表明,电场(以及 JO)与蜜蜂的社交交流相关。
索顿氏器,如 JO,仅存在于昆虫和甲壳类动物中 [10]。索顿氏神经元是纤毛细胞 [25]。编码功能纤毛所需蛋白质的基因在索顿氏神经元中表达。人类同源基因的突变会导致遗传疾病。了解纤毛发生的机制有助于理解和治疗由人类纤毛形成或功能缺陷引起的疾病。这是因为控制昆虫和脊椎动物神经元特化的过程基于高度保守的转录因子,以下示例说明了这一点:无眼蛋白(Ato)是一种前神经元转录因子,它指定索顿氏器的形成。小鼠直系同源基因 Atoh1 是耳蜗毛细胞发育所必需的。表达突变 Atoh1 表型的聋鼠可以通过果蝇的无眼蛋白基因治愈。研究昆虫中的索顿氏器可以更深入地了解机械感应和纤毛构建。果蝇是一个通用的模型,可以用来研究索顿氏器 [26]。果蝇易于培养且成本低廉,产生大量的胚胎,可以通过多种方式进行基因改造,并且生命周期短,这使得能够在相对较短的时间内研究多个世代。此外,控制发育和生存的大多数基本生物机制和途径在果蝇和其他物种(例如人类)之间是保守的。
尽管一些蜘蛛物种高度发达的视觉系统已经历经数十年的广泛研究,但“动物智力”或“认知”等术语通常不会出现在蜘蛛研究中。相反,蜘蛛传统上被描绘为相当简单的、受本能驱动的动物(Bristowe 1958,Savory 1928),以预编程的方式处理视觉输入,而不是积极地解释从其视觉器官接收到的信息,以做出适当的反应。尽管这似乎仍然是大多数蜘蛛的情况,这些蜘蛛主要通过触觉而不是视觉线索与世界互动,但一些蜘蛛物种却表现出令人惊讶的智能使用它们的眼睛。考虑到其在身体内的有限尺寸,蜘蛛的视觉器官和视觉处理能力极其出色。[27] 近期研究表明,当研究诸如视觉引导的跳蛛(Salticidae)的复杂狩猎方式(跳跃时可达自身身长的30倍)或狼蛛(Lycosidae)识别潜在配偶不对称的能力等主题时,蜘蛛的世界中视觉线索得到了非常复杂的运用。即使是主要依靠其他感觉器官的夜行性杯状蜘蛛(Cupiennius salei,Ctenidae)或通过编织小网并将其投掷到接近的猎物身上在夜间狩猎的食人魔面蛛(Dinopis),其视觉系统仍然高度发达。这些发现不仅令人着迷,而且还激励了其他科学和工程领域,例如机器人技术和计算机引导图像分析。
蜘蛛视觉系统的总体结构
[edit | edit source]
蜘蛛的解剖结构主要由两个主要的身体部分组成,即前体和后体,分别称为头胸部和腹部。所有肢体以及包括眼睛在内的感官器官都位于前体。除了节肢动物的视觉系统以复眼为特征外,现代蛛形纲动物的眼睛是单眼(由覆盖着充满玻璃体液体的凹坑的透镜组成的简单眼睛,在底部有一个视网膜),蜘蛛有六或八个单眼,通常排列成三或四排,横跨前体的外骨骼。总体而言,99% 的蜘蛛有八只眼睛,其余 1% 的蜘蛛几乎都有六只眼睛。只有六只眼睛的蜘蛛缺少“主眼”,下面将详细介绍这些眼睛。
这些眼睛被称为前正中眼(AME)、前侧眼(ALE)、后正中眼(PME)和后侧眼(PLE)。向前看的较大主眼是前正中眼,它们为蜘蛛提供最高的空間分辨率,但视野非常窄。较小的向前看的眼睛是前侧眼,具有中等视野和中等空间分辨率。后两对眼睛是外周的次要眼睛,视野很广。它们极其敏感,适合在低光照条件下使用。蜘蛛利用它们的后侧眼睛来感知运动,而它们的主眼则可以识别形状和物体。与昆虫视觉不同,蜘蛛的基于视觉的大脑几乎完全致力于视觉,因为它只接收视神经,并且仅包含视神经节和一些联想中心。大脑显然能够识别物体运动,但更重要的是,它还能通过观察腿(线条)相对于身体的特定角度来将对手分类为潜在配偶、竞争者或猎物。这种刺激会导致蜘蛛分别表现出求偶或威胁的迹象。
蜘蛛的眼睛
[edit | edit source]虽然蜘蛛的眼睛可以被描述为“照相机眼睛”,但它们在细节上与哺乳动物或任何其他动物的“照相机眼睛”有很大不同。为了将高分辨率的眼睛安装在如此小的身体中,既不是昆虫的复眼,也不是像我们人类一样的球形眼睛,都无法解决这个问题。蜘蛛身上的单眼是光学上更好的解决方案,因为它们的分辨率不受透镜处的折射效应的限制,而这在复眼中会发生。如果用具有相同分辨率的复眼代替蜘蛛的眼睛,它根本无法装入蜘蛛的前体。通过使用单眼,一些蜘蛛的空间视敏度更类似于哺乳动物,而不是昆虫,体型差异很大,只有几千个感光细胞,例如跳蛛的眼睛,而人类视网膜则拥有超过 1.5 亿个感光细胞。
主眼
[edit | edit source]
存在于大多数蜘蛛物种中的前正中眼(AME)也被称为主眼。下图说明了主眼结构及其组成部分的细节,并通过分析跳蛛 Portia(跳蛛科)的 AME 来解释,该物种以其高空间分辨率的眼睛和视觉引导行为而闻名,尽管其体型非常小,只有 4.5-9.5 毫米。
当光束进入主眼时,它首先穿过一个大的角膜透镜。这个透镜具有很长的焦距,能够放大甚至远处的物体。两只主眼角膜透镜的组合视野将覆盖跳蛛前方约 90 度的范围,但是,具有所需精度的视网膜太大,无法装入蜘蛛的眼睛。令人惊讶的解决方案是一个小的、细长的视网膜,它位于一个长而窄的管子和其末端的一个第二个透镜(凹坑)后面。角膜透镜(具有长焦距)和长眼管(放大角膜透镜产生的图像)的这种组合类似于远摄系统,使一对主眼类似于一对双筒望远镜。
跳蛛在四个视网膜受体层上依次捕捉光束,这些受体层彼此相邻(相比之下,人类视网膜仅在一个平面上排列)。这种结构不仅允许在一个有限的区域内容纳更多的感光细胞,而且还能够实现色觉,因为光被透镜系统分成不同的颜色(色差)。因此,不同波长的光会在不同的距离处聚焦,这些距离对应于视网膜层的的位置。跳蛛利用它们的主眼识别绿色(层 1 - 约 580 纳米,层 2 - 约 520-540 纳米)、蓝色(层 3 - 约 480-500 纳米)和紫外线(层 4 - 约 360 纳米),但只有最靠后的两层(层 1 和层 2)由于其紧密的受体间距,能够识别形状和形式。
与人类的眼睛一样,在层 1 中有一个中心区域称为“中央凹”,其中受体间距被测量为约 1 微米。这被发现是最佳的,因为远摄光学系统提供了足够精确的图像,可以以这种分辨率进行采样,但任何更紧密的间距都会由于相邻受体之间的量子级干扰而降低视网膜的采样质量。凭借这样的眼睛,Portia 在视觉锐度方面远远超过了任何昆虫:虽然蜻蜓 Sympetrum striolatus 拥有昆虫中已知最高的锐度(0.4 度),但 Portia 的锐度是其十倍(0.04 度),而眼睛却小得多。人类眼睛的锐度为 0.007 度,仅比 Portia 的锐度高五倍。凭借如此精确的视觉,Portia 从理论上讲能够区分距离 200 毫米处相距 0.12 毫米的两个物体。其他跳蛛眼睛的空间视敏度通常不会比 Portia 差太多。[28][29][30]
主眼视网膜运动
[edit | edit source]对于像跳蛛这样的小动物来说,如此惊人的视觉能力是有代价的:Portia 每只主眼中的视网膜视野只有 2-5 度,而它的中央凹甚至只捕捉到 0.6 度的视野。这是由于主视网膜呈细长的回旋镖形状,垂直跨度约为 20 度,水平跨度仅为 1 度,对应于约六排受体。这种严重的限制通过使用眼部肌肉(跳蛛有六块)来弥补,这些肌肉扫过场景的整个图像,从而将眼管扫过整个图像。这些肌肉附着在主眼管的外部,并允许与人类眼睛相同的三个自由度——水平、垂直和旋转。主视网膜可以水平和垂直移动多达 50 度,并且绕光轴(扭转)旋转类似的量。
能够复杂地利用视觉线索的蜘蛛会自发地移动它们的主眼视网膜,通过“扫视”将中央凹固定在移动的视觉目标上(“跟踪”),或者通过“扫描”来实现,这可能用于模式识别。如今,蜘蛛似乎通过以复杂模式移动眼管来顺序地扫描场景,尽管它们的大脑容量非常有限,但仍能够处理大量视觉信息。
所谓的“微眼跳”,即自发的视网膜运动,被认为是一种机制,可以防止前中眼的光感受器细胞适应静止的视觉刺激。杯状蜘蛛具有 4 块眼肌,分别为两块背肌和两块腹肌,它们会持续进行 2° 到 4° 的背中向微眼跳,持续约 80 毫秒(当固定在支架上时)。2-4° 的微眼跳运动与杯状蜘蛛受体细胞之间的约 3° 角非常吻合,支持了它防止适应功能的观点。相比之下,由机械刺激引起的视网膜运动(将一股气流吹向第二条步足的跗节)可能比自发的视网膜运动大得多,偏转幅度可达 15°。这种刺激会使眼肌活动从静止状态下的 12 ± 1 Hz 自发活动增加到施加气流刺激后的 80 Hz。然而,在这类实验中,两颗主要眼睛的主动视网膜运动永远不会同时激活,两颗眼睛的方向之间也不存在相关性。这两种机制,即自发的微眼跳以及主动视网膜运动带来的主动“凝视”,似乎可以让蜘蛛仅使用主要眼睛有效地追踪和分析静止的视觉目标,而不会通过身体运动加强眼跳运动。
然而,影响蜘蛛眼睛视觉能力的另一个因素是保持不同距离物体聚焦的问题。在人类的眼睛中,这是通过调节来解决的,即改变晶状体的形状,但跳蛛则采用不同的方法:它们视网膜第 1 层的受体排列在“阶梯”上,距离晶状体不同。因此,任何物体的图像,无论是距离眼睛几厘米还是几米,都将在第 1 层阶梯的某一部分上聚焦。此外,跳蛛可以在不移动角膜晶状体的情况下左右摇动眼管,从而将每只视网膜的阶梯在角膜晶状体的图像上扫描,依次获得物体的清晰图像。
由此产生的视觉性能令人印象深刻:跳蛛,例如波提亚跳蛛,可以准确地聚焦 2 厘米到无限远之间的物体,在实践中能够看到大约 75 厘米。然而,由于需要复杂扫描过程才能从如此小的眼睛捕捉到高质量的图像,识别物体的所需时间相对较长(似乎在 10-20 秒范围内)。由于这个限制,像波提亚跳蛛这样的蜘蛛很难快速识别更大的捕食者,因为捕食者的体型较大,使得这种小型蜘蛛很容易成为鸟类、青蛙和其他捕食者的猎物。[31][32]
模糊视觉用于距离估计
[edit | edit source]一项意想不到的发现最近让研究人员感到惊讶,他们发现跳蛛使用一种叫做模糊视觉的技术来估计它们在跳跃前与之前识别的猎物之间的距离。人类通过双眼视觉实现深度感知,而其他动物则通过左右移动头部或测量超声波响应来实现深度感知,跳蛛则在它们的主要眼睛内执行这项任务。与其他跳蛛物种一样,阿达松跳蛛的主要眼睛具有四层视网膜,其中最底部的两层具有对绿色脉冲做出反应的光感受器。然而,由于绿色光线距离内部晶状体较远,因此只能在最底部的第 1 层上清晰聚焦。第 2 层会接收聚焦的蓝色光线,但这些光感受器细胞对蓝色不敏感,而是接收模糊的绿色图像。有趣的是,模糊程度取决于物体与蜘蛛眼睛的距离——物体越近,它在第二层视网膜上看起来越模糊。与此同时,由于第一层视网膜具有阶梯结构,因此始终接收清晰的图像。因此,跳蛛能够通过比较两个最底层视网膜图像来使用一只静止的眼睛估计深度。这一点得到了证实,即让蜘蛛在充满绿色光线的竞技场中跳跃攻击猎物,而在相同亮度的红色光线下则不能。如果没有使用绿色视网膜层的能力,跳蛛会反复无法准确判断距离,错过跳跃。
次要眼睛
[edit | edit source]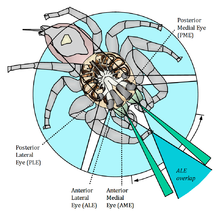
与负责物体分析和识别的主要眼睛不同,蜘蛛的次要眼睛充当运动检测器,因此没有眼肌来更广泛地分析场景。根据它们在蜘蛛甲壳上的排列方式,次要眼睛使动物能够拥有全景视野,几乎可以检测到身体周围 360° 的移动物体。前外侧眼和后外侧眼(即次要眼睛)只具有单一类型的视觉细胞,对波长约为 535-540 纳米的绿色光具有最大光谱灵敏度。不同蜘蛛科之间甚至同一蜘蛛科内,次要眼睛的数量和排列方式差异很大,其结构也是如此:大型次要眼睛可以包含数千个感光体(视网膜的感光部分),并通过其对光的高灵敏度为猎食者或夜行蜘蛛提供支持,而小型次要眼睛最多包含几百个感光体,只提供基本的运动检测。与主要眼睛(感光体朝向光线)不同,蜘蛛的次要眼睛是倒置的,即它们的感光体背离光线,就像脊椎动物(例如人类的眼睛)一样。例如,在被广泛研究的杯状蜘蛛中的次要眼睛的空间分辨率在水平方向上最大,这使得蜘蛛即使使用次要眼睛也能很好地分析水平运动,而垂直运动在“平坦世界”中可能并不重要。
跳蛛的侧眼反应时间比较慢,约为 80-120 毫秒,这是用一个大小为 3°(受体间角)的方形刺激经过动物眼睛测量得出的。蜘蛛做出反应的最小刺激移动距离为:在 1°/s 的刺激速度下为 0.1°,在 9°/s 的速度下为 1°,在 27°/s 的速度下为 2.5°。这意味着,即使物体以较慢的速度移动只有侧眼受体间角的十分之一,跳蛛的视觉系统也能检测到运动。如果刺激变得更小,仅为 0.5° 的大小,则只有在长时间延迟后才会出现响应,表明它们处于蜘蛛可感知运动的极限。
(夜行)蜘蛛的次要眼睛通常在感光体后面有一个反光层,这是一层将光线反射回受体以提高视觉灵敏度的晶体层。这使得夜间猎食的蜘蛛的眼睛具有 f/0.58 的光圈,即使在超低光照条件下也能捕捉到视觉信息。因此,包含反光层的次要眼睛很容易在夜间被照亮(例如手电筒照射)时暴露蜘蛛的位置。[33][34]
中枢神经系统和大脑中的视觉处理
[edit | edit source]就像神经科学的任何领域一样,我们对蜘蛛的中枢神经系统(CNS)知之甚少,特别是在它在视觉控制行为中的作用方面。在所有蜘蛛中,对杯状蜘蛛的 CNS 研究最为广泛,主要集中在 CNS 结构方面。迄今为止,我们对杯状蜘蛛中枢神经元的电生理特性知之甚少,对于其他蜘蛛在这方面的了解就更少了。
蜘蛛神经系统的结构与其身体的细分密切相关,但神经组织并没有分散在整个身体中,而是高度集中和集中化。CNS 由两对相当简单的 нервные клетки 簇(神经节)组成,这些神经节通过神经与蜘蛛的肌肉和感觉系统相连。大脑是由这些神经节融合在口前和口后头节中形成的,并充满着大量的 нервные клетки 组织,而腹部不存在神经节。从蜘蛛的大脑来看,它只接收来自一个感觉系统的直接输入,即眼睛——这与任何昆虫和甲壳类动物不同。八根视神经从正面进入大脑,它们的信号在脑前部的两个视叶中被处理。当蜘蛛的行为特别依赖于视觉时,就像跳蛛一样,视神经节占据了大脑体积的 31%,表明大脑几乎完全致力于视觉。这个比例在杯状蜘蛛中仍高达 20%,而其他蜘蛛,如金丝蛛和树皮蛛,只有 2%。
主要眼睛和次要眼睛之间的区别在脑中仍然存在。这两种类型的眼睛都有自己的视觉通路,有两个独立的神经纤维区域,执行不同的任务。因此,蜘蛛明显地并行处理两种眼睛类型提供的视觉信息,次要眼睛专门用于检测物体的水平运动,而主要眼睛用于检测形状和纹理。
虽然主要和次要视觉在蜘蛛的大脑中似乎是不同的,但两个视觉系统之间的惊人相互关系也是众所周知的。在视觉实验中,当遮盖主要或次要眼睛时,测量了捕鸟蛛主要眼睛肌肉的活动。当用移动的黑色短条序列刺激白色竞技场中的动物时,只要次要眼睛检测到其视野内的运动,主要眼睛就会不由自主地移动。与没有呈现刺激相比,主要眼部肌肉的这种活动增加不会在用黑色油漆覆盖主要眼睛时发生变化,但如果遮蔽次要眼睛,这种活动就会停止。因此现在很清楚,只有从次要眼睛接收到的输入控制着主要眼睛肌肉的活动。此外,蜘蛛的主要眼睛似乎不参与运动检测,这仅仅是次要眼睛的责任。
其他使用双通道遥测记录捕鸟蛛眼部肌肉活动的实验表明,蜘蛛主动注视着行走方向:主要眼睛的同侧视网膜在转弯之前、期间和之后相对于行走方向发生偏移,而对侧视网膜则保持在静止位置。这与实际的光照条件无关,表明这是由蜘蛛的大脑发起的“自愿”注视。

跳蛛被认为是通过对视觉区域的扫描过程来识别形状和形式的,该过程包括一组复杂的旋转(扭转运动)和前正中眼部视网膜的平移。正如“主要眼睛视网膜运动”部分所述,蜘蛛的视网膜很窄,形状像回旋镖,可以通过扫过视觉场景与直线特征相匹配。当调查一个新的目标时,眼睛会以一种定型的方式扫描它:通过以每秒 3-10° 的速度缓慢地从一侧移动到另一侧,并旋转 ± 25°,水平和扭转视网膜运动允许检测不同位置和旋转的线。这种方法可以理解为模板匹配,其中模板具有细长的形状,并且只要视网膜与场景中的直线特征匹配,就会产生强烈的神经反应。这识别了一条直线,几乎不需要任何进一步的处理。
一种将直线检测作为优化问题的计算机视觉算法(da Costa,da F. Costa)受到跳蛛视觉系统的启发,并使用相同的方法,即使用模板匹配顺序扫描场景。虽然众所周知的霍夫变换允许在图像中鲁棒地检测直线视觉特征,但由于在搜索线时需要计算参数空间的很大一部分甚至全部,因此其效率受到限制。相反,跳蛛视觉系统中使用的另一种方法建议使用线性窗口搜索视觉空间,这允许在直线搜索过程中使用自适应搜索方案,而无需系统地计算参数空间。此外,以这种方式解决直线检测问题使其成为一个优化问题,这使得计算机能够进行有效地处理。虽然需要通过实验找到控制基于退火的扫描的适当参数,但采用跳蛛直线检测路径的方法被证明非常有效,尤其是在正确设置参数的情况下。[35]

捕鸟蛛已被证明具有区分略微不同的视觉目标的能力,尽管该物种在捕食或交配行为中主要依靠其机械感觉系统。当将两个目标呈现在距离蜘蛛 2 米处时,其行走路径取决于其视觉外观:当必须在两个相同的目标(如垂直条)之间进行选择时,捕鸟蛛没有表现出任何偏好。但是,该动物强烈偏好垂直条而不是倾斜条或 V 形目标。
不同目标的辨别已被证明只有在主要眼睛未遮盖的情况下才有可能,而蜘蛛能够使用任何眼睛检测目标。这表明许多蜘蛛的前外侧(次要)眼睛能够完成比简单物体运动检测更多的功能。当所有眼睛都被遮盖时,蜘蛛会表现出完全无方向的行走路径。
然而,将捕鸟蛛放置在完全黑暗中不仅会导致无方向的行走,还会引起步态的变化:蜘蛛不会使用所有八条腿,而只会用六条腿行走,并将第一条腿用作触角,类似于盲人的拐杖。为了感知周围环境,伸出的前肢会上下左右移动。这仅针对第一对腿,仅受视觉输入的影响,当普通房间灯光切换到不可见的红外光时,就会发生这种情况。
跳蛛在用眼睛检测到运动后的行为取决于三个因素:目标的大小、速度和距离。如果它的大小是蜘蛛的两倍以上,则不会靠近该物体,如果该物体向它移动,蜘蛛会试图逃脱。如果目标大小合适,则会使用次要眼睛视觉分析其速度。速度超过 4°/s 的快速移动目标会受到跳蛛的追逐,并由其前外侧眼睛引导。会仔细地靠近速度较慢的物体,并用前正中(即主要)眼睛进行分析,以确定它是猎物还是同一物种的另一只蜘蛛。这似乎是通过应用上述直线检测来实现的,以找出视觉目标是否有腿。虽然跳蛛已被证明只要物体移动就会靠近具有适当特征的潜在猎物,但雄性在决定其当前的配偶是否可能是潜在的伴侣时会更加挑剔。
实验表明,中心点周围有类似腿的附属物的图纸会导致求爱展示,这表明跳蛛使用视觉特征提取来检测目标中线性结构的存在和方向。此外,蜘蛛对被认为是同种蜘蛛的行为取决于不同的因素,例如两只参与蜘蛛的性别和成熟度,以及是否是交配时间。雌性狼蛛(Schizocosa ocreata)在选择伴侣时甚至能辨别雄性次要性征的非对称性,可能是为了避免后代出现发育不稳定。雄性前肢上醒目的毛簇,用于视觉求爱信号,似乎会影响雌性的伴侣选择,而这些身体部位的非对称性则会导致腿部损失和再生,显然会降低雌性对这些雄性蜘蛛的接受度。[36]
跳蛛在猎捕昆虫猎物时的潜行行为类似于猫潜行捕鸟。如果次要眼睛的视野内有东西在移动,它们就会启动转动,将更大、面向前方的一对主要眼睛移至适当位置,以便将物体的形状分类为配偶、对手或猎物。即使是非常小的、低对比度的点刺激,以慢速或快速的速度移动,也会引起这种定向行为。与捕鸟蛛一样,跳蛛也能够使用它们的次要眼睛完成比运动检测更复杂的任务:向跳蛛呈现视觉猎物线索,只有次要眼睛的视觉信息可用,而两只主要眼睛被遮盖,会导致动物表现出完整的狩猎序列。这表明跳蛛的前外侧眼睛可能是其视觉系统中最通用的部分。除了检测运动之外,次要眼睛显然还具有足够好的空间辨别能力,可以指导完整的视觉引导狩猎序列。
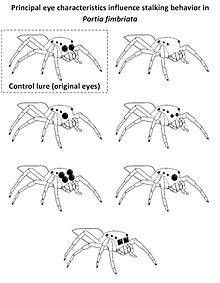
视觉线索在跳蛛(跳蛛科)利用主要视力区分跳蛛科猎物和非跳蛛科猎物时也起着重要作用。为此,跳蛛科猎物的大型主要眼睛提供了关键线索,跳蛛 Portia fimbriata 会对这些线索做出反应,在攻击前表现出隐秘的潜行策略(非常缓慢地行走,触须收缩,面对猎物时会冻结)。这种行为只在识别猎物为跳蛛科时才会使用。在实验中,向 Portia fimbriata 展示了经过修改的主要眼睛的计算机渲染的逼真三维诱饵,利用了这一点。虽然完整的虚拟诱饵会导致隐秘的潜行,但没有主要眼睛或主要眼睛比平时小的诱饵(如右图所示)会引发不同的行为。向虚拟的跳蛛科猎物展示只有单眼或两个放大的次要眼睛的普通诱饵,会引发隐秘的潜行行为,表明成功识别了跳蛛科,而 P. fimbriata 面对独眼怪诱饵(单眼位于两个次要眼睛之间)时,冻结的频率较低。具有方形边缘的主要眼睛的诱饵通常不会被归类为跳蛛科,表明主要眼睛边缘的形状是识别同类跳蛛科的重要线索。[37]

在对 Phidippus 属蜘蛛进行的一项研究中,研究人员在障碍物开口的另一侧放置了视觉目标,以测试蜘蛛穿越不适宜的开放空间的意愿。研究发现,蜘蛛是否冒险穿越空旷的地面主要取决于诸如目标距离、目标相对大小与距离之比以及目标颜色和形状等因素。在独立的测试运行中,蜘蛛移动到高远的目标的频率与移动到矮近的目标的频率相同,这两个物体在蜘蛛的视网膜上看起来大小相同。当提供选择移动到白色或绿色草状目标的选择时,蜘蛛始终选择绿色目标,无论其与背景的对比度如何,从而证明了它们在狩猎情境中使用颜色辨别的能力。[38]
Psecas chapoda(一种生活在凤梨科植物上的跳蛛)能够通过视觉分析寄主植物叶片和莲座的结构特征来检测有利的微生境,研究人员向它们展示了经过处理的真实植物和植物照片。通过使用黑白照片,在研究中可以排除其他线索(如颜色和气味)对蜘蛛选择寄主植物的潜在影响,只留下形状和形式作为辨别特征。即使仅根据照片做出决定,Psecas chapoda 也始终偏好莲座状植物(龙舌兰科),其叶片窄而长,而不是其他类型的植物,这证明某些蜘蛛物种能够仅根据植物性状的视觉线索(形状)来评估和区分微生境的物理结构。[39]
- ↑ K. Gammon, Life’s Little Mysteries (http://www.lifeslittlemysteries.com/1647- smartest-non-primates.html) . TechMediaNetwork.
- ↑ G. S. et al., Control of Octopus Arm Extension by a Peripheral Motor Program . Science 293, 1845, 2001.
- ↑ Y. Gutfreund, Organization of octopus arm movements: a model system for study- ing the control of flexible arms. Journal of Neuroscience 16, 7297, 1996.
- ↑ P. Graziadei, The anatomy of the nervous system of Octopus vulgaris, J. Z. Young. Clarendon, Oxford, 1971.
- ↑ M. J. Wells, The orientation of octopus. Ergeb. Biol. 26, 40-54, 1963.
- ↑ J. L. Fox and T. L. Daniel (2008), "A neural basis for gyroscopic force measurement in the halteres of Holorusia.", J Comp Physiol, 194: 887–897
- ↑ a b Rhoe A. Thompson (2009), "Haltere Mediated Flight Stabilization in Diptera: Rate Decoupling, Sensory Encoding, and Control Realization.", PhD thesis, University of Florida
- ↑ a b J. W. S. Pringle (1948), "The gyroscopic mechanism of the halteres of diptera.", Phil Trans R Soc Lond B, 233 (602): 347–384
- ↑ a b c d e f g h i Kamikouchi A, Inagaki HK, Effertz T, Hendrich O, Fiala A, Gopfert MC, Ito K (2009). "The neural basis of Drosophila gravity-sensing and hearing". Nature. 458 (7235): 165–171.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c d Yack JE (2004). "The structure and function of auditory chordontonal organs in insects". Microscopy Research and Technique. 63 (6): 315–337.
- ↑ Johnston, Christopher. 1855. Original Communications: Auditory Apparatus of the Culex Mosquito
- ↑ a b c Dreller C and Kirchner WH (1993). "Hearing in honeybees: localization of the auditory sense organ". Journal of Comparative Physiology A. 173: 275–279.
- ↑ McIver, S.B. 1989. Mechanoreception, In Comprehensive Insect Physiology, Biochemistry, and Pharmacology. Pergamon Press. 1989, Vol. 6, pp. 71-132.
- ↑ Keil, Thomas A. 1999. Chapter 1 - Morphology and Development of Peripheral Olfactory Organs. [book auth.] B.S. Hansson. Insect Olfaction. s.l. : Springer, 1999, pp. 5-48
- ↑ a b c d e Jarman, Andrew P. 2014. Chapter 2 - Development of the Auditory Organ (Johnston's Organ) in Drosophila. Development of Auditory and Vestibular Systems (Fourth Edition). San Diego : Academic Press, 2014, pp. 31-61
- ↑ Baker, Dean Adam and Beckingham, Kathleen Mary and Armstrong, James Douglas. 2007. Functional dissection of the neural substrates for gravitaxic maze behavior in Drosophila melanogaster. Journal of Comparative Neurology. 2007, Vol. 501, 5, pp. 756-764
- ↑ Nadrowski, Björn 和 Albert, Jörg T. 以及 Göpfert, Martin C (2008). "基于换能器的力生成解释了果蝇听觉中的主动过程". 当代生物学. 18 (18): 1365–1372.
{{cite journal}}: CS1 维护:作者列表中有多个名称 (link) - ↑ a b c Kamikouchi A, Shimada T 和 Ito K (2006). "果蝇黑腹果蝇脑中听觉感觉投射的全面分类". J. 比较神经. 499 (3): 317–356.
- ↑ Tauber, Eran 和 Eberl, Daniel F. 2003. 果蝇的声学交流. 行为过程. 2003, 第 64 卷, 第 2 期, 第 197-210 页
- ↑ Baker, Dean Adam 和 Beckingham, Kathleen Mary 和 Armstrong, James Douglas. 2007. 果蝇黑腹果蝇重力迷宫行为神经基础的功能性解剖. 比较神经学杂志. 2007, 第 501 卷, 第 5 期, 第 756-764 页
- ↑ a b c d e Yorozu S, Wong A, Fischer BJ, Dankert H, Kernan MJ, Kamikouchi A, Ito K 和 Anderson DJ (2007). "果蝇脑中风和近场声音的不同感觉表征". 自然. 458 (7235): 201–205.
{{cite journal}}: CS1 维护:作者列表中有多个名称 (link) - ↑ Beckingham, Kathleen M. 和 Texada, Michael J. 以及 Baker, Dean A. 以及 Munjaal, Ravi 和 Armstrong, J. Douglas. 2005. 动物的重力感知遗传学. 学术出版社. 2005, 第 55 卷, 第 105-145 页
- ↑ Nadrowski, Björn 和 Albert, Jörg T. 以及 Göpfert, Martin C. 2008. 基于换能器的力生成解释了果蝇听觉中的主动过程. 当代生物学. 2008, 第 18 卷, 第 18 期, 第 1365-1372 页
- ↑ a b c Greggers U, Koch G, Schmidt V, Dürr A, Floriou-Servou A, Piepenbrock D, Göpfert MC 和 Menzel R (2013). "蜜蜂对电场的接收和学习". 英国皇家学会学报B: 生物科学. 280: 1759.
{{cite journal}}: CS1 维护:作者列表中有多个名称 (link) - ↑ Kavlie, Ryan G. 和 Albert, Jörg T. 2013. 索顿器官. 当代生物学. 2013, 第 23 卷, 第 9 期, 第 334-335 页
- ↑ Jennings, Barbara H. 2011. 果蝇,生物学和医学中的通用模型. 材料今日. 2011, 第 14 卷, 第 5 期, 第 190-195 页
- ↑ F. G. Barth: 蜘蛛的世界:感觉和行为. ISBN 978-3-642-07557-5, 施普林格出版社柏林,海德堡. (2002)
- ↑ D. P. Harland, R. R. Jackson: '八条腿的猫' 以及它们如何看到 - 对跳蛛 (Araneae: Salticidae) 的最新研究综述. 坎特伯雷大学动物学系 (2000)
- ↑ A. Schmid: 蜘蛛 杯状腹毛蛛 (Cupiennius salei) 不同眼类型的不同功能. 实验生物学杂志 201, 221–225 (1998)
- ↑ S. Yamashita, H. Tateda: 跳蛛眼睛的光谱敏感度. J. comp. Physiol. 105, 29-41 (1976)
- ↑ D. P. Harland, R. R. Jackson: 虚拟猎物前内侧眼线索对食蛛跳蛛 (Portia fimbriata) 的影响. 实验生物学杂志 205, 1861–1868 (2002)
- ↑ A. Schmid, C. Trischler: 自由行走的蜘蛛的主动感官: 看哪里去. 昆虫生理学杂志 57 第 494–500 页 (2011)
- ↑ D. B. Zurek, X. J. Nelson: 跳蛛侧眼的超敏运动检测. 视觉研究 66 第 26–30 页 (2012)
- ↑ D. B. Zurek, A. J. Taylor, C. S. Evans, X. J. Nelson: 前侧眼在基于视觉的跳蛛行为中的作用. 实验生物学杂志 213, 2372-2378 (2010)
- ↑ F. M. G. da Costa, L. da F. Costa: 直线检测作为优化问题: 一种受跳蛛视觉系统启发的思路. 在: 生物启发的计算机视觉, 第一个 IEEE 国际研讨会, BMVC 2000, 韩国首尔 (2000)
- ↑ G.W. Uetz, E. I. Smith: 视觉信号特征的不对称性以及狼蛛的性选择. Behav Ecol Sociobiol (1999) 45: 87–93
- ↑ D. P. Harland, R. R. Jackson: 虚拟猎物前内侧眼线索对食蛛跳蛛 (Portia fimbriata) 的影响. 实验生物学杂志 205, 1861–1868 (2002)
- ↑ R. R. Jackson, D. P. Harland: 对跳蛛来说只是一小步,但对视觉科学来说是巨大的一步. 实验生物学杂志, JEB 经典 第 2129-2132 页
- ↑ P. M. de Omena 和 G. Q. Romero: 利用微生境特征的视觉线索寻找家园: 凤梨跳蛛 (Salticidae) 的案例研究. 行为生态学 21:690–695 (2010)







![{\displaystyle {{e}_{ij}}(t)=\int \limits _{0}^{t}{d{t}'}\,G(t-{t}')\left[S_{i}^{LMAN}(t)-\left\langle S_{i}^{LMAN}\right\rangle \right]\,\,S_{ij}^{HVC}(t)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b43f62b81c13062636c5d924a6ca0aa129f13fd8)







