结构生物化学/内吞作用期间的肌动蛋白组装

肌动蛋白是一种蛋白质复合物,构成细胞骨架的主要部分。肌动蛋白的球状部分(G-肌动蛋白)结合在一起,形成长而细的 F-肌动蛋白微丝。F-肌动蛋白微丝以双螺旋形式呈双链结构。肌动蛋白相关蛋白 (Arp2/3) 复合物促进称为成核的过程,即形成新的肌动蛋白微丝分支。子丝以 Y 形从母丝伸出,预期角度约为 70 度。观察到肌动蛋白具有许多不同的功能,例如肌肉收缩、维持细胞形状、细胞的运动性、细胞的分裂以及细胞信号传导。这里感兴趣的功能是肌动蛋白在内吞作用的许多步骤中的作用。
内吞作用是细胞通过用细胞膜本身形成的囊泡吞噬物质来吸收物质的方法。内吞作用有不同的类型:网格蛋白介导、气泡、巨胞饮和吞噬作用。哺乳动物中最了解的方法是网格蛋白介导的内吞作用 (CME)。网格蛋白是胞质溶胶中的蛋白质成分,它有助于在细胞膜内侧形成包被坑。这个坑芽形成网格蛋白包被囊泡 (CCV),这是这种形式的内吞作用的特征。在哺乳动物中,人们了解到肌动蛋白在 CME 过程中通过帮助在囊泡颈部掐断起作用。
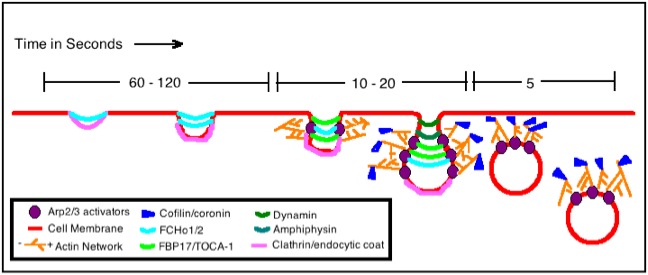
该图显示了一个基本的肌动蛋白组装模型,该模型特别有助于哺乳动物细胞的内吞作用,尽管酵母肌动蛋白组装模型非常相似。在酵母中,已经证明肌动蛋白始终是内吞作用所必需的,但这种哺乳动物内吞作用仅在特定条件下需要肌动蛋白:例如,当细胞摄入的物质非常大或内吞作用的部位已经富含肌动蛋白微丝时。
这个特定模型是针对网格蛋白介导的内吞作用过程中的肌动蛋白组装。网格蛋白和其他特定接头蛋白(FCHo1/2 和 FBP17/TOCA-1)首先开始在这个过程中使细胞膜弯曲。然后引入复合物 Arp2/3,其目的是调节肌动蛋白丝成核。肌动蛋白丝通过聚合继续生长,并且该过程在肌动蛋白的刺突末端有助于迫使囊泡颈部伸长。整个囊泡内陷变长,最终在额外的双端蛋白和动力蛋白的帮助下发生膜裂变。最后,在内吞作用工作完成且囊泡位于细胞内部后,使用蛋白 cofflin 和 coronin 来分解肌动蛋白丝。内吞作用过程中细胞膜内陷、伸长和裂变的整个过程是由这些肌动蛋白丝的形成和随后的推动作用介导的。
使用光学显微镜和电子显微镜的技术和方法的改进对于增进对分子机制的理解非常重要。荧光蛋白,尤其是绿色荧光蛋白 (GFP),使人们能够研究单个成分并跟踪内吞结构的运动。pHluorin 作为 GFP 衍生物的开发对 pH 水平的荧光敏感。它是一个用于标记内吞囊泡从质膜裂解时间的有用工具。共聚焦显微镜(激光扫描和旋转盘)的开发以及全内反射荧光显微镜的实施为信噪比提供了巨大的改进。这提高了对微弱荧光信号的可视化。电子显微镜取得了进步,特别是在可视化网格蛋白组装体和肌动蛋白丝的能力方面。这得益于冷冻蚀刻、铂复制和断层扫描方法的使用。通过与细胞中的标准进行比较,可以将 GFP 荧光的定量测量转换为分子的绝对数量。计算机跟踪这些单个实体,例如内吞囊泡和富含网格蛋白的位点,提供关于其荧光强度的數據。计算机已经能够分析数百到数千个这些实体。
我们对肌动蛋白在内吞作用过程中的作用的大部分知识来自对酵母而非哺乳动物中该过程的探索。因此,哺乳动物中的过程和肌动蛋白微丝的真实性质在很大程度上是未知的。出现了一些重要的进一步问题,例如确定肌动蛋白在内陷颈部引起囊泡裂变的力是如何产生的以及在何处产生的。另一个潜在的兴趣领域是发现为什么肌动蛋白并非总是哺乳动物内吞作用过程所必需的。了解细胞如何发出其对肌动蛋白的需求信号以及导致这种肌动蛋白组装的精确信号传导过程将非常有用。总的来说,必须继续在哺乳动物细胞中研究这个过程,以获得更多关于肌动蛋白在细胞中的功能的知识。
Mooren, Olivia L., Brian J. Galletta, and John A. Cooper. "Roles for Actin Assembly in Endocytosis." Annual Review of Biochemistry (2012): 661-86. Biochemistry. Annual Reviews, 2012. Web. 6 Dec. 2012. <http://ucelinks.cdlib.org:8888/sfx_local?sid=Entrez:PubMed&id=pmid:22663081>.
Akin , O. and Mullins , R. D. Capping Protein Increases the Rate of Actin-Based Motility by Promoting Filament Nucleation by the Arp2/3 Complex. Cell 133, 841–851 (2008). doi: 10.1016/j.cell.2008.04.011
McPherson PS, Ritter B, Wendland B. Clathrin-Mediated Endocytosis. In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-. Available from: http://www.ncbi.nlm.nih.gov/books/NBK6479/