结构生物化学/细胞凋亡
细胞凋亡是发育过程中和清除细胞的正常过程。这些细胞可能发展成癌细胞。
细胞凋亡是细胞程序性死亡。它自然发生在多细胞生物体中,用于调节死亡细胞。细胞凋亡每天都在人类体内发生,每天自然摧毁 20 到 700 亿个细胞,这些细胞最终被更新的细胞取代。
在细胞凋亡过程中,细胞会
- 收缩
- 在它们的表面形成气泡状的囊泡
- 使它们细胞核中的染色质降解
- 使它们的线粒体分解并释放细胞色素 c
- 分解成小的、膜包裹的片段
- 释放 ATP 和 UTP
- 它们的核苷酸会与吞噬细胞上的受体结合,这将作为吸引垂死细胞的信号
- 磷脂磷脂酰丝氨酸将在表面暴露
- 暴露的磷脂将作为“吞噬我”的信号,这将诱导吞噬细胞吞噬细胞片段
- 吞噬细胞分泌抑制炎症的细胞因子
这种有序的事件模式被称为程序性细胞死亡,也称为细胞凋亡。[1]
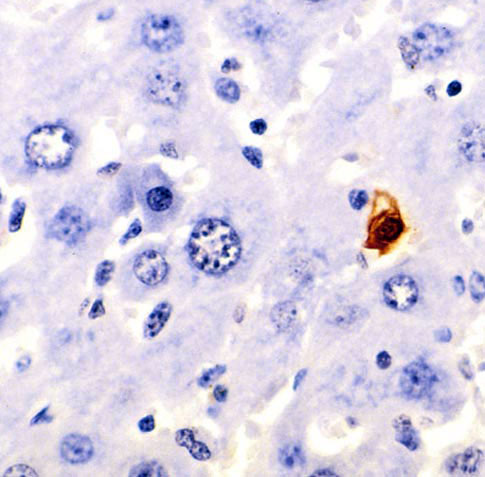
细胞凋亡是由德国科学家卡尔·沃格特发现的,他首次详细描述了细胞凋亡的过程。这一发现后来被沃尔特·弗莱明给出了更精确的定义。自 1990 年代以来,细胞凋亡开始更加主流,并得到更多研究。它真正始于 1960 年代,当时人们在显微镜下观察到它正在发生。下面的图片是小鼠肝脏细胞,被染色的细胞正在经历细胞凋亡。
由于细胞凋亡的途径非常长,如果一个生化反应没有完成,它最终会导致细胞无法死亡并继续在生物体中造成破坏。如果细胞没有经历它们生命周期中的这个自然阶段,它们最终会导致疾病和/或疾病。这个问题可以与癌症的产生联系起来,因为一个功能失调的细胞能够复制并传递任何不良的细胞器或不正确的 DNA 序列。
下面是来自维基共享资源的一张图片,简要地展示了细胞凋亡在细胞中发生的过程的示意性图形
细胞凋亡是在线虫中研究的,在其细胞死亡的最后阶段,人们发现死亡诱导蛋白酶 CED-3 的激活是细胞凋亡的原因。为了调节这些蛋白酶,人们发现 CSP-3 可以阻止 CED-3 自激活,并最终减少线虫发育阶段的细胞凋亡迹象。CSP-3 是一种半胱天冬酶同源物,仅在体细胞中起作用。因此,生殖细胞不受 CSP-3 的影响。
- 细胞凋亡对于身体部位的正常发育和形成是必需的。例如,胎儿的手指和脚趾的形成是通过它们之间的组织的细胞凋亡而实现的。
- 细胞凋亡需要破坏对生物体整体福祉构成威胁的细胞。例如,破坏具有受损 DNA 的细胞。
- 存在积极信号的撤回。细胞需要从其他细胞中接收持续的刺激、积极信号,或者需要持续粘附到表面才能存活。
例如:神经元生长因子的撤回会导致细胞凋亡,因为生长因子充当积极信号,对于细胞发育至关重要
- 存在负面信号的接收。
例如:细胞内氧化剂的增加或错误折叠蛋白的积累。
细胞凋亡有 3 种不同的机制。
- 在健康的细胞中,Bcl-2 蛋白显示在线粒体外膜的表面。这种蛋白抑制细胞凋亡。
- 细胞的内部损伤会导致 Bax 蛋白迁移到线粒体表面,抑制 Bcl-2 的作用,并粘附在线粒体外膜表面。Bax 在线粒体外膜上打孔,导致细胞色素 c 溢出。
- 细胞色素 c 利用 ATP 提供的能量,并继续与 Apaf-1 (“凋亡蛋白酶激活因子-1”) 蛋白结合。
- 细胞色素 c 与 Apaf-1 的结合形成凋亡体。
- 凋亡体与 caspase-9 结合并激活它。Caspase-9 是一种切割蛋白质的蛋白酶。
- 当 caspase-9 切割蛋白质时,它会激活来自其家族的其他 caspase。例如,caspase-3 和 caspase-7。
- caspase 的激活会产生一系列蛋白水解活性。这些蛋白水解活性会导致细胞质中结构蛋白的消化、染色体 DNA 的降解以及细胞的吞噬作用。[2]
- 膜整合蛋白,如 Fas 和 TNF 受体,在细胞表面暴露受体。
- 与互补的死亡激活剂(如 FasL 和 TNF)结合,会向细胞质发送信号,导致 caspase-8 的激活。
- 与 caspase-9 相似,caspase-8 会激活一系列蛋白水解活性,最终导致细胞的吞噬作用。[3]
- 神经元在不使用 caspase 的情况下经历细胞凋亡。
- AIF 是一种位于线粒体膜间隙的蛋白质。
- 当细胞接收到死亡信号时,从线粒体释放的 AIF 会迁移到细胞核中并与 DNA 结合,然后触发 DNA 的破坏。
- 除了程序性细胞死亡外,AIF 在健康细胞中也起着重要的线粒体作用。“AIF 的一部分在凋亡功能中是可有可无的,它携带一个 NADH 氧化酶域,该域调节呼吸链复合物 I,对于细胞存活、增殖和线粒体完整性是必需的。”[4]
最近利用突变小鼠进行的研究有助于理解 AIF 的线粒体功能。例如,AIF 缺陷小鼠被用作复杂 I 缺陷模型,显示出线粒体代谢的普遍重编程。[5] 在人类中,复杂 I 缺陷导致超过 30% 的线粒体疾病,[6] 主要影响婴儿,表现出各种症状,如癫痫发作、失明、失聪、共济失调、认知缺陷、肌病和心肌病。
研究表明,AIF 的未表征剪接异构体,其组织和细胞类型特异性表达模式可能是 AIF 缺陷中某些组织特异性效应的原因。此外,无法检测到 AIF 突变可能导致 AIF 缺陷的胚胎致死性,这在突变小鼠中观察到。[7]
研究还表明,AIF 表达量减少 80% 允许小鼠发育 Hq,并由于加剧的复杂 I 缺陷而影响成年动物的健康。[8]
突变小鼠被用于研究 AIF 在细胞存活、增殖和代谢中的作用。如果 AIF 的存在水平较低,它不会影响 Hq 突变的遗传,并且在表现出生长迟缓方面没有重大影响。随着时间的推移,AIF 水平的降低会对衰老成年小鼠的健康产生重大影响。[9] AIF 的完全丧失会导致子宫内发育不相容,并且由于同源重组失败而倾向于导致 AIF 零小鼠。[10]
- 某些身体部位,如睾丸和眼球前房,不受抗原入侵的影响。事实证明,这些细胞以高速度产生 FasL,因此,产生 Fas 的抗原在进入这些部位后立即会被杀死。
- 这一发现将极大地帮助移植接受者,因为如果能够有效地将人工细胞插入移植器官中,这些细胞会以高水平产生 FasL,移植器官将不太容易受到宿主机体细胞介导的免疫系统的攻击。
- 到目前为止,已经对动物进行了临床试验。合成表达 FasL 的同种异体移植已显示出肾脏的存活率提高,但心脏的存活率没有提高。
- 植物也会经历程序性细胞死亡。凋亡可能帮助植物阻止病毒感染的扩散。
- 植物凋亡的机制也涉及 caspase,它在 Asp 残基处切割。然而,caspase 的激活会破坏中央液泡,进而分解细胞的其余部分,而不是 DNA。
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/A/Apoptosis.html
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/caspase9.png
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/CTL_Fas.gif
- ↑ Hangen, Emilie; Blomgren, Klas; Bénit, Paule; Kroemer, Guido; Modjtahedi, Nazanine (2010). "Life with or without AIF". Trends in Biochemical Sciences. 35 (5): 278–87. doi:10.1016/j.tibs.2009.12.008. PMID 20138767.
- ↑ Pospisilik, J. Andrew; Knauf, Claude; Joza, Nicholas; Benit, Paule; Orthofer, Michael; Cani, Patrice D.; Ebersberger, Ingo; Nakashima, Tomoki; Sarao, Renu; Neely, Gregory; Esterbauer, Harald; Kozlov, Andrey; Kahn, C. Ronald; Kroemer, Guido; Rustin, Pierre; Burcelin, Remy; Penninger, Josef M. (2007). "Targeted Deletion of AIF Decreases Mitochondrial Oxidative Phosphorylation and Protects from Obesity and Diabetes". Cell. 131 (3): 476–91. doi:10.1016/j.cell.2007.08.047. PMID 17981116.
- ↑ Koene, S.; Smeitink, J. (2009). "Mitochondrial medicine: Entering the era of treatment". Journal of Internal Medicine. 265 (2): 193–209. doi:10.1111/j.1365-2796.2008.02058.x. PMID 19192036.
- ↑ Vahsen, Nicola; Candé, Céline; Brière, Jean-Jacques; Bénit, Paule; Joza, Nicholas; Larochette, Nathanael; Mastroberardino, Pier Giorgio; Pequignot, Marie O; Casares, Noelia; Lazar, Vladimir; Feraud, Olivier; Debili, Najet; Wissing, Silke; Engelhardt, Silvia; Madeo, Frank; Piacentini, Mauro; Penninger, Josef M; Schägger, Hermann; Rustin, Pierre; Kroemer, Guido (2004). "AIF deficiency compromises oxidative phosphorylation". The EMBO Journal. 23 (23): 4679–89. doi:10.1038/sj.emboj.7600461. PMC 533047. PMID 15526035.
- ↑ Hangen, Emilie; Blomgren, Klas; Bénit, Paule; Kroemer, Guido; Modjtahedi, Nazanine (2010). "有或无 AIF 的生命". 生物化学趋势. 35 (5): 278–87. doi:10.1016/j.tibs.2009.12.008. PMID 20138767.
- ↑ Bénit, Paule; Goncalves, Sergio; Dassa, Emmanuel Philippe; Brière, Jean-Jacques; Rustin, Pierre (2008). "小丑鱼表型的变异类似于人类线粒体复合物 I 缺乏症". PLoS ONE. 3 (9): e3208. Bibcode:2008PLoSO...3.3208B. doi:10.1371/journal.pone.0003208. PMC 2527683. PMID 18791645.
- ↑ Joza, Nicholas; Susin, Santos A.; Daugas, Eric; Stanford, William L.; Cho, Sarah K.; Li, Carol Y. J.; Sasaki, Takehiko; Elia, Andrew J.; Cheng, H.-Y. Mary; Ravagnan, Luigi; Ferri, Karine F.; Zamzami, Naoufal; Wakeham, Andrew; Hakem, Razqallah; Yoshida, Hiroki; Kong, Young-Yun; Mak, Tak W.; Zúñiga-Pflücker, Juan Carlos; Kroemer, Guido; Penninger, Josef M. (2001). "线粒体凋亡诱导因子在程序性细胞死亡中的重要作用". 自然. 410 (6828): 549–54. doi:10.1038/35069004. PMID 11279485.